دليل اختيار منتج كواشف نقل الخلايا في المختبر
أصبحت كواشف التحويل الخلوي كواشف روتينية لدراسة ومراقبة وظيفة الجينات في الخلايا حقيقية النواة. تُستخدم كواشف التحويل على نطاق واسع في أبحاث وظيفة الجينات وتنظيم التعبير الجيني وتحليل الطفرات، فضلاً عن العلاج الجيني والعلاج الخلوي وإنتاج البروتين وإنتاج اللقاحات. إذن ما هو التحويل الخلوي؟ وكيف تختار نوع كاشف التحويل بناءً على تجاربك؟
ما هي أنواع النقل الجيني؟
مميزات كواشف النقل الجيني من شركة Yeasen
كيفية اختيار نوع كاشف النقل بناءً على تجاربك؟
حالة التطبيق
مرجع لشروط النقل
الأسئلة الشائعة
قراءة محترمة
ما هي أنواع النقل الجيني؟
وفقًا لما إذا كان الحمض النووي مدمجًا في كروموسوم الخلية المضيفة بعد التحويل، فإنه ينقسم إلى "مؤقت" (التحويل المؤقت) و"مستقر" (التحويل المستقر). تختلف كفاءة التحويل، والسمية الخلوية، والتأثيرات على الفسيولوجيا الطبيعية، ومستويات التعبير الجيني لطرق التحويل المختلفة. تتم مقارنة المبادئ والتطبيقات والخصائص في الجدول التالي:
الجدول 1 مقارنة بين طرق النقل المختلفة
| تكنولوجيا | مبادئ | المزايا | العيوب |
| طريقة النقل الكيميائي | |||
| الليبوزومات الكاتيونية | تشكل الليبوزومات المشحونة إيجابيا معقدات مع مجموعات فوسفاتية مشحونة سلبًا من الأحماض النووية ويتم إدخالها إلى الخلايا. |
|
|
| ترسب فوسفات الكالسيوم | تمتص معقدات فوسفات الكالسيوم DNA على أغشية الخلايا وتنتقل إلى الخلايا |
|
|
| دكسترين | يتم إدخال المركب المشكل عن طريق تفاعل DEAE-dextran المشحون إيجابيا مع العمود الفقري الفوسفاتي المشحون سلبًا للحمض النووي بواسطة الخلية. |
|
|
| بوليمرات كاتيونية أخرى | يشكل البوليمر المشحون إيجابيا معقدًا مشحونًا إيجابيًا مع مجموعة الفوسفات المشحونة سلبًا للحمض النووي، ثم يتفاعل مع البروتيوغليكان المشحون سلبًا على سطح الخلية، ويدخل الخلية عن طريق البلعمة الذاتية. |
|
|
| طريقة النقل الحيوي | |||
| الانتقال الفيروسي | الغريزة تصيب الخلايا وتنقل المادة الوراثية |
|
|
| طريقة النقل الفيزيائي | |||
| نقل الكهرباء | يؤدي ارتفاع الجهد النبضي إلى تعطيل إمكانات غشاء الخلية، ويتم إدخال الحمض النووي من خلال المسام المتكونة في الغشاء. |
|
|
| نقل الجسيمات عن طريق النقل البيولوجي (قصف الجسيمات) | يتم ترسيب الحمض النووي بجزيئات معدنية ثقيلة مجهرية، ثم يتم إطلاق الجزيئات المغلفة إلى الخلايا بجهاز باليستي، ويتم إطلاق الحمض النووي تدريجيًا والتعبير عنه في الخلايا. |
|
|
| الحقن المجهري | يتم استخدام المعالجة الدقيقة لحقن الحمض النووي مباشرة في نواة الخلية المستهدفة. |
|
|
مميزاته كواشف النقل الجيني من شركة Yeasen
بالنسبة لكاشفات نقل الحمض النووي وكواشف نقل الحمض النووي الريبي، تمتلك شركة Yeasen Biotechnology فريقًا قويًا للبحث والتطوير والإنتاج، وتعمل باستمرار على تحسين الصيغ وتحسين عمليات الإنتاج، وأطلقت مجموعة متنوعة من المنتجات القائمة على الليبوزومات الكاتيونية والبوليمرات الكاتيونية. توفر مؤسسات البحث العلمي والشركات مجموعة كاملة من المنتجات، ويغطي خط المنتجات جميع المجالات المتعلقة بكاشفات النقل.
| كاشف نقل الخلايا الليبوسومية الخالي من الخلايا Hieff Trans™ Suspension | |
| 40802ES | 40805ES |
| 40806ES | 40816ES |
- كفاءة عالية: مناسبة للانتقال المؤقت أو الانتقال المستقر لخطوط الخلايا.
- سمية منخفضة: تظل الخلايا المحولة قابلة للحياة بشكل جيد.
- قدرة واسعة على التكيف: تغطية شاملة للخلايا الشائعة والخلايا الأولية التي يصعب نقلها.
- سهل التشغيل: مناسب للوسط الموجود في المصل، دون تغيير الوسط قبل وبعد النقل.
- فعّالة من حيث التكلفة: اقتصادية وعملية، وكفاءة نقل عالية، وسعر منخفض.
كيفية اختيار نوع كاشف النقل بناءً على تجاربك؟
يجب أن يتم اختيار كواشف التحويل وفقًا للأغراض التجريبية المختلفة والمحتويات التجريبية، مثل المواد المحولة والخلايا المحددة وسهولة التشغيل وعوامل أخرى.
| منتج | كاشف نقل الخلايا الليبوسومية الخالي من الخلايا Hieff Trans™ Suspension | |||
| نوع الخلية | خلية تقليدية | خلية تقليدية | خلية تقليدية | خلية تقليدية |
| / | / | خلايا يصعب نقلها | خلايا يصعب نقلها | |
| نوع الحمض النووي | الحمض النووي | الحمض النووي | / | الحمض النووي |
| الرنا المتداخل صغير الحجم | الرنا المتداخل صغير الحجم | الرنا المتداخل صغير الحجم | / | |
| / | / | ميكرو رنا | / | |
| / | / | تقليد miRNA | / | |
| / | / | مضاد الميكرو رنا | / | |
| النقل المشترك للحمض النووي DNA/الحمض النووي الريبوزي المتداخل صغير الحجم | النقل المشترك للحمض النووي DNA/الحمض النووي الريبوزي المتداخل صغير الحجم | / | / | |
| تغليف الفيروسات | تغليف الفيروسات | / | تغليف الفيروسات |
حالة التطبيق
كاشف نقل الليبوسومات Hieff Trans™
هييف ترانس™ يتم توفيره في صورة سائل معقم. بشكل عام، بالنسبة لنقل صفيحة ذات 24 بئرًا، يتم استخدام حوالي 1.5 ميكرولتر في كل مرة، و1 مل من Hieff Trans™ يمكن إجراء حوالي 660 عملية نقل؛ بالنسبة للصفيحة ذات 6 آبار، حوالي 6 ميكرولتر في كل مرة، 1 مل من Hieff Trans™ يمكن أن تفعل حوالي 660 انتقالًا. 160 انتقالًا؛
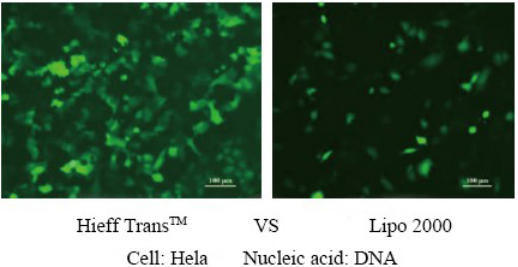
لمزيد من التفاصيل، يرجى الاطلاع الثقة في النقل الجيني باستخدام كاشف Hieff Trans™ Lipofectamine
بولي إيثيلين إيمين خطي (PEI) MW40000 (تحلل سريع)
PEI 40000 هو بوليمر كاتيوني مشحون للغاية بوزن جزيئي يبلغ 40000 يرتبط بجزيئات الحمض النووي المشحونة سلبًا بسهولة شديدة، ويشكل مركبًا ويسمح للمركب بدخول الخلايا. PEI 40000 هو كاشف انتقال مؤقت ذو سمية خلوية منخفضة وكفاءة انتقال عالية وكفاءة عالية في التعبير الجيني في خلايا مثل HEK293 وCHO. تم التحقق من صحة كواشف انتقال PEI الخطية لمجموعة واسعة من سلالات الخلايا بما في ذلك خلايا HEK-293 وHEK293T وCHO-K1 وCOS-1 وCOS-7 وNIH/3T3 وSf9 وHepG2 وHela. تصل كفاءة الانتقال إلى 80% ~ 90%.
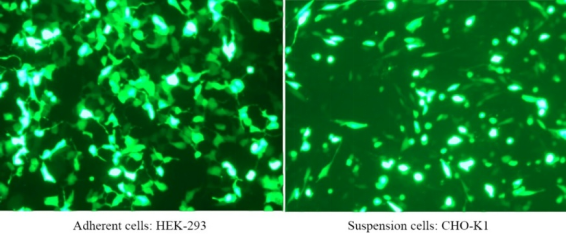
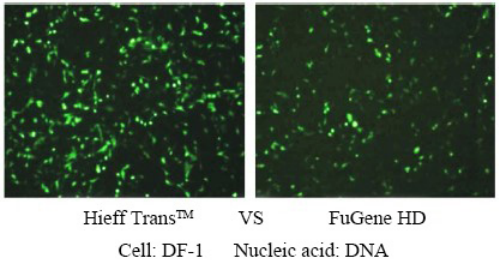
لمزيد من التفاصيل، يرجى الاطلاع مفضل جديد للتحويل الجيني —— Linear PEI MW 40000، كاشف تحويل جيني أكثر كفاءة
هييف ترانس™ في المختبر كاشف انتقال siRNA/miRNA
يمكن لهذا المنتج تحقيق كفاءة تعبير تزيد عن 90% لـ 1 nM siRNA في مجموعة واسعة من سلالات الخلايا، مما يتجنب التأثيرات غير المستهدفة. مناسب لنقل مجموعة متنوعة من الخلايا، بما في ذلك Hela وMCF-7 وHepG2 وCHO والخلايا الملتصقة الأخرى؛ ويمكن لسلالات الخلايا المعلقة التي يصعب نقلها، مثل خلايا K562 أو THP-1، تحقيق كفاءة إسكات بنسبة 80%؛ بما في ذلك بعض الخلايا الأولية، والأرومات الليفية البشرية الأولية وخلايا الكبد البشرية الأولية، وما إلى ذلك، يمكن تحقيق كفاءة إسكات بنسبة 80%.
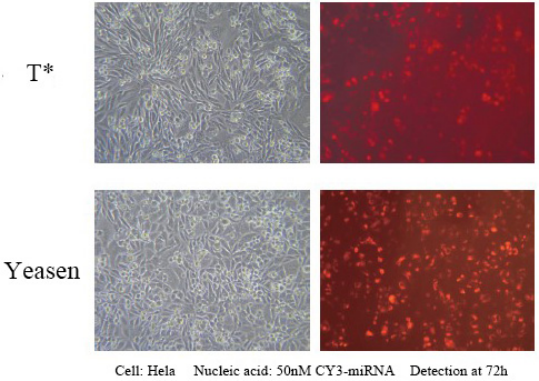
مرجع لشروط النقل
بالإضافة إلى التعليمات الخاصة بكل منتج، يعمل العملاء وفقًا لمحتوى تجريبي محدد، وستكون هناك اختلافات مختلفة في كمية الاستخدام. وفقًا لظروف نقل الخلايا في المختبر التي أبلغ عنها العملاء بعد استخدام المنتج، فقد تم فرزها للرجوع إليها.
| اسم المنتج/رقم العنصر | |||||
| خلية | وعاء الثقافة | كثافات طلاء الخلايا | الحمض النووي | هييف ترانس | كفاءة النقل الجيني |
| أ549 | 6 جيدا | 90% | 0.7 ميكروجرام | 1.15 ميكرولتر | +++ |
| بى فى 2 | 24 بئر | 95% | 0.2 ميكروجرام | 0.2 ميكرولتر | ++ |
| سي2سي12 | 24 بئر | 80% - 90% | 1 ميكروجرام | 5 ميكرولتر | ++ |
| دي اف 1 | 24 بئر | 80% - 90% | 0.5 ميكروجرام | 0.5 ميكرولتر | +++ |
| ح520 | 6 جيدا | 80% | 1.2 ميكروجرام | 6 ميكرولتر | ++ |
| هاكات | 96 جيدا | 70% | 100 نانوغرام | 1 ميكرولتر | ++ |
| اتش سي تي 116 | 6 جيدا | 90% | 4 ميكروجرام | 10 ميكرولتر | ++ |
| هيك 293 | 6 جيدا | 95% | 2 ميكروجرام | 10 ميكرولتر | 80 - 90% |
| هيك 293 قدم | 24 بئر | 85% | 1 ميكروجرام | 4 ميكرولتر | 90% |
| هيك 293T | 12 بئر | 1×105 | 1 ميكروجرام | 2 ميكرولتر | +++ |
| HEK 293T (نظام التعليق) | 30 مل | 80% | 30 ميكروجرام | 60 ميكرولتر | ++ |
| هيلا | 12 بئر | 90% | 0.2 ميكروجرام | 0.6 ميكرولتر | 90% |
| هيلا | 12 بئر | 80% | 1 ميكروجرام | 3 ميكرولتر | +++ |
| التهاب الكبد G2 | 12 بئر | 80% | 1 ميكروجرام | 3 ميكرولتر | ++ |
| هيوفك | 24 بئر | 80% | 1 ميكروجرام | 2 ميكرولتر | ++ |
| إم سي إف 10 أ | طبق مقاس 10 سم | 60% | 5 ميكروجرام | 15 ميكرولتر | ++ |
| ن2أ | 24 بئر | 70% - 80% | 300 نانوغرام | 900 ميكرولتر | + |
| المعهد الوطني للسرطان H1975 | 6 جيدا | 80% | 4 ميكروجرام | 10 ميكرولتر | +++ |
| المعهد الوطني للصحة 3T3 | 6 جيدا | 90% | 4 ميكروجرام | 10 ميكرولتر | +++ |
| خام 264.7 | طبق 35 ملم | 80% | 1 ميكروجرام | 2 ميكرولتر | 90% |
| فيرو | 6 جيدا | 80% | 3 ميكروجرام | 9 ميكرولتر | +++ |
| خلية | وعاء الثقافة | كثافات طلاء الخلايا | الرنا المتداخل صغير الحجم | هييف ترانس | كفاءة النقل الجيني |
| هونج كونج 2 | 6 جيدا | 65% | 100 بيكومول | 6 ميكرولتر | +++ |
الأسئلة الشائعة
1 كاشف نقل الليبوسومات Hieff Trans™
1.1 س: هل يمكن أن يكون المصل موجودًا عند تحضير مجمعات كواشف نقل الحمض النووي؟
ج: وجود المصل يؤثر على تكوين الليبوزومات. يوصى باستخدام وسط خالٍ من المصل (عادةً وسط MEM) عند تحضير مجمعات كواشف نقل الحمض النووي.
1.2 س: ما الذي يجب أن أنتبه إليه عند استخدام كاشف نقل الحمض النووي الليبوزومي Hieff Trans™؟
أ:
1) عندما يتم تحويل الخلايا، تكون كثافة الخلايا تفضيلياً 80% -95%، ويتم تحديد كثافة الطلاء النوعية وفقًا لحالة الخلايا؛
2) يساعد استخدام الحمض النووي عالي النقاء على الحصول على كفاءة نقل أعلى؛
3) يلزم تخفيف كواشف الحمض النووي وكواشف النقل باستخدام وسط خالٍ من المصل عند تحضير معقدات النقل؛
4) لا يمكن إضافة المضادات الحيوية إلى الوسط أثناء النقل؛
5) يجب تخزين الكواشف عند درجة حرارة تتراوح بين 2-8 درجة مئوية، ويجب الحرص على تجنب فتح الغطاء بشكل متكرر لفترة طويلة؛
6) يجب تحسين تركيز الحمض النووي وعدد كواشف الليبوزوم الكاتيوني للاستخدام الأول للحصول على أقصى قدر من كفاءة النقل. يوصى عمومًا بأن تكون نسبة الحمض النووي إلى كاشف النقل 1:2-1:3.
1.3 س: هل هناك حاجة إلى إنهاء العملية بعد النقل؟
ج: لا حاجة لذلك. تظل مجمعات الليبوزوم مستقرة لمدة 6 ساعات. إذا لم يتم تغيير وسط الخلية قبل التحويل الجيني، فمن أجل ضمان العناصر الغذائية اللازمة لنمو الخلايا الطبيعي، فمن الضروري التغيير إلى وسط جديد بعد 4-6 ساعات. ومع ذلك، إذا تم تغيير الوسط قبل التحويل الجيني، فليس من الضروري تغيير الوسط بعد تحويل الليبوزوم.
1.4 س: هل يمكن إجراء التحويل المشترك للحمض النووي والحمض النووي الريبوزي منقوص الأكسجين؟ ما هو التأثير؟
ج: نعم، عندما يتم نقل DNA و siRNA معًا، فإن كفاءة نقل siRNA ستكون أسوأ قليلاً.
1.5 س: هل يمكن استخدام كاشف التحويل الجيني لتحويل العبوات الفيروسية العدسية؟
أ: التغليف الفيروسي العدسي ممكن.
1.6 س: هل يمكن تحويل الخلايا المعلقة باستخدام كاشف تحويل الحمض النووي الليبوزومي Hieff Trans™؟
أ: يمكن استخدام كاشف نقل الحمض النووي الليبوزومي Hieff Trans™ لنقل الخلايا المعلقة، راجع البروتوكول للحصول على التفاصيل. بالإضافة إلى ذلك، قدمنا أيضًا كاشف نقل خاصًا بالخلايا المعلقة (رقم الكتالوج 1000).40805، كاشف نقل الخلايا الليبوسومية الخالي من الخلايا Hieff Trans™
2 هييف ترانس™ في المختبر كاشف انتقال siRNA/miRNA
2.1 س: هل هناك حاجة إلى تغيير كاشف التحويل بعد التحويل؟
ج: يمكن تقسيم هذه المشكلة إلى حالتين: 1. إذا لم يكن هناك تغيير في الوسط قبل التحويل، فيجب تغيير الوسط بعد حوالي 6 ساعات من التحويل لضمان العناصر الغذائية اللازمة لنمو الخلايا؛ 2. إذا كان هناك تغيير في الوسط قبل التحويل، فهل يمكن تشغيله وفقًا للتشغيل الطبيعي للخلايا المزروعة؟ بعد عملية تغيير السائل؟
2.2 س: هل يمكن تجميد كواشف النقل الجيني؟
ج: لا يمكن تجميده، لأن كاشف التحويل هو كاشف تحويل كاتيوني PEI. التجميد في درجات حرارة منخفضة سيدمر نشاط كاشف التحويل PEI. لذلك، من الأفضل تخزينه عند درجة حرارة تتراوح بين 2 و8 درجات مئوية للحفاظ على أفضل فعالية للتحويل.
معلومات المنتج
| اسم المنتج | رقم المنتج | تحديد |
| كاشف نقل الليبوسومات Hieff Trans™ | 40802ES02 | 0.5 مل |
| 40802ES03 | 1.0 مل | |
| 40802ES08 | 5×1مل | |
| كاشف نقل الخلايا الليبوسومية الخالي من الخلايا Hieff Trans™ Suspension (استفسار) | 40805ES02 | 0.5 مل |
| 40805ES03 | 1.0 مل | |
| 40805ES08 | 5×1 مل | |
| Hieff Trans™ في المختبر كاشف انتقال siRNA/miRNA (استعلام) | 40806ES02 | 0.5 مل |
| 40806ES03 | 1.0 مل | |
| بولي إيثيلين إيمين خطي (PEI) MW40000(التحلل السريع) | 40816ES02 | 100 ملغ |
| 40816ES03 | 1 جرام | |
| 40816ES08 | 5×1 جرام |
بعض المقالات المنشورة باستخدام منتجاتنا
[1] Liu R, Yang J, et al. Optogenetic control of RNA function and metabolism using engineeringd light-switched RNA-binding protein. Nat Biotechnol. 3 يناير 2022. (IF:55)
[2] Luo J, Yang Q, et al. TFPI هو مستقبل في القولون لـ TcdB من السلالة شديدة الضراوة 2 من C. difficile. Cell. 17 مارس 2022.(IF:41.582)
[3] Zhou J, Chen P, et al. متغيرات Cas12a المصممة لتأثير أقل خارج الهدف على مستوى الجينوم من خلال التعرف الصارم على PAM. Mol Ther. 5 يناير 2022.(IF:11.454)
[4] Chen S, Cao X, et al. circVAMP3 يحرك فصل طور CAPRIN1 ويمنع سرطان الخلايا الكبدية عن طريق قمع ترجمة c-Myc. Adv Sci (Weinh). 24 يناير 2022.(IF:16.808)
[5] Gu C, Wang Y, et al. AHSA1 هو هدف علاجي واعد لتكاثر الخلايا ومقاومة مثبطات البروتيازوم في المايلوما المتعددة. J Exp Clin Cancer Res. 2022 Jan 6.(IF:11.161)
[6] Zhang Y, Yu X, et al. Splicing factor arginine/serine-rich 8 promotes multiple myeloma malignant and bone lesion through alternative linking of CACYBP and exosome based cell communication. Clin Transl Med. 2022 Feb.(IF:11.492)
[7] Qin J, Cai Y, et al. Molecular mechanism of agonism and inverse agonism in ghrelin receptor. Nat Commun. 2022 Jan 13.(IF:14.9)
[8] تانغ إكس، دينج زد، وآخرون.بروتين جديد مشفر بواسطة circHNRNPU يعزز تطور الورم النقوي المتعدد عن طريق تنظيم بيئة نخاع العظم والربط البديل. J Exp Clin Cancer Res. 2022 Mar 8.(IF:11.161)
[9] Xie F, Su P, et al. Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy. Adv Mater. 2021 Oct 19. (IF:30.849)
[10] Liang Y, Lu Q, et al. Reactivation of tumour suppressor in breast cancer by booster switching through NamiRNA network. Nucleic Acids Res. 2021 Sep 7.(IF:16.9)
[11] Fan Y, Wang J, et al. CircNR3C2 يعزز تأثير HRD1-mediated tumor-suppressive effect عن طريق إسفنج miR-513a-3p في سرطان الثدي الثلاثي السلبي. Mol Cancer. 2 فبراير 2021.(IF:27.403)
[12] Dai L, Dai Y, et al. Structural insight into BRCA1-BARD1 complex recruiting to damaged chromatin. Mol Cell. 2021 Jul 1.(IF:17.97)
[13] Zhang K, Wang A, et al. UBQLN2-HSP70 axis يقلل من تجمعات بولي جلاي-ألا ويخفف من العيوب السلوكية في نموذج حيواني C9ORF72. Neuron. 16 يونيو 2021.(IF:17.17)
[14] Li T, Chen X, et al. جهاز بصري جيني قائم على BRET الاصطناعي للتعبير عن الجينات المنقولة النبضية مما يتيح توازن الجلوكوز في الفئران. Nat Commun. 27 يناير 2021.(IF:14.92)
[15] Yan F, Huang C, et al. Threonine ADP-ribosylation of Ubiquitin by a Bacterial Effects Family يمنع عملية تحويل اليوبيكويتين إلى مضيف. Mol Cell. 21 مايو 2020.(IF:17.97)
[16] Sun X, Peng X, et al. ADNP يعزز التمايز العصبي عن طريق تعديل إشارات Wnt/β-catenin. Nat Commun. 12 يونيو 2020.(IF:14.911)
[17] Yang X, Wang H, et al. Rewiring ERBB3 and ERK signaling confers resistant to FGFR1 inhibition in vascular cancer habored an ERBB3-E928G altered. Protein Cell. 2020 Dec.(IF:14.872)
[18] Zou Y, Wang A, et al. Analysis of redox landscapes and dynamics in living cells and in vivo using genetically encodedfluorescent sensors. Nat Protoc. 2018 Oct.(IF:13.490)
[19] Hao H, Hu S, et al. Loss of Endothelial CXCR7 Impairs Vascular Homeostasis and Cardiac Remodeling After Myocardial Infarction: Implications for Cardiovascular Drug Discovery. Circulation. 28 مارس 2017.(IF:29.69)
