Oversigt over T4 DNA Ligase
Hvilke enzymer bruger forskerne til at binde et nyt gen? Det er overflødigt at sige, at DNA-ligase er inkluderet. Så hvorfor er DNA-ligase så vigtig i rekombinant DNA? Fordi DNA-ligase er ansvarlig for ligering af målfragmentet til vektoren, hvilket er et af nøgleelementerne, der bestemmer eksperimentets succes. Som en slags DNA-ligase, hvilken rolle spiller T4 DNA-ligase i molekylære kloningseksperimenter? Hvordan virker det? T4 DNA-ligasen vil blive grundigt introduceret næste gang.
1. Hvad er T4 DNA Ligase?
2. Hvad er funktionen af T4 DNA-ligase?
3. Yeasen Biotech T4 DNA-ligase kan bruges til NGS-adapterligering
4. En udvælgelsesvejledning til Yeasen Biotech T4 DNA-ligase
1. Hvad er T4 DNA Ligase?
T4 DNA-ligase er en ATP-afhængig ligase, der katalyserer ligeringsreaktionen mellem DNA-molekyler. Det danner hovedsageligt phosphodiester ved at forbinde 3'-hydroxyl- og 5'-phosphat-enderne. DNA-ligaser er involveret i DNA-replikation og reparationsprocesser i alle organismer. Den fag-kodede T4 DNA-ligase produceres under fag T4-infektion af E. coli.
De ligaser, der anvendes i genteknologi, er hovedsageligt E. coli DNA-ligase og T4 DNA-ligase, hvor sidstnævnte er mere udbredt i øjeblikket. T4 DNA ligase kan reparere enkeltstrengede hak på dobbeltstrenget DNA, dobbeltstrenget RNA eller DNA/RNA hybridstrenge for at forbinde to tilstødende nukleotider og spiller en vigtig rolle i DNA reparation og rekombination.
I den rekombinante plasmidkonstruktionsproces kan T4 DNA-ligase anvendes sammen med restriktionsenzymer for at fuldende det rekombinante plasmidkonstruktionsforsøg. Det kan katalysere dannelsen af en phosphodiester-binding mellem 5'-P-enden og 3'-OH-enden af dobbeltstrenget DNA og har en god forbindelseseffektivitet for sticky-ende-forbindelse og stump-ende-forbindelse.
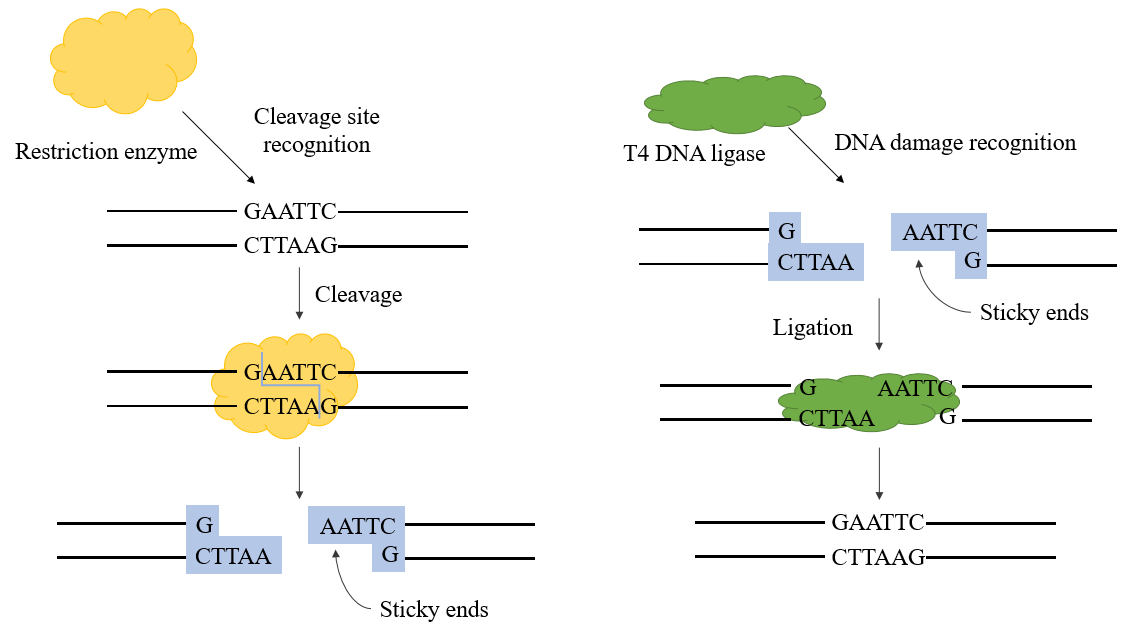
Figur 1. T4 dna ligase mekanisme
2. Hvad er funktionen af T4 DNA-ligase?
2.1 Vektorkonstruktion
I vektorkonstruktionsforsøg kan forskellige restriktionsenzymer producere forskellige typer ender. Til forskellige ender vil T4 DNA-ligase have forskellige ligeringsstrategier.
2.1.1 Kloning med restriktionsenzymer, klæbrige ender produceret ved enkelt fordøjelse
Under konstruktionen af vektoren, hvis den samme restriktionsendonuklease bruges til at skære DNA-fragmentet af målgenet, og vektormolekylet kan producere den samme klæbrige ende, kan T4 DNA-ligasen direkte udføre rekombinationsforbindelsen. Men fordi de klæbrige ender er de samme, kan målgenet indsættes i vektoren i frem- eller modsat retning, hvilket let vil øge arbejdsbyrden ved screening for korrekte rekombinante kloner. Overvej at bruge dobbelt-enzymfordøjelsesmetoden til vektorkonstruktion.
Derudover kan de kohæsive ender af vektoren fremstillet ved enkelt enzymfordøjelse også parres, og derefter dannes phosphodiesterbindinger mellem nukleotider under påvirkning af T4 DNA-ligase, hvilket resulterer i selvligering af vektoren. Brug af alkalisk phosphatase til at behandle den fordøjede vektor kan fjerne phosphatgruppen ved 5'-enden af vektoren, så vektoren ikke kan fuldføre selvligering. Under påvirkning af T4 DNA-ligase forbindes vektoren og målfragmentet således for at fuldende konstruktionen af den rekombinante vektor.
2.1.2 Kloning med restriktionsenzymer, klæbrige ender produceret ved dobbeltfordøjelse
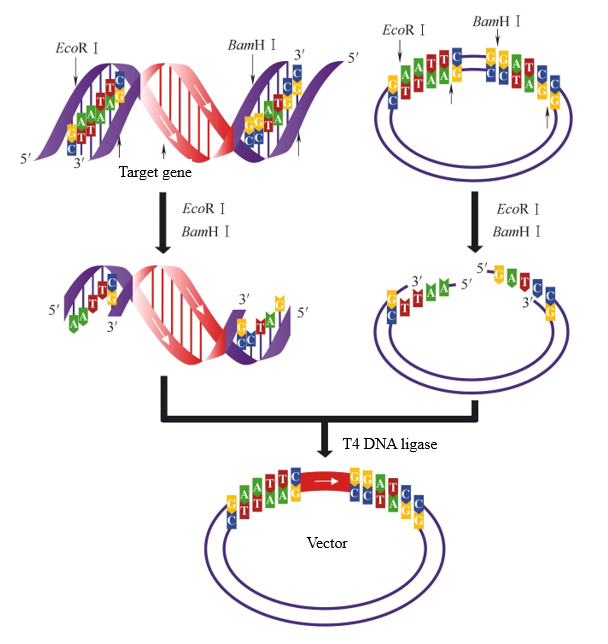
I processen med vektorkonstruktion, hvis to restriktionsenzymer med forskellige klæbrige ender anvendes til at fordøje henholdsvis målfragmentet og vektoren, kan der dannes to forskellige klæbrige ender. På dette tidspunkt kan T4 DNA-ligase selektivt ligere de samme klæbrige ender for at sikre, at målfragmentet indsættes i vektoren i den korrekte retning. Når målfragmentet og vektoren i figur 2 fordøjes med EcoRI og BamHI på samme tid, kan de samme klæbrige ender forbindes. Der er kun én ligeringsretning mellem målfragmentet og vektoren.

Figur 2. Sticky end ligering genereret ved dobbelt-enzym fordøjelse[1]
2.1.3 Kloning af restriktionsfragmenter, stump ende
Nogle restriktionsendonukleaser kan også generere stumpe ender under enzymatiske spaltninger, såsom Smal og andre. T4 DNA-ligase kan direkte danne en phosphodiesterbinding mellem vektoren og insertionen, og der er ikke behov for parring mellem baser. Denne metode har imidlertid lav ligeringseffektivitet og er tilbøjelig til vektorselvligering. Generelt kan de stumpe ender omdannes til klæbrige ender og derefter ligeres. For eksempel forbedrer tilsætning af komplementære poly A- og poly-T-baser til enderne af målfragmentet og vektoren og kunstigt klæbrige komplementære ender henholdsvis forbindelseseffektiviteten ved terminal deoxynucleotidyltransferase.
2.1.4 TA-kloning
T-vektoren anvendt i TA-kloning har et T-overhæng i 3'-enden. Når DNA-sekvensen af målfragmentet er uklar, kan målgenfragmentet forbindes til T-vektoren ved TA-kloning, og målgenet kan bestemmes ved sekventering. Taq DNA-polymerasen anvendt i PCR har terminal transferaseaktivitet og kan tilføje et nukleotid "A" til 3'-enden af DNA-fragmentet. T4 DNA-ligase kan direkte forbinde produktet amplificeret af Taq DNA-polymerase til T-vektoren, og det PCR-amplificerede produkt kan opnå formålet med effektiv kloning uden at tilføje kunstige adaptere.
Figur 3. Arbejdsgangen for TA-kloning[2]
2.2 NGS adapter ligering
Under konstruktionen af næste generations sekventeringsbibliotek er det nødvendigt at forbinde den kunstige adapter til PCR-produktet, før den kan fikseres på flowcellen på sekventeringschippen for at fuldføre sekventeringen. Opbygning af TA-kloningsligeringslinkerbibliotek er et meget almindeligt teknisk middel, og dets princip ligner den ovennævnte TA-kloning. Efter at DNA-fragmentet, der skal sekventeres, er phosphoryleret i 5'-enden og "A" er tilføjet i 3'-enden, er det komplementært og parret med adapteren med den "T"-klæbende ende. Den komplette dobbeltstreng dannes derefter og sekventeres af maskinen.
Under TA-ligering vil forskellige prøvetyper eller kompleksiteten af nukleinsyrefragmentstrukturen påvirke effektiviteten af ligeringen, så adaptorerne på forskellige platforme vil også have indflydelse på det endelige biblioteksresultat.
For eksempel har MGI-platformens Bubble-adapter en speciel sekundær struktur og kræver meget høj ligeringseffektivitet for T4 DNA-ligase, og reduktionen af ligeringseffektiviteten påvirker direkte bibliotekets output.
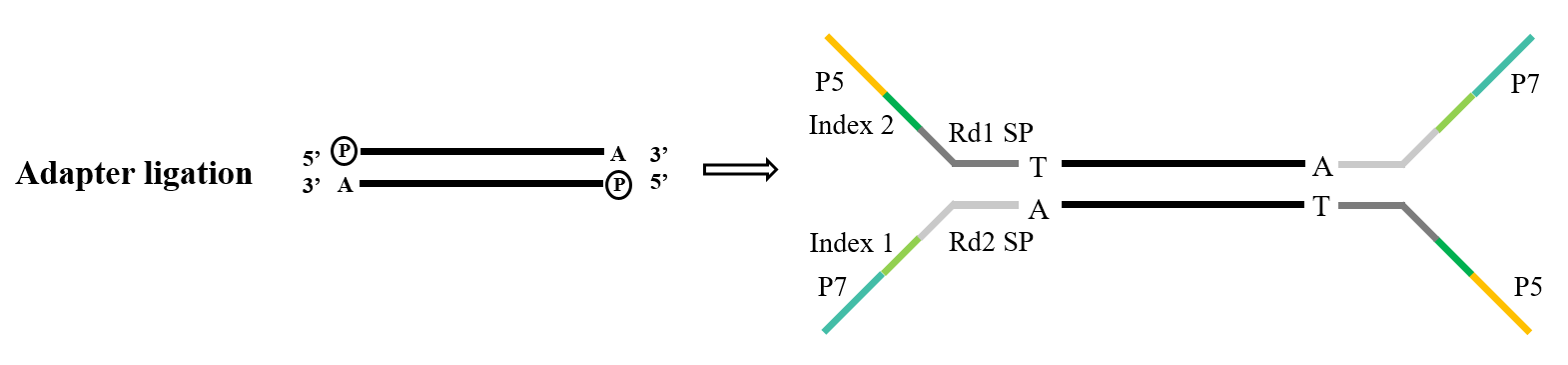
Figur 4. Generel adapterligeringsproces
3.Yeasen Biotech T4 DNA-ligase kan bruges til NGS-adapterligering
Yeasen Biotech specielt udviklet Hurtig T4 DNA ligase til ligering af DNA-fragmenter og adaptere i processen med NGS-bibliotekskonstruktion. Enzymet har effektiv ligeringsevne, ikke kun hurtig forbindelseshastighed, men også kompatibel med forskellige typer prøver, hvilket er mere fordelagtigt til forbindelse af nukleinsyrefragmenter med komplekse strukturer. På nuværende tidspunkt er det blevet verificeret ved high-throughput sekventering af et stort antal kunder. Til tilslutning af Bubble-adaptere på MGI-platformen kan der også opnås fremragende sekventeringskvalitet.
3.1 Yeasen Biotech Fast T4 DNA-ligase med den ultrahøje ligeringseffektivitet
Brug Yeasen Biotech Fast T4 DNA-ligase til at konstruere biblioteker med forskellige adaptertyper. Prøven er en 170 bp cfDNA-mimik, og Agilent 2100-biblioteket bruges til at detektere resultaterne. ①Utilsluttet adapterprodukt; ②Single-end adapter produkt; ③ Dobbelt-ende adapter produkt; ④Resterende adapter. Fra resultaterne kan det ses, at ligeringseffektiviteten af enkelt- og dobbeltendede adaptere er meget høj.
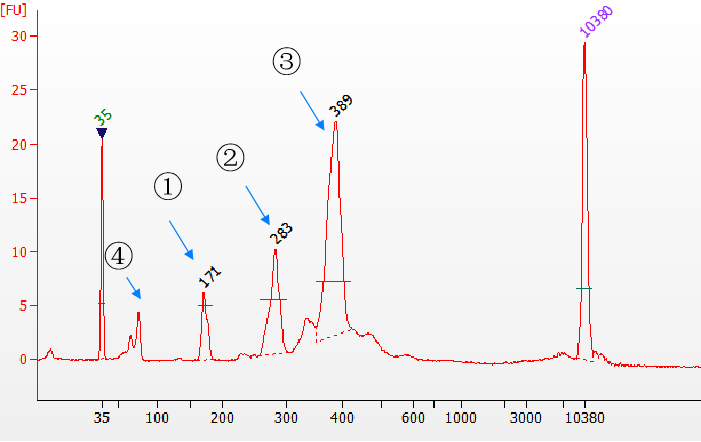
Figur 5. Forskellige typer ligeringsprodukter detekteret af Agilent 2100
3.2 Yeasen Biotech Fast T4 DNA-ligase med fremragende biblioteksudbytte
Ved at bruge Fast T4 DNA-ligase til forskellige typer bibliotekskonstruktion sammenlignet med andre T4 DNA-ligaser er biblioteksudbyttet bedre.
Tabel 1. Bibliotekers udbytte af forskellige slags prøver
| Typer af prøver | Intestinal mikrobiota gDNA | cfDNA | FFPE HD200 gDNA | |||
| T4 DNA ligase (samme enhed) | Yeasen | N* | Yeasen | N* | Yeasen | N* |
| Input DNA (ng) | 10 | 10 | 50 | |||
| Amplifikationscyklusnummer | 10 | 10 | 8 | |||
| Gennemsnitligt udbytte (μg) Illumina platform | 3.3 | 2.8 | 2.7 | 2.2 | 3 | 2.5 |
| Gennemsnitligt udbytte (μg) MGI platform | 2.7 | 0,9 | 2.0 | 0,7 | 2.3 | 0,8 |
4. En udvælgelsesvejledning til Yeasen Biotech T4 DNA-ligase
Yeasen er en bioteknologisk virksomhed, der beskæftiger sig med forskning, udvikling, produktion og salg af tre store biologiske reagenser: molekyler, proteiner og celler. Udover Fast T4 DNA-ligase har Yeasen Biotech også Ny T4 DNA-ligase og Hurtig T4 DNA ligase at vælge imellem. Du kan vælge dem baseret på applikationer, der vises i følgende tabel:
Tabel 2: Relaterede produkter
| Produktpositionering | Produktnavn | Kat# | Anvendelse |
| Universel | Hieff™ Gold T4 DNA Ligase(Spørge) | 10300ES | Molekylær kloning. |
| Universel | 10301ES | NGS biblioteksbyggeri. | |
| Høj ligeringseffektivitet og lav vært E. coli rester | 10299ES | NGS bibliotekskonstruktion, specielt velegnet til patogendetektion, NIPT-detektion mv. | |
| Høj følsomhed | 10298ES | NGS bibliotekskonstruktion, specielt velegnet til bibliotekskonstruktion af cfDNA prøver. |
Referencer
[1] W. Yuan. Genteknik[M]. Chemical Industry Press, 2019.
[2] Clark DP, Pazdernik NJ, Mcgehee MR. Kloning af gener for syntetisk biologi - ScienceDirect[J]. Molekylærbiologi (tredje udgave), 2019:199-239.
[3] Tomkinson AE, Vijayakumar S, Pascal JM, et al. DNA-ligaser: struktur, reaktionsmekanisme og funktion[J]. Chemical Reviews, 2006, 106(2):687-699.
[4] Shuman S. DNA-ligaser: fremskridt og udsigter[J]. Journal of Biological Chemistry, 2009, 284(26):17365-17369.
