Med den dybere forskning i organoider slutter et stigende antal individer sig. Denne artikel opsummerer nogle almindelige videnspunkter om organoider [1-5], i håb om at være nyttige for alle.
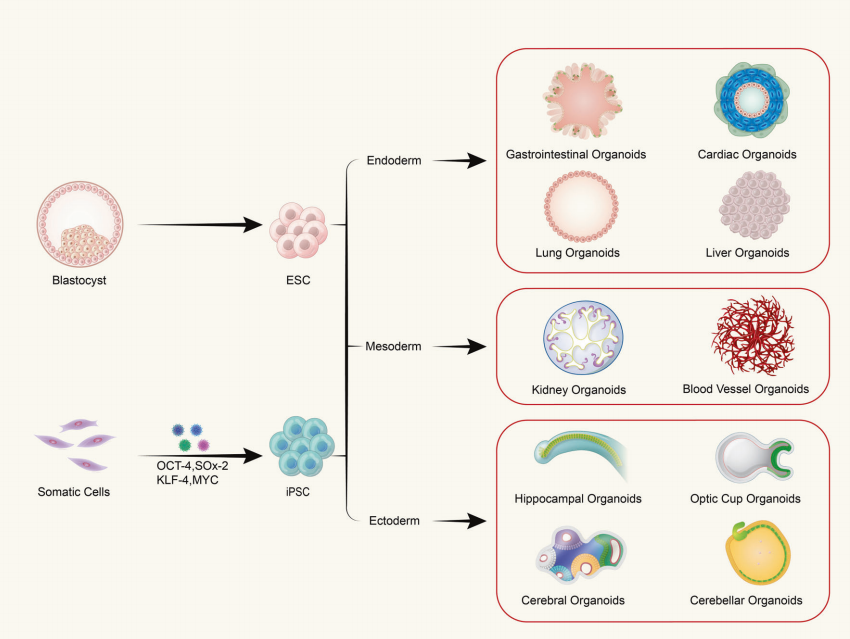
Spørgsmål: Er organoider sammensat af en enkelt type celle eller flercellet væv?
Organoider dannes ved in vitro tredimensionel (3D) dyrkning af voksne stamceller eller pluripotente stamceller, hvilket resulterer i vævslignende strukturer med en vis rumlig organisation. Organoider er ikke strukturer sammensat af enkeltceller; snarere dannes de ved at inducere deling og differentiering af initierende celler med stamcelleegenskaber, som derefter selv samles til væv med en vis rumlig struktur, morfologi og funktionalitet svarende til tilsvarende organer in vivo.
Q: Hvad er kilderne til dyrkning af organoider?
(1) Organoider afledt af pluripotente stamceller omfatter voksne stamceller (ASC), pluripotente stamceller (PSC) og inducerede pluripotente stamceller (iPSC). (2) Organoider afledt af vævsekstraherede celler findes almindeligvis i tumorvæv.
Q: Kan frosset væv bruges til 3D-dyrkning i mangel af frisk væv?
Ja, men der er højere krav til størrelsen af frosset væv, og levedygtigheden af primært frosset væv og celler vil falde betydeligt, hvilket fører til en stærkt reduceret succesrate i efterfølgende dyrkning.
Q: Hvordan fryses og genoplives organoider?
Det optimale tidspunkt at nedfryse organoider er ved passager 2-5, hvor organoidernes aktivitet og differentieringspotentiale er bedst. Genoplivning af organoider kan følge de metoder, der bruges til celle-genoplivning.
Spørgsmål: Er det nødvendigt at kontrollere størrelsen af dyrkede organoider, og er det gavnligt, hvis de er for store?
Ja, det er nødvendigt at kontrollere størrelsen, helst inden for 500μm, da organoider mangler interne vaskulære og gas-væske cirkulationssystemer. Når størrelsen af organoider er stor, kæmper celler nær midten med at udveksle ilt og næringsstoffer med det ydre miljø. Derfor, jo større strukturen er, jo større er antallet af døde celler.
Q: Udover at bruge matrixgel, hvad kan der ellers bruges til at dyrke organoider?
Ud over matrixgel inkluderer alternativer til dyrkning af organoider (1) decellulariseret ekstracellulær matrix og andre afledte proteiner, (2) syntetiske hydrogeler og (3) konstruerede rekombinante proteingeler.
Q: Hvordan kan styret differentiering af organoider opnås?
Den tidlige udvikling af stamcelle-induceret differentiering i organoider er i fællesskab reguleret af flere signalveje. In vitro-dyrkning kræver tilføjelse af vækstfaktorer for at simulere aktiviteten af disse signalveje, hvilket leder celler til at differentiere i specifikke retninger. For eksempel kan induktion med Y27632 og Activin A differentiere embryonale stamceller (ESC'er) eller inducerede pluripotente stamceller (iPSC'er) til embryoidlegemer (EB'er). Efterfølgende reguleres signalveje af faktorer som Wnt3a, FGF-4 og Noggin for at inducere stamcelledifferentiering i specifikke retninger.
Spørgsmål: Hvordan kan kontaminering undgås, når der tages kliniske prøver?
(1) Sørg for aseptisk prøveudtagning så meget som muligt. (2) Forud for ekstraktion nedsænkes i PBS indeholdende antibiotika i flere minutter: for tumorer placeret i områder med potentiel kontakt med det ydre miljø, såsom mave, tarme og blære, anbefales det at nedsænke i PBS indeholdende 3%-5% antibiotika i 5-10 minutter; for andre almindelige tumorer, nedsænk i PBS indeholdende 1%-2% antibiotika i ca. 5 minutter. (3) Alle reagenser, der anvendes under celleekstraktion, bør indeholde 1 % antibiotika og en passende koncentration af primære antibiotika.
Spørgsmål: Hvilke forholdsregler skal der tages for indsamling, konservering og transport af tumorvæv?
Indsaml tumorvæv med et højt indhold af tumorceller så meget som muligt, og minimer eksponeringstiden af vævsprøver til luft for at reducere sandsynligheden for kontaminering. Placer indsamlede tumorvævsprøver i sterile rør, der indeholder en speciel prøvekonserveringsopløsning, så hurtigt som muligt, og transporter dem hurtigt til testenheden ved lav temperatur (omkring 4°C) (søg efter at levere inden for 2~4 timer efter prøveudtagning).
Spørgsmål: Er der forskel på organoider dyrket fra læsioner og dem, der dyrkes fra tilstødende væv?
Hvad er kravene til prøveudtagningssteder for tumorvæv? Ja, der er forskel. Tumorer selv udviser heterogenitet, så det er almindeligt at observere forskelle mellem organoider, der stammer fra forskellige kilder. Morfologisk har organoider afledt af primære læsioner en tendens til at have en mere invasiv struktur sammenlignet med dem fra tilstødende væv, og de virker generelt mere uregelmæssige. For at minimere fejl i modellering eller lægemiddelscreening bør der tages flere prøver fra områder med god aktivitet.
Q: Hvilke typer lægemidler kan bruges til lægemiddelfølsomhedstest af tumororganoider?
De vigtigste typer af antitumorlægemidler i klinisk praksis kan klassificeres i tre kategorier: cytotoksiske lægemidler (såsom paclitaxel, cisplatin/carboplatin, 5-FU osv.), målrettede lægemidler (lægemidler rettet mod EGFR, HER2, VEGFR osv.) og immunterapilægemidler repræsenteret af immune checkpoint-hæmmere, PD-1-antistoffer, etc.1).
Q: Hvad er succesraten for BOB-dyrkning?
Succesraten for BOB-dyrkning varierer lidt afhængigt af kilden. De fleste PDO'er har en succesrate mellem 63% og 70%, eller endda højere, op til 90%, hvilket i høj grad er korreleret med aktiviteten af selve vævet. Derudover kan kliniske behandlinger påvirke succesraten. Succesrater kan forbedres ved at reducere tiden for væv ex vivo og operationelle trin.
Q: Kan frosset væv bruges til organoid dyrkning?
Generelt anbefales vævkryokonservering ikke på grund af betydeligt tab af levedygtighed. Men hvis væv opbevares ved -80°C, er det optimale vindue for organoid dyrkning inden for 6 uger efter konservering. Hvis væv opbevares i flydende nitrogen, kan konserveringstiden være længere, men helst ikke over seks måneder.
Q: Når man udvinder primære celler, er der normalt fibroblaster blandet i. Hvordan skal de håndteres?
(1) På grund af den dårlige vedhæftning af fibroblaster kan de fjernes ved gentagen vedhæftning.(2) Reagenser til fjernelse af fibroblaster kan bruges, men hvorvidt de påvirker organoid dyrkning, kræver eksperimentel validering.
Q: Hvor meget originalt tumorvæv er nødvendigt for at dyrke tumororganoider? Er biopsiprøven tilstrækkelig?
Generelt bør kirurgisk væv være større end størrelsen af 2-3 sojabønner; hvis opnået via nålebiopsi, kræves mindst 2-3 prøver, mens endoskopiske biopsier kræver, at mindst seks eller flere tumorvæv fastklemmes.
Sp: Hvis prøven af tumorvæv er for lille, og antallet af dyrkede organoider er utilstrækkeligt til efterfølgende test, hvad skal der så gøres?
Da organoider afledt af tumorkilder kan udvise fænotypiske forskelle efter passage, anbefales passage generelt ikke. Det anbefales i litteraturen at begrænse passagen af organoider til 2-3 generationer, med et maksimum på 5 generationer. Hvis celletallet er for lille og ikke kan opfylde testkravene efter 5 generationer, kan du overveje at ændre testmetoden, såsom at bruge en mindre 384-brønds plade eller prøve mikrofluidchips til test.
Q: Vil der være normale celler i tumorvæv? Hvordan fjerner man disse normale celler?
Der kan være et lille antal normale celler. For det første, prøv at undgå at tage prøver af normalt væv under indsamlingen. For det andet, efter ekstraktion af primære celler, kan magnetisk perlesortering eller flowcytometri bruges til yderligere organoid dyrkning. Når et meget lille antal normale celler er til stede, påvirker det ikke den efterfølgende organoide modellering og dyrkning væsentligt, så fjernelse er muligvis ikke nødvendig.
Q: Når man udvinder primære celler fra tumorvæv, hvorfor ser cellerne røde ud?
Væv er rige på blodforsyning in vivo, så der er mange røde blodlegemer. I de fleste tilfælde kræver dette ikke forarbejdning og påvirker ikke organoid dyrkning. Hvis der er for mange røde blodlegemer, kan de passende behandles med lysisbuffer før dyrkning.
Q: Under organoid dyrkning findes sorte partikler. Hvordan fjerner man dem?
Sorte partikler er højst sandsynligt urenheder eller cellerester. De kan fjernes på to måder:
Fordøj organoiderne og vask dem gentagne gange med medium for at fortynde urenhederne.
Brug en steril kirurgisk kniv til at skære organoiderne i to, og brug derefter en 1 ml sprøjte fyldt med medium til forsigtigt at skylle urenheder ud fra organoiderne.
Spørgsmål: Er der en grænse for antallet af passager til organoid dyrkning, og hvor mange passager kan udføres?
Antallet af passager afhænger generelt af kildecellernes egenskaber. De fleste organoider kan passere in vitro i op til 10 gange (>6 måneder). Valget af dyrkningsbetingelser kan også have en vis indflydelse, idet konditioneret medium generelt er bedre end syntetisk faktormedium.
Q: Kan tumorcellelinjer (såsom HepG2-cellelinjen) dyrkes til PDO'er?
PDO'er er komplekse selvsamlede strukturer. 3D-kultursystemer dannet af enkelte cellelinjer kan ikke kaldes PDO'er; de omtales blot som 3D-sfæriske tilstande.
Q: Hvad er kriterierne for passage af organoider?
Afhængig af organoidernes udviklingsstatus varierer tiden, normalt mellem 5-10 dage, med en diameter på omkring 100-200μm. Nogle langsomt udviklende organoider kan tage flere uger at nå en passende overgangstilstand.
Q: Hvordan tæller man antallet af levedygtige organoider?
Under eksperimentet skal du tage den forudfremstillede Calcein-AM-opbevaringsopløsning ud og tilsætte Calcein-AM-opløsning til mediet til en slutkoncentration på 0,2 μmol/L. Inkuber ved 37°C i 60 minutter. Når tiden er gået, skylles det Calcein-AM-holdige medium langsomt væk med PBS og frisk medium tilsættes. Brug et fluorescensmikroskop med en excitationsbølgelængde på 490 nm og en emissionsbølgelængde på 515 nm til at observere og fotografere organoiderne. Levende organoider vil se grønne ud og have klare kanter. Tæl organoiderne med en diameter >20μm.
Q: Hvordan beregner man levedygtigheden af organoider?
Organoiders levedygtighed beregnes efter formlen: X=(Nive/Ntotal)×100%, hvor: X repræsenterer organoiders levedygtighed; Nlive repræsenterer antallet af levende organoider; Ntotal repræsenterer det samlede antal organoider.
Q: Hvad er metoderne til at identificere organoider?
Den mest grundlæggende metode er at observere organoidernes morfologi gennem et mikroskop og udføre H&E-farvning. Yderligere metoder omfatter Western Blot, qRT-PCR, immunfluorescens, flowcytometri for at påvise, om organoiderne udtrykker tilsvarende biomarkører. Genetisk sekventering kan identificere det genetiske match mellem de dyrkede organoider og kildevævet. For nogle organoider kan der udføres funktionelle tests for at se, om de har specifikke funktioner. For eksempel har undersøgelser vist, at maveorganoider kan udskille mavesyre, og hjerteorganoider kan slå autonomt.
Q: Kan normale celler også vokse til organoider? Hvordan fjerner man normale organoider under dyrkning af tumororganoider?
Normale celler kan også vokse til organoider. Metoder til at fjerne normale organoider omfatter: (1) Manuel udvælgelse baseret på HE-farvningsresultater under et mikroskop; (2) Oprensning af PDO'er ved at justere sammensætningen af dyrkningsmediet (såsom vækstfaktorer/småmolekylehæmmere); (3) Spredning af PDO'er i enkeltceller til flowcytometri eller magnetisk perlesortering.
Spørgsmål: Skal PDO'er fordøjes fra matrixgelen under forsøg med lægemiddelfølsomhed?
Nej, PDO'er har brug for en tredimensionel struktur for at simulere in vivo-forhold. Hvis der ikke er støtte fra matrixgelen, vil nøjagtigheden af lægemiddelfølsomhedseksperimenter blive påvirket. Generelt kan opløselige lægemidler trænge ind i matrixgelen for at virke på organoider, men når man udfører immuncytokemiske eksperimenter, er det nødvendigt at fjerne matrixgelen.
Q: Kan BOB-forsøg fuldstændig erstatte dyremodeller (PDX)?
PDO'er kan delvist erstatte PDX, men kan ikke helt erstatte dem.
Q: Hvad kan årsagerne være til unormal vækst af PDO'er under dyrkning, karakteriseret ved forkortede vækstcyklusser og hurtig spredning sammenlignet med tidligere forhold?
Eksterne faktorer: (1) Denne abnormitet kan være forårsaget af den omfattende vækst af visse kontaminerende celler, såsom fibroblaster. I sådanne tilfælde anbefales det at udføre sektionsfarvning og observation for at bekræfte tilstedeværelsen af disse kontaminerede celler og derefter fortsætte med at fjerne dem. (2) Ændringer i dyrkningsbetingelser, herunder tilføjelse af visse faktorer eller små molekyler, kan yderligere aktivere proliferationsvejene for PDO'er.
Interne faktorer: Mulige genetiske mutationer. For at verificere dette anbefales sekventering, og resultaterne bør sammenlignes med resultaterne for de primære PDO'er for at afgøre, om der er genetiske mutationer.
Q: Hvordan kan PDO'ers følsomhed over for lægemidler testes?
PDO'er kan testes for lægemiddelfølsomhed ved hjælp af metoder såsom CCK8-assay, ATP-cellelevedygtighedsassay og levende/død farvning. Vurdering af ATP-aktiviteten af tumororganoider er den mest almindelige metode. ATP er det vigtigste energimolekyle i celler og kan bruges til at måle cellulære metaboliske niveauer, hvilket afspejler antallet af levedygtige celler. Baseret på virkningen af lægemiddeladministration på cellulært ATP-indhold kan IC50-værdien (halvmaksimal inhiberende koncentration af det testede lægemiddel) for hvert lægemiddelregime beregnes ved hjælp af analysesoftware til at vælge de mest effektive lægemidler til tumorhæmning.
Spørgsmål: Er koncentrationsintervallerne for lægemiddelfølsomhedseksperimenter af PDO'er de samme som for primære tumorceller?
Nej, de er ikke ens. Typisk skal lægemiddelkoncentrationen for PDO'er være højere end for primære celler. Foreløbige eksperimenter kan udføres for at analysere de optimale koncentrationer for formelle lægemiddelfølsomhedseksperimenter.
Spørgsmål: På hvilket vækststadium skal organoider bruges til lægemiddeltestning?
Det anbefales generelt at bruge organoider inden for 5 passager til lægemiddeltestning. På dette stadium udviser organoider den bedste stabilitet og aktivitet.
Spørgsmål: Hvad er kriterierne for at bestemme succesen med organoid etablering?
(1) Tidlig foreløbig vurdering: Organoid morfologi ændres fra en cellulær tilstand til former som vakuolær, spirende, kompakt eller løs. (2) Identifikation af specifik biomarkørekspression, som bør svare til fordelingen i vævsskiver. Yderligere sekventeringsanalyse kan udføres for mere detaljerede sammenligninger.
Q: Hvordan adskiller organoid dyrkning sig fra almindelig cellekultur?
(1) Forskellige cellekulturmetoder: Organoider kræver støtte fra substrater eller rumlige strukturer for at opretholde deres tredimensionelle struktur, mens almindelig cellekultur ikke kræver dette. (2) Organoid kultur kræver opnåelse af ex vivo differentiering og selvsamling, hvilket kræver brug af kombinationer af forskellige cytokiner til induktion, hvilket resulterer i relativt komplekse dyrkningsmediekomponenter. Almindelig cellekultur involverer normalt kun en enkelt celletype, så dyrkningsmediets komponenter er relativt enkle.(3) Forskellige cellekilder: Organoider er afledt af multipotente epitelceller, mens almindelig cellekultur er velegnet til at dyrke forskellige typer udvalgte celler.
Spørgsmål: Hvordan kan jeg afgøre, om de 3D-sfærer, jeg dyrkede, er organoider, og om de stemmer overens med målvævet?
Metoder til at identificere organoider omfatter H&E-farvning, immunhistokemi (IHC), enkeltcelle-sekventering og andre. Det er nødvendigt at foretage multidimensionelle vurderinger fra morfologiske, histopatologiske og molekylærgenetiske perspektiver for at bestemme, om de er i overensstemmelse med målorganet eller vævet. For tumororganoider kan påvisning af specifikke biomarkører bruges til bekræftelse.
Spørgsmål: Hvis morfologien af organoiderne observeret under dyrkning afviger fra det, der er rapporteret i litteraturen, hvad kan årsagen være?
For det første kan der eksistere individuelle forskelle og heterogenitet i prøvekilder og undertyper. For det andet kan forskelle i kvaliteten af udvalgte cytokiner og nogle små molekyle inhibitorer, der anvendes til induktion, føre til variationer i differentieringsmorfologien af forskellige organoider. Det foreslås at bekræfte overensstemmelsen mellem organoid morfologi og kildevæv gennem metoder som HE-farvning, IHC og genetisk sekventering i stedet for udelukkende at stole på litteraturbeskrivelser.
Spørgsmål: Når man udfører lægemiddelfølsomhedseksperimenter med organoider, er det så nødvendigt at kontrollere mængden af DMSO, der bruges som opløsningsmiddel til lægemidler?
Ja, typisk lægemiddelfølsomhedseksperimenter kræver, at volumenprocenten af DMSO er mindre end 0,5 %.
Q: Hvordan kan organoider genvindes fra matrixgelen?
Følgende metoder anbefales: (1) Kommercielt tilgængelige organoidgenvindingsopløsninger (CAT#41421ES) kan bruges til forsigtigt og effektivt at opnå cellesuspensioner uden at beskadige celler eller celleoverfladeproteiner. (2) Matrixgelen kan optøs ved lav temperatur for at blødgøre den og frigive organoiderne.
Q: Mange organoider klæber til centrifugerørets vægge under genopretning. Hvordan kan inddrivelsesraten forbedres?
Ved centrifugering efter opsamling skal du bruge en vandret rotorcentrifuge og øge centrifugeringshastigheden passende. Generelt er en centrifugalkraft på ca. 300 g og en hastighed på ca. 1000-1200 rpm egnede.
Beslægtede cytokiner information
| Pprodukt Name | KAT | Størrelse |
| Human Wnt-3a | 92276ES10 | 10μg |
| 92278ES20 | 20μg | |
| 92701ES10 | 10μg | |
| Menneskelig Noggin | 92528ES10 | 10μg |
| 91330ES10 | 10μg | |
| 91306ES10 | 10μg | |
| 91502ES10 | 10μg | |
| 91701ES08 | 10μg | |
| 92602ES60 | 100μg | |
| 91204ES10 | 10μg | |
| 90601ES10 | 10μg | |
| 91113ES10 | 10μg | |
| 92279ES10 | 10μg | |
| 92055ES10 | 10μg | |
| 92053ES10 | 10μg | |
| 92129ES08 | 5μg | |
| 91304ES10 | 10μg | |
| 91702ES10 | 10μg | |
| 92252ES60 | 100μg | |
| 90103ES10 | 10μg | |
| 90104ES10 | 10μg | |
| 90197ES10 | 10μg | |
| 90144ES08 | 10μg | |
| 90196ES10 | 10μg | |
| 90194ES10 | 10μg | |
| 90111ES10 | 10μg | |
| 90120ES10 | 10μg | |
| 90198ES10 | 10μg | |
| 91605ES10 | 10μg | |
| 92251ES10 | 10μg | |
| 92566ES08 | 5μg | |
| 92102ES10 | 10μg | |
| 91103ES10 | 10μg | |
| 92711ES10 | 10μg | |
| 92122ES60 | 100μg | |
| 92201ES60 | 100μg | |
| 92275ES20 | 20μg | |
| Human BMP-2 | 92051ES10 | 10μg |
Relateret læsning:
Reference
