Ceturegel™ Basalmembranmatrix – Ihre erste Wahl
Mit der Weiterentwicklung der Stammzellentherapie und der organoidbasierten Arzneimittelentwicklung spielt die Basalmembranmatrix eine zentrale Rolle als Nährstoff und Träger für Stammzellkulturen und Organoide, 3D-Zellkulturen und andere Anwendungen, einschließlich Angiogenese, In-vivo-Tumorbildungsexperimente usw. Ceturegel™-Basalmembranextrakte werden aus Engelbreth-Holm-Swarm-Maustumoren (EHS) gewonnen, die reich an extrazellulären Matrixproteinen wie Laminin, Kollagen Typ IV, Nestin usw. sind. IGF, FGF und andere Wachstumsfaktoren. Bei Raumtemperatur polymerisiert die Ceturegel™-Basalmembranmatrix zu einer biologisch aktiven dreidimensionalen Matrix. Sie kann die Struktur, Zusammensetzung, physikalischen Eigenschaften und Funktionen der Zellbasalmembran in vivo simulieren, was für die Kultur und Differenzierung von Zellen in vitro von Vorteil ist und eine gute Matrigelalternative darstellt.
1. Was ist die Ceturegel™-Basalmembranmatrix?
2. Welche Rolle spielt die Ceturegel™-Basalmembranmatrix?
3. Was sind die Eigenschaften der Ceturegel™-Basalmembranmatrix?
4. Die beliebte Anwendung der Ceturegel™-Basalmembranmatrix
5. Häufig gestellte Fragen
6. Der Auswahlleitfaden für die Ceturegel™-Basalmembranmatrix von
1. Was ist die Ceturegel™-Basalmembranmatrix?
Die Matrix neben Endothelzellen, Epithelzellen, Muskel- und Nervenzellen bildet eine kontinuierliche, geschichtete extrazelluläre Matrix, die als Basalmembran bezeichnet wird. Die Basalmembran degeneriert und regeneriert sich während der Entwicklung und Wundheilung. Sie stützt nicht nur Zellen und Zellschichten, sondern spielt auch eine wichtige Rolle bei der Bildung von Geweben, indem sie die Zelladhäsion, Migration, Proliferation und Differenzierung beeinflusst, die alle Funktionen der Basalmembran sind. Daher kann man sagen, dass die Basalmembran die Hauptbarriere gegen die Invasion metastatischer Tumorzellen darstellt.
Abbildung 1. Die Ceturegel™ Basalmembranmatrix
Die von YEASEN entwickelte und produzierte Ceturegel™-Basalmembranmatrix enthält kein LDEV (Lactate Dehydrogenase Enhancing Virus) und hat einen extrem niedrigen Endotoxingehalt. Und nach Mykoplasmenerkennung wird sichergestellt, dass keine Mykoplasmenkontamination vorliegt, einschließlich verschiedener Typen wie Basiskonzentration, hohe Konzentration und niedriger Wachstumsfaktor.
2. Welche Rolle spielt die Ceturegel™-Basalmembranmatrix?
Die Ceturegel™-Basalmembranmatrix kann zur Herstellung von Basalmembranmatrizen für verschiedene Anforderungen verwendet werden. Sie kann für Zellsignalstudien verwendet werden, wie z. B. für die Untersuchung der Rolle von Wachstumsfaktoren bei der Bildung von Nierentubuli durch Nierenstammzellen von Mäusen, die Genexpressionstudie von Brustepithelstammzellen von Mäusen und das Tumorinvasivitätsexperiment von Transwell. Gleichzeitig kann sie für die Untersuchung von Zellmorphologie, biochemischer Funktion, Migration, Infektion und Genexpression verwendet werden. Die Ceturegel™-Basalmembranmatrix kann die Anheftung und Differenzierung von Epithelzellen und anderen Zelltypen, einschließlich Nervenzellen, Stammzellen, Säugetierepithelzellen, Melanomzellen, vaskulären Endothelzellen, Schilddrüsenzellen und Haarfollikelzellen, effektiv unterstützen. Gleichzeitig beeinflusst die Ceturegel™-Basalmembranmatrix auch den Proteinexpressionslevel von Brustepithelzellen von Mäusen und unterstützt die Regeneration peripherer Nerven.

Abbildung 2.Die wichtigsten Anwendungsgebiete der Ceturegel™ Basalmembranmatrix
Zellmigration und -invasion im Detail: Zellmigration, auch als Zellkriechen, -bewegung oder -bewegung bekannt, bezieht sich auf die Bewegung von Zellen, nachdem sie ein Migrationssignal empfangen oder einen Gradienten bestimmter Substanzen spüren. Zellmigration ist ein abwechselnder Prozess der Ausdehnung von Pseudopodien im Zellkopf, der Bildung neuer Adhäsionen und des Zurückziehens des Schwanzes des Zellkörpers. Zellmigration ist eine der Grundfunktionen normaler Zellen und auch ein physiologischer Prozess des normalen Wachstums und der Entwicklung des Körpers. Als allgegenwärtige Form der Bewegung lebender Zellen kann sie an einer Vielzahl kollektiver physiologischer und pathologischer Prozesse teilnehmen. Wie embryonale Entwicklung, Angiogenese, Wundheilung, Immunreaktion, Entzündungsreaktion, Arteriosklerose, Krebsmetastasen usw. Zellinvasion hingegen bezieht sich auf die Fähigkeit von Zellen, durch die extrazelluläre Matrix von einem Bereich in einen anderen zu wandern. Zellinvasion ist die Reaktion normaler Zellen und Krebszellen auf chemische und mechanische Reize. Zellinvasion tritt häufig bei den Prozessen der Wundheilung, Angiogenese, Entzündung, Tumorzellmetastasen und abnormalen Infiltration von Geweben auf.
3. Was sind die Eigenschaften der Ceturegel™-Basalmembranmatrix?
Hohe Sicherheit: kein LDEV (Laktatdehydrogenase erhöhtes Virus)
Konzentrationsvielfalt: der Konzentrationsbereich liegt zwischen 8~20 mg/ml
Gute Chargenstabilität: strenger Produktionsqualitätsprüfprozess, um eine stabile Leistung zwischen den Chargen zu gewährleisten
Niedriger Endotoxingehalt: Endotoxingehalt <8 EU/ml
Kontaminationserkennung: Es wurden keine Mykoplasmen-, Bakterien- und Pilzrückstände nachgewiesen
Hohe Einzelchargenleistung: Die Einzelchargenleistung liegt über dem 50L-Niveau
Kompatibilität: Kompatibel mit jeder Art von Zellkulturmedium
4. Die beliebte Anwendung der Ceturegel™-Basalmembranmatrix
4.1 Migrations- und Invasionstest
Die experimentelle Methode zur Ermittlung der Fähigkeit zur Zellmigration und -invasion ist das Transwell-Experiment, und Transwell wird auch Perforationsexperiment genannt. Die Zellsuspension wird zuerst in die Kammer gegeben, da die Kammer dichte Poren hat. Die Kammern wurden dann in eine 24-Well-Platte gegeben, der ein vollständiges Medium zugegeben wurde. Zellen verformten sich und gelangten durch Löcher in der Kammer nach außen in die nährstoffreichere Kammer, wo sie an der Außenseite haften blieben. Durch Färben und Zählen der Zellen außerhalb der Kammer kann die Migrations- und Invasionsfähigkeit der Zellen beurteilt werden. Das Prinzip von Transwell besteht darin, die kleine Kammer in die Kulturplatte zu geben, die kleine Kammer wird als obere Kammer bezeichnet und die Kulturplatte als untere Kammer. Die oberen und unteren Schichten der Kulturflüssigkeit sind durch eine Polycarbonatmembran getrennt, die obere Schicht der Kulturflüssigkeit wird in die obere Kammer gegeben und die untere Schicht der Kulturflüssigkeit wird in die untere Kammer gegeben. Die Zellen befinden sich in der oberen Kammer, und die Zusammensetzung des unteren Mediums beeinflusst die Zellen in der oberen Kammer aufgrund der Durchlässigkeit der Membran. Darüber hinaus wurden die Auswirkungen der Komponenten im unteren Medium auf Zellwachstum und Zellbewegung untersucht.
Spezifische Operationen der Ceturegel™-Basalmembranmatrix in Migrations- und Invasionsassays: Die verdünnte Ceturegel™-Basalmembranmatrix wurde in die obere Kammer des Transwell gegeben, und die Zellen wurden plattiert und in einem 37°C, 5% CO2 24 Stunden im Inkubator, in 4 % Paraformaldehyd fixiert und mit 0,1 % Kristallviolett-Färbelösung gefärbt. Die Zellen wurden unter einem invertierten Phasenkontrastmikroskop beobachtet und gezählt.
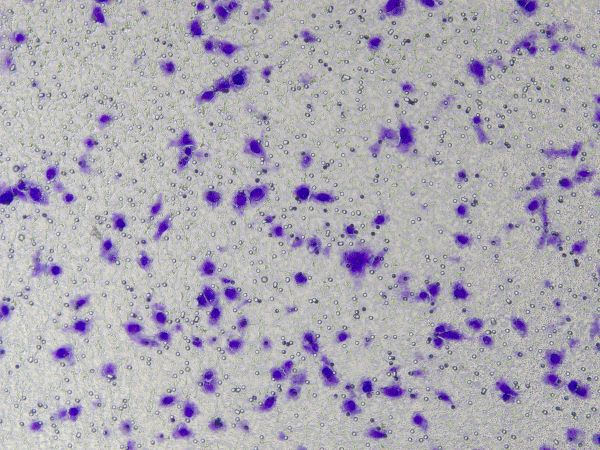
Abbildung 3. Ergebnisse der Kristallviolettfärbung nach Zellinvasion
4.2 Angiogenese
1) Einen Tag vor dem Experiment das Ceturegel™ herausnehmen Nehmen Sie das Matrigel aus dem Gefrierschrank und legen Sie es über Nacht zum Auftauen in einen 4 °C kalten Kühlschrank, während Sie die gebrauchten Verbrauchsmaterialien vorkühlen.
2) Bewahren Sie Ceturegel™ Matrigel vor dem Experiment immer in einer Eisbox auf. Öffnen Sie die sterile Verpackung der angiogenen Objektträger und entnehmen Sie die Objektträger.
3) Geben Sie 10 μl Ceturegel™ Matrigel in jede Vertiefung. Beachten Sie, dass die Pipettenspitze beim Hinzufügen von Ceturegel™ Matrigel senkrecht zur Oberseite der inneren Öffnung stehen sollte, um zu verhindern, dass das Matrigel durch die obere Öffnung fließt und einen Klebstoffrückstand hinterlässt.
4) Decken Sie zunächst den Objektträger ab, bereiten Sie eine 10 cm große Petrischale vor und legen Sie in Wasser getränkte Papiertücher hinein, sodass eine Nassbox entsteht.
5) Legen Sie die Objektträger in die Petrischale und decken Sie die Petrischale ab. Stellen Sie sie in ein CO2 Inkubator, lassen Sie es etwa 30 Minuten stehen, warten Sie, bis das Gel gerinnt, und bereiten Sie gleichzeitig die Zellsuspension vor.
6) Bereiten Sie die verdauten Zellen zu einer Zellsuspension mit einer Dichte von 2*105 Zellen/ml und gründlich mischen.
7) Entnehmen Sie den Objektträger mit dem zu einem Gel erstarrten Blutgefäß. Geben Sie 50 μl der Zellsuspension in jede Vertiefung. Achten Sie dabei darauf, dass die Pipettenspitze senkrecht über der oberen Vertiefung steht und das Gel in der unteren Vertiefung nicht berührt.
8) Das Zellkulturmedium hinzufügen, den Deckel schließen und stehen lassen. Nach einiger Zeit sinken alle Zellen an die Oberfläche des Matrigels.
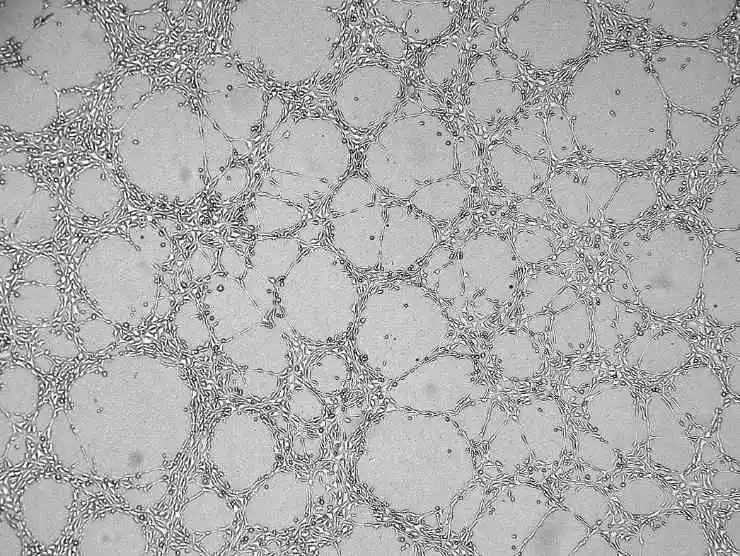
Abbildung 4. Diagramm mit Angiogenese-Ergebnissen
Immunfluoreszenzfärbung
1) Entfernen Sie das Medium vorsichtig aus den Vertiefungen, ohne den Klebstoff oder das Zellnetzwerk zu berühren. Verdünnen Sie Calcein in serumfreiem Medium auf eine Endkonzentration von 6–8 µg/ml. Fügen Sie Zellfärbelösung hinzu, um die Zellen vollständig einzutauchen, und inkubieren Sie sie 30–40 Minuten lang bei Raumtemperatur im Dunkeln.
2) Dreimal mit PBS waschen. Beachten Sie, dass PBS langsam in die oberen Vertiefungen gegeben werden sollte, um eine Beeinträchtigung der Zellen zu vermeiden. Fluoreszenzbeobachtung mit Wellenlängen von Ex = 485 nm, Em = 529 nm
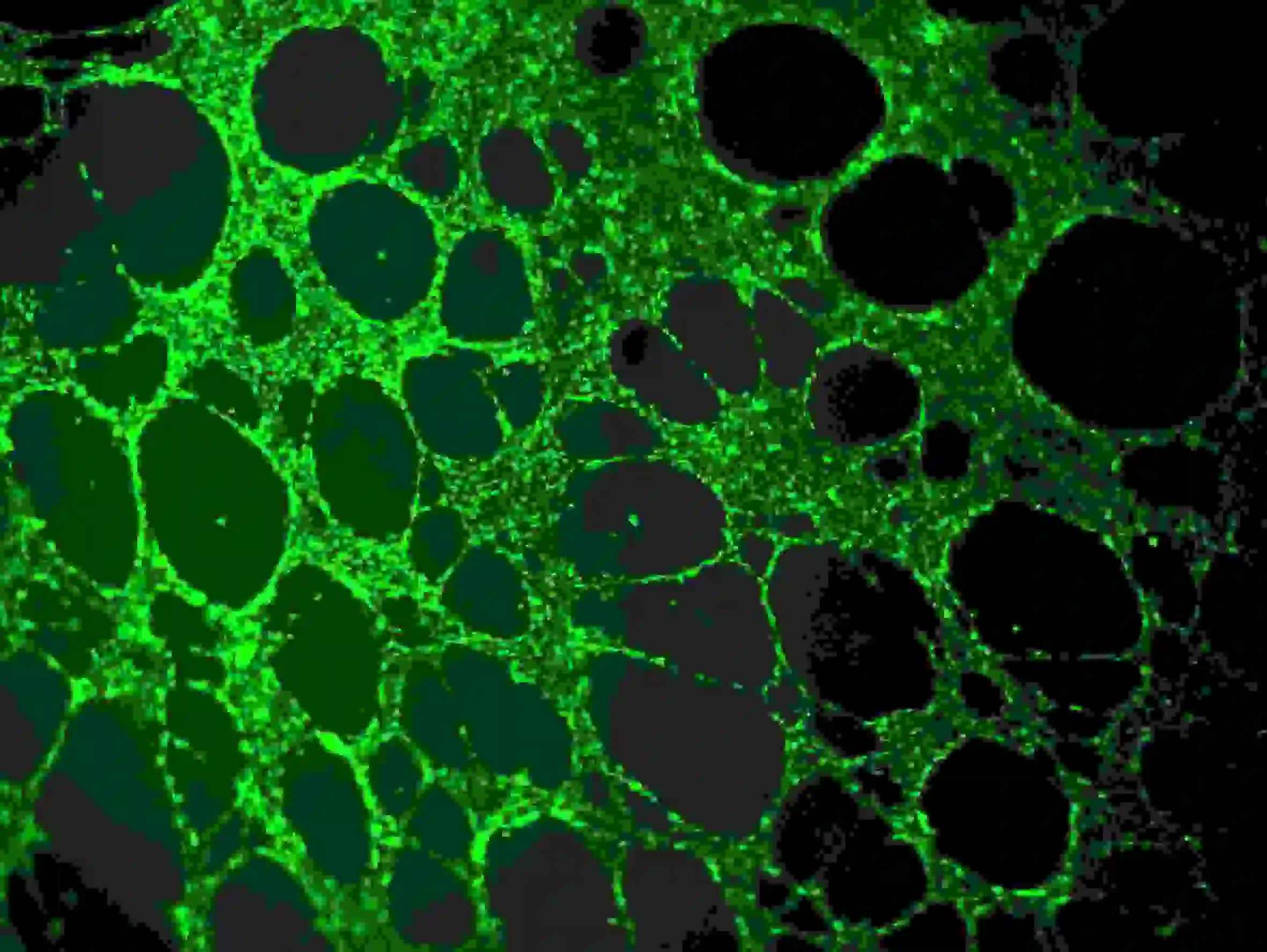
Abbildung 5. Immunfluoreszenzfärbung von Blutgefäßen
4.3 3D-Zellkultur
Im Gegensatz zur traditionellen Zellkultur reproduziert die 3D-Zellkultur die In-vivo-Umgebung von Zellen. Sogar einfache Sphäroidmodelle können die Mängel von Monolayer-Kulturen ausgleichen. Diese Strukturen können Gradienten von Sauerstoff, Nährstoffen, Metaboliten und löslichen Signalen bilden, die wiederum vielfältige Zellpopulationen bilden. Die 3D-Zellkulturtechnologie kann die natürliche Umgebung, in der Zellen in Organismen leben, besser simulieren, wodurch die Interaktionen zwischen Zellen und biochemischen und physiologischen Reaktionen realistischer werden. In einer 3D-Umgebung ähneln die Reaktionen der Zellen auf endogene und exogene Reize stärker ihren In-vivo-Reaktionen.
Die konkrete Funktionsweise der Ceturegel™-Basalmembranmatrix in der 3D-Zellkultur ist wie folgt: Mischen Sie die Ceturegel™-Basalmembranmatrix vorsichtig mit der angepassten Konzentration der Einzelzell-HepG2-Suspension 1:1 und geben Sie mit einer vorgekühlten Pipettenspitze 50 μl der oben gemischten Einzelzellsuspension in die vorgekühlte 24-Well-Platte, um bogenförmige Zelltröpfchen zu bilden, die in einem Inkubator mit 37 °C und 5 % CO2 kultiviert und täglich beobachtet und fotografiert werden.
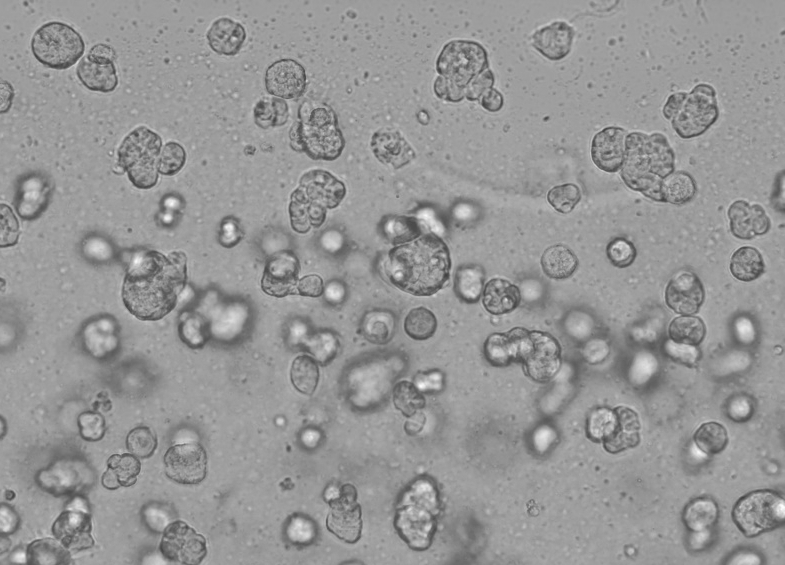
Abbildung 6. Ergebnisse der 3D-Zellkultur
Tabelle 1. 3D-Zellkultur Ceturegel™ Basalmembranmatrix Verwendungshinweis:
| Kulturplattentyp (Schale) | Zellkulturfläche (cm2) | Dosierung bei der Anwendung (Konzentration ≥ 3 mg/mL)* |
|---|---|---|
| 6-Well-Platte | 9.6 | 200 μL/cm2 |
| 12-Well-Platte | 4.5 | 180 μL/cm2 |
| 24-Well-Platte | 2.0 | 180 μL/cm2 |
| 96-Well-Platte | 0,32 | 160 μL/cm2 |
| 35 mm Gericht | 11,78 | 200 μL/cm2 |
| 100 mm Gericht | 58,95 | 200 μL/cm2 |
Hinweis: Verschiedene Chargen der Ceturegel™-Basalmembranmatrix weisen einen gewissen Konzentrationsunterschied auf. Die empfohlene Dosierung dient nur als Referenz
4.4 Tumorbildungsexperiment in vivo
Am Beispiel des subkutanen Tumorgenese-Experiments von HepG2-Zellen in Nacktmäusen wurden Ceturegel™-Basalmembranmatrix und Zellsuspension für eine 1:1-Verdünnung verwendet und weibliche BALB/c-nu-Mäuse im Alter von 4–5 Wochen subkutan inokuliert. Der experimentelle Ablauf ist wie folgt:
♦ Bereiten Sie HepG2-Zellen mit logarithmischem Wachstum und einer Zelldichte von etwa 80–90 % vor und wechseln Sie das frische Medium am Abend vor der Zellentnahme.
♦ Die Zellen werden durch Trypsin verdaut. Wenn die Zellen rund werden und die Kulturschale nicht verlassen, wird das Trypsin entfernt, das serumfreie Medium wird hinzugefügt, um die Zellsuspension herzustellen, einmal zentrifugiert und gereinigt, und die Endkonzentration beträgt 5 × 107 Zellen/ml.
♦ Verdünnen Sie die Zellsuspension und die Ceturegel™-Basalmembranmatrix im Verhältnis 1:1 bei 4 ℃, um eine Endkonzentration von 5 × 10 herzustellen7 Zellen/ml.
♦ Nehmen Sie mit der linken Hand eine fixierte Nacktmaus und injizieren Sie sie subkutan an der rechten Schulter der Nacktmaus. Während der Injektion wird die Nadel etwas tiefer (ca. 1 cm) subkutan eingeführt, um das Überlaufen der Zellsuspension aus dem Nadelöhr nach der Injektion zu verhindern.
Das Inokulationsvolumen beträgt 200 μl. (Dieser Vorgang sollte möglichst innerhalb einer halben Stunde abgeschlossen sein. Unterwegs sollte die Zellsuspension auf Eis gelegt werden, um die Zellapoptose zu verlangsamen und ein Gelphänomen zu verhindern.)
♦ Setzen Sie die Nacktmäuse zur weiteren Fütterung zurück in den Käfig. Der Tumor ist etwa eine Woche bis einen Monat lang sichtbar.Gemäß dem Versuchsaufbau werden die Nacktmäuse eingeschläfert, wenn das Tumorvolumen die Anforderungen erfüllt, und es werden Fotos gemacht.
Hinweis: Bei der Kontrollgruppe handelt es sich um eine Suspension aus Kulturmedium und Zellen. Die endgültige Dichte entspricht der der Matrixkleber-Testgruppe.
4.5 Organoidkultur
Organoide sind dreidimensionale, vielzellige, winzige Gewebe, die sich aus Stammzellen differenzieren. Einige Eigenschaften von Organen können reproduziert werden. Organoide sind vielzellig und weisen einen hohen Grad an Selbstassemblierung auf. Daher können sie komplexe zelluläre Reaktionen und Interaktionen in vivo besser zeigen als herkömmliche 2D-Kulturen. Stammzellen und/oder Organvorläuferzellen aus normalem oder erkranktem Gewebe können mit der Ceturegel™-Basalmembranmatrix oder Kollagen gemischt werden. Sie bilden Niere, Schilddrüse, Leber, Gehirn, Lunge, Darm, Prostata und andere Mikroorganismen. Forscher, die beispielsweise genetische Screens durchführen, können Ceturegel™-Basalmembranmatrixsubstrate als Biotinten verwenden, um eine präzise Lokalisierung und Einbettung lebender Zellen/Organoide im 3D-Bioprinting zu ermöglichen.
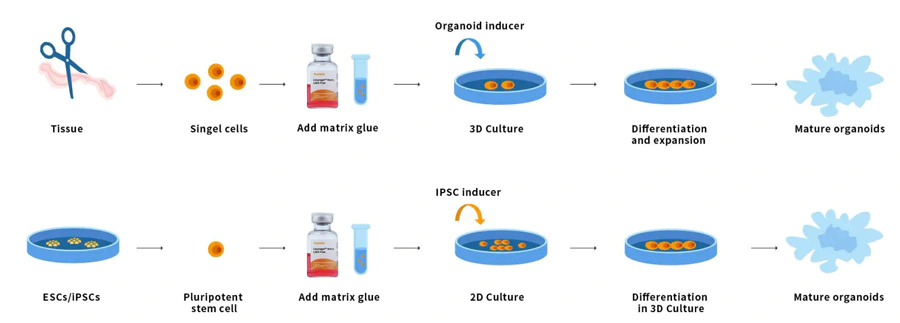
Abbildung 7. Organoid-Operationsprozess
Konstruktion von Organoiden des Dünndarms von Mäusen
Probenvorbereitung: Die Mäuse wurden durch Aufschneiden der Hälse getötet und die Oberfläche zur Sterilisation mit Alkohol besprüht. In einer sterilen Umgebung wurde das Darmgewebe 3 bis 15 cm weit in der Nähe des Magenendes herausgeschnitten, das Mesenterium und das Fett außerhalb des Darmtrakts vorsichtig mit einer Pinzette entfernt und in eine auf 4 °C vorgekühlte DPBS-Lösung mit 1 % Doppelantikörper gegeben.
Reinigung der Probe: Spülen Sie den Darmtrakt 2–3 Mal mit einer Spritze, schneiden Sie den Darmtrakt mit der Darmhöhle nach oben vorsichtig mit einer chirurgischen Schere durch und schaben Sie mit einer chirurgischen Klinge vorsichtig die Darmzotten an der Oberfläche der Darmhöhle ab. Nachdem die Darmzotten abgeschabt wurden (wobei transparentes Gewebe sichtbar wird), legen Sie das Darmgewebe 2–3 Mal in eine neue Kulturschale mit DPBS.
Erste Probenbehandlung: Schneiden Sie das gewaschene Dünndarmgewebe in 2 mm breite kleine Stücke und geben Sie diese dann in ein neues 50-ml-Zentrifugenröhrchen. Waschen Sie sie 3-5 Mal vorsichtig mit DPBS, um Darmzottenzellen und schwimmendes Fettgewebe zu entfernen.
Probenverdauung: Geben Sie den gereinigten Dünndarmfragmenten zur Verdauung 10–15 ml vorgekühltes DPBS mit 3–5 mM EDTA hinzu, inkubieren Sie es etwa 30 Minuten lang bei 4 °C und schütteln Sie das Zentrifugenröhrchen während dieser Zeit alle 10 Minuten vorsichtig.
Nach der Verdauung den Überstand der EDTA-Verdauungslösung verwerfen und die Gewebe 2–3 Mal vorsichtig mit neuer DPBS-Pufferlösung spülen, um das restliche EDTA zu entfernen.
Geben Sie 10–15 ml vorgekühltes DPBS mit 0,1 % BSA in die Dünndarmgewebefragmente, blasen Sie die Gewebefragmente wiederholt und resuspendieren Sie sie, um die Vertiefung von der Basalschicht zu trennen, und entnehmen Sie dann eine kleine Menge der Suspension zur mikroskopischen Untersuchung. Wenn eine große Anzahl vertiefungsähnlicher Strukturen sichtbar ist, hören Sie auf zu blasen und verwenden Sie für die geblasene Gewebesuspension ein 70 % μM-Filtersieb, um die durch das Filtersieb hindurchtretende Gewebesuspension zu filtern und zu sammeln.
Wiederholen Sie die Schritte 5–6 zweimal und zentrifugieren Sie 3 Minuten lang bei 1500 U/min und 4 °C.
Bildung der Mischung: Ceturegel™ Matrixkleber-Schwerstoffsuspension vertieft Gewebefällung, jede 10 μL Matrixklebersuspension enthält 200 bis 600 Vertiefungen. Nach der Resuspension wird die Mischung auf Eis gelegt und so schnell wie möglich verarbeitet, um zu verhindern, dass der Matrixkleber ein Gel bildet.
Hinweis: Das Verdünnungsverhältnis des Matrixklebers sollte ≥ 50 % betragen, um die Stabilität der Matrixkleberstruktur von Ceturegel™ während des Kultivierungsprozesses sicherzustellen.
Geben Sie die gemischte Suspension in die Mitte des Bodens der 24-Well-Platte, 30–50 µl pro Well nach links und rechts, um zu vermeiden, dass die Suspension mit der Seitenwand der Blendenplatte in Berührung kommt.
Legen Sie die kultivierte Kulturplatte in einen Kohlendioxid-Inkubator mit konstanter Temperatur von 37 °C und inkubieren Sie sie etwa 30 Minuten lang, bis das Matrixgel erstarrt.
Warten Sie auf Ceturegel™. Nachdem der Matrixkleber vollständig ausgehärtet ist, geben Sie langsam das vorbereitete Darmorgankulturmedium entlang der Wand hinzu, 800 µl pro Vertiefung.
Legen Sie die 24-Well-Platte zur Kultivierung in einen 37 °C heißen Kohlendioxid-Inkubator. Ersetzen Sie das frische Medium alle 3 Tage und überwachen Sie den Wachstumsstatus eines Organs. Im Allgemeinen bildet sich das Dünndarmorgan von Mäusen innerhalb von 5-7 Tagen.
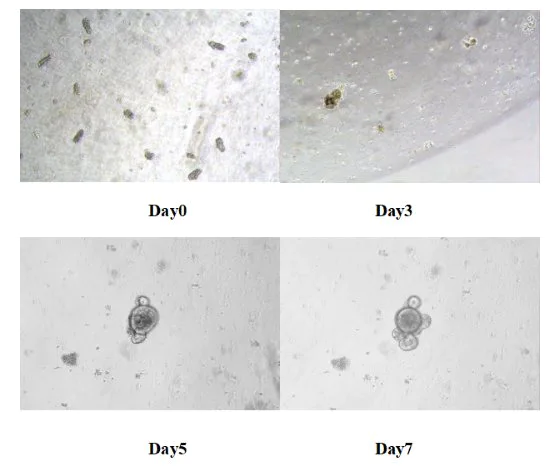
Abbildung 8. Ergebnisse der In-vitro-Kultur von Dünndarm-ähnlichen Organen bei Mäusen
5. Häufig gestellte Fragen
1. Was ist der Grund für den Farbunterschied (hellgelb bis dunkelrot) des erhaltenen Substrats?
Bei der Ceturegel™-Basalmembranmatrix, die Phenolrot enthält, wird sie hauptsächlich durch die Wechselwirkung von Phenolrot und Bicarbonat mit CO verursacht.2, aber der Farbunterschied verringert sich nach Äquilibrierung mit 5% CO2. Schütteln Sie das Fläschchen nach dem Einfrieren und Auftauen vorsichtig, um die Ceturegel™-Basalmembranmatrix gleichmäßig zu verteilen.
2. Worauf sollte beim Betrieb der Ceturegel™-Basalmembranmatrix geachtet werden?
Alle Vorgänge sollten in einer sterilen Umgebung durchgeführt werden und es sollte eine vorgekühlte Pipette verwendet werden, um sicherzustellen, dass die Ceturegel™-Basalmembranmatrix homogenisiert wird.
3. Wie wird die Ceturegel™-Basalmembranmatrix zur Verwendung eingefroren und gelagert?
Die gefrorene und aufgetaute Ceturegel™ Matrix LDEV-freie Ceturegel™ Basalmembranmatrix kann in mehrere kleine Röhrchen verteilt werden. Alle Verteilungen sollten in vorgekühlten Kryoröhrchen erfolgen, die schnell eingefroren und gelagert werden sollten, um mehrfaches Einfrieren und Auftauen zu vermeiden. Alle beteiligten Gegenstände sollten vor der Verwendung vorgekühlt werden. Verwenden Sie vorgekühlte Pipetten, Spitzen und kleine Röhrchen zum Umgang mit der Ceturegel™ Basalmembranmatrix.
6. Der Auswahlleitfaden für die Ceturegel™-Basalmembranmatrix von Yeasen
Verschiedene Arten von Ceturegel™-Basalmembranmatrix haben unterschiedliche Anwendungen. Standardkonzentrationen der Ceturegel™-Basalmembranmatrix können für polare Zellkulturen wie Epithelzellen verwendet werden. Sie können die Differenzierung verschiedener Zellen fördern und für Experimente zur Tumorzellmigration und -invasion verwendet werden. Hohe Konzentrationen der Ceturegel™-Basalmembranmatrix werden häufig in vivo verwendet und können für Experimente zur Tubulusbildung verwendet werden. Die Hauptfunktion des niedrigen Wachstumsfaktors (GFR) besteht darin, die Interferenz von Wachstumsfaktoren im Experiment zu eliminieren, und sie eignet sich für Studien mit hohen Anforderungen an die Basalmembranvorbereitung. Die Ceturegel™-Basalmembranmatrix ohne Phenolrot kann die Interferenz des Phenolrot-Indikators eliminieren und eignet sich für Farbentwicklungsexperimente wie Kolorimetrie und Fluoreszenzerkennung. Die Ceturegel™-Basalmembranmatrix in Kulturqualität für menschliche embryonale Stammzellen wird speziell für die Kultur menschlicher embryonaler Stammzellen und induzierte pluripotente feederfreie Stammzellkulturen verwendet.
Tabelle 2. Ceturegel™Matrix-Auswahlhilfe
| Produkttyp | Katzen-Nr. | Produktname | Matrigel Kat.-Nr. | Anwendungsrichtung |
| Basiskonzentration (8-12 mg/ml) | 40183ES | 356234/ 354234 | Passt sich an 2D- und 3D-Kultur-, Invasions- und Migrationsexperimente an und kann auch für tumorbildende Experimente in vivo verwendet werden | |
| 40184ES | 356237 | Wird hauptsächlich zur Farberkennung verwendet, z. B. bei Fluoreszenzerkennungsexperimenten usw. | ||
| Reduzierung des Wachstumsfaktors
| 40185ES | 354230 | Hauptsächlich, um die Beeinflussung des Experiments durch Wachstumsfaktoren auszuschließen. Wird auf verwandte Forschungen zu Wachstumsfaktoren, Signalwegen usw. angewendet. | |
| 40186ES | 356231 | |||
| Hohe Konzentration (≥18mg/ml) | 40187ES | 354248 | Wird hauptsächlich in Experimenten wie Angiogenese, Gelembolisation und Tumorbildung in vivo verwendet (für die Angiogenese wird eine Endkonzentration der Ceturegel™-Basalmembranmatrix von ≥10 mg/ml empfohlen) | |
| 40189ES (Anfrage) | Ceturegel™Matrix Hohe Konzentration, GFR, LDEV-frei | 354263 | ||
| 40188ES | Ceturegel™Matrix Hohe Konzentration, Phenolrot-frei, LDEV-frei | 354262 | ||
| Für Stammzellen | 40190ES | 354277 | Wird hauptsächlich für Stammzellkulturen wie hESC, iPSC usw. verwendet. | |
| Organoid-spezifisch | 40191ES (Anfrage) | Ceturegel™Matrix für Organoidkultur, Phenolrot-frei, LDEV-frei | 356255 | Ceturegel™ Basalmembranmatrix für die Organoidkultur |
