Beschreibung
Hieff NGS® DNA&RNA Bibliothek Co-Prep Kit Version 2 ist ein DNA&RNA Co-Library Kit für die Illumina®&MGI® Sequenzierungsplattform, das effiziente cDNA Synthesereagenzien und Enzymverdauungsreagenzien enthält. Im Vergleich zur traditionellen Bibliothek Konstruktion Methode, dieses Produkt kann effizient cDNA-Synthese und DNA&RNA-Bibliothek abschließen Konstruktion in einem Röhrchen. Das Kit enthält ein hochwertiges Enzym zur DNA-Fragmentierung und kombiniert DNA-Fragmentierung, Endreparatur und dA-Tailing in einem Schritt, was den Zeit- und Kostenaufwand für die Bibliotheksvorbereitung erheblich reduziert. Dieses Bibliotheksvorbereitungskit weist eine hervorragende Bibliothekskonvertierungsrate auf und ist für Proben aller gängigen Tiere, Pflanzen, Mikroorganismen usw. sowie für FFPE-Proben anwendbar. Dieses verbesserte Kit mit der neuesten optimierten Ligase verringert die Selbstligationsrate während der Adapterligation erheblich. Darüber hinaus verbessert die Einführung einer neuen hochpräzisen Polymerase die Homogenität und Genauigkeit der Amplifikation weiter.
Alle im Kit enthaltenen Komponenten wurden einer strengen Qualitätskontrolle und Funktionsüberprüfung unterzogen, wodurch die Stabilität und Wiederholbarkeit des Bibliotheksaufbaus im höchsten Maße gewährleistet wird.
Technische Daten
| Kat.-Nr. | 12305ES08 / 12305ES24 / 12305ES96 |
| Größe | 8 T / 24 T / 96 T |
Komponenten
| NEIN. | Name | 12305ES08 | 12305ES24 | 12305ES96 | |
| 12305-A | Zufällige Grundierung | 20 μL | 60 μL | 240 μL | |
| 12305-B | cDNA-Reaktionspuffer | 64 μL | 192 μL | 768 μL | |
| 12305-C | cDNA-Enzym-Mix | 16 μl | 48 μL | 192 μl | |
| 12305-D | Smearase-Puffer | 80 μl | 240 μL | 960 μl | |
| 12305-E | Smearase Enzymmischung | 40 μl | 120 μL | 480 μL | |
| 12305-F | Ligationsverstärker | 240 μl | 720 μL | 2×1440 μL | |
| 12305-G | Roman T4 DNA Ligase | 40 μl | 120 μL | 480 μl | |
| 12305-H | 2×Super Canace® II Hi-Fi-Mix | 200 μl | 600 μl | 2×1200 μL | |
| * | Grundierungsmischung* | 40 μl | 120 μL | 480 μl | |
Notiz: * zeigt an, dass dieses Reagenz nicht in diesem Kit enthalten ist und zusätzliche Reagenzien erforderlich sind. Das Kit Ist kompatibel mit Dual-Plattformen von Illumina®&MGI®, aber zusätzliche Primer-Mischung (CAT # 13334 Primer-Mischung für MGI® und Kat.-Nr. 13335 Primer Mix für Illumina®) ist erforderlich.
Arbeitsablauf:
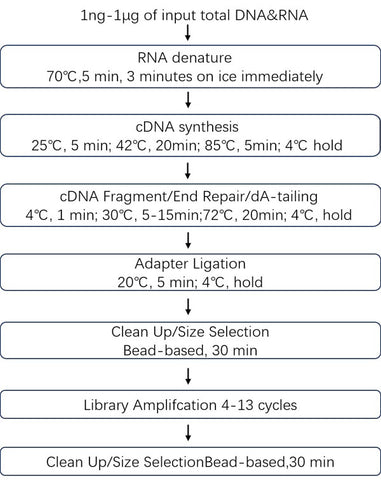
Lagerung
Dieses Produkt sollte bei -25~-15℃ gelagert werden für 1 Jahr.
Hinweise
Über die Operation
- 1. Tragen Sie zu Ihrer Sicherheit bitte Laborkittel und Einweghandschuhe.
- Komponenten bei Raumtemperatur auftauen.Nach dem Auftauen gründlich durch Vortexen mischen, die Röhrchen kurz zentrifugieren und für die spätere Verwendung auf Eis legen.
- Es wird empfohlen, jeden Reaktionsschritt in einem Thermocycler mit beheiztem Deckel durchzuführen. Der Thermocycler sollte vor Gebrauch auf die eingestellte Temperatur vorgeheizt werden.
- Bitte verwenden Sie Verbrauchsmaterialien ohne RNaseKontamination und Reinigung des Versuchsbereichs regelmäßig. ThermoFishers RNAZapTM Zur Entfernung einer RNase-Kontamination wurde ein hochwirksames Nukleinsäureentfernungsspray empfohlen.
- Durch unsachgemäße Handhabung kann es mit hoher Wahrscheinlichkeit zu Aerosolverunreinigungen kommen, die die Genauigkeit des Ergebnisses beeinträchtigen.Eine obligatorische physische Isolierung der PCR-Reaktionsmischbereiche und der PCR-Produktreinigungstestbereiche wird empfohlen. Ausgestattet mit Geräten wie Spezialpipetten für den Bibliotheksaufbau.
- 6. Dieses Produkt ist nur für Forschungszwecke bestimmt.
Adapterligatur
- Kunden können je nach ihren experimentellen Anforderungen zwischen langen Adapter-Kits (Adapter mit Strichcode) und kurzen Adapter-Kits von Illumina oder MGI wählen.
- Es wird empfohlen, hochwertige, kommerzielle Adapter auszuwählen. Wenn Sie sich für selbst hergestellte Adapter entscheiden, vertrauen Sie diese bitte einem Unternehmen mit Erfahrung in der NGS-Primersynthese an und weisen Sie auf die Notwendigkeit einer strengen Kontaminationskontrolle hin. Darüber hinaus wird empfohlen, die DNA-Annealing-Lösung in einer Reinraumbank vorzubereiten und jedes Mal nur einen Adaptertyp zu verwenden, um Kreuzkontaminationen zu vermeiden.
- Tauen Sie die Adapter bitte auf Eis oder bei 4°C auf, bei Betrieb bei Raumtemperatur sollte die Labortemperatur 25°C nicht überschreiten, um eine Denaturierung der Adapter zu vermeiden.
- Die Konzentration des Adapters wirkt sich direkt auf die Ligationseffizienz und die Bibliotheksausbeute aus. Das dem Kit hinzugefügte Adaptervolumen ist auf 5 μl festgelegt. Es wird empfohlen, die Adapter mit 0,1 × TE-Puffer zu verdünnen. Die verdünnten Adapter können 48 Stunden lang bei 4 °C gelagert werden. Tabelle1 listet die empfohlene Adaptermenge für unterschiedliche Mengen an Eingangs-RNA auf.
Tabelle 1-1 Die empfohlenen Illumina® Adaptermenge für verschiedene Eingänge DNA und RNA
| Eingabe Gesamt DNA&RNA | Illumina® Adapterbestandskonzentration |
| <10 ng | 3 μM |
| ≥10 ng | 15 μM |
Tabelle 1-2 Der empfohlene MGI® Adaptermenge für verschiedene Eingänge DNA und RNA
| Eingabe Gesamt DNA und RNA | MGI® Adapterbestandskonzentration |
| <10 ng | 5 μM |
| ≥10 ng | 10 μM |
*Die Adapternutzung kann je nach Art der Gesamt-RNA-Proben und Eingabemenge angepasst werden.
Bibliothekserweiterung
Die Anzahl der Amplifikationszyklen sollte streng kontrolliert werden. Unzureichende Amplifikation kann zu einer geringen Bibliotheksausbeute führen; Überamplifikation kann zu erhöhter Verzerrung, Fehlern, doppeltem Lesen und chimären Produkten führen. Tabelle 2 listet empfohlene Zykluszahlen auf, die auf eine Bibliotheksausbeute von 1 μg abzielen.
Tisch 2 Die empfohlene Anzahl von Zyklen zur Generierung einer DNA- und RNA-Bibliothek *
| Gesamt-DNA und -RNA eingeben | Anzahl der Zyklen |
| <1 ng | 10 bis 12 |
| 1 ng | 9 bis 10 |
| 10 ng | 6 bis 7 |
| 50 ng | 4 bis 5 |
| 100~1000 ng | 4 |
Hinweis: *Die Ausbeute der Bibliothek hängt nicht nur von der Eingangsmenge und der Anzahl der Amplifikationszyklen ab, sondern wird auch von der Qualität der Proben, den Fragmentierungsbedingungen und den Sortierbedingungen beeinflusst. Wählen Sie beim Aufbau der Bibliothek die am besten geeigneten Bedingungen entsprechend der tatsächlichen Situation aus.
DNA-Reinigung und Größenauswahl auf Perlenbasis
- 1. Es gibt mehrere Schritte im Bibliotheksaufbauprozess, die magnetische Perlen zur DNA-Reinigung erfordern. Wir empfehlen Hieff NGS™ DNA Selection Beads (Yeasen Cat#12601) oder AMPure® XP magnetische Perlen (Beckman Cat#A63880) zur DNA-Reinigung und Größenauswahl.
- 2. Die magnetischen Perlen sollten vor der Verwendung auf Raumtemperatur gebracht werden, da sonst die Ausbeute abnimmt und der Größenauswahleffekt beeinträchtigt wird.
- 3. Die magnetischen Perlen sollten vor der Verwendung durch Vortexen oder Pipettieren gut gemischt werden.
- 4. Saugen Sie die Perlen beim Übertragen des Überstands nicht ab, selbst kleinste Mengen der Perlen können die folgenden Reaktionen beeinträchtigen.
- 5. Der 80 %ige Ethanol muss frisch zubereitet werden, da sonst die Rückgewinnungseffizienz beeinträchtigt wird.
- 6. Die Magnetkügelchen sollten vor dem Eluieren des Produkts bei Raumtemperatur getrocknet werden. Unzureichende Trockenheit führt leicht dazu, dass Ethanolrückstände nachfolgende Reaktionen beeinträchtigen; übermäßige Trockenheit führt dazu, dass die Magnetkügelchen reißen und die Reinigungsausbeute verringert wird. Normalerweise reicht es aus, die Kügelchen 3–5 Minuten bei Raumtemperatur trocknen zu lassen, damit sie vollständig trocknen.
- 7.Falls erforderlich, werden die gereinigten oder größenselektierten DNA-Proben in1× TE-Puffer kann 1–2 Wochen bei 4 °C oder einen Monat bei -20 °C gelagert werden.
Analyse der Bibliotheksqualität
- Die Qualität der erstellten Bibliotheken wird im Allgemeinen durch Messen der Konzentrationen und Größenverteilungen analysiert.
- Die Konzentrationen von Bibliotheken können mit fluoreszenzbasierten Methoden wie Qubit und PicoGreen oder qPCR gemessen werden.
- Es wird NICHT empfohlen, absorptionsbasierte Quantifizierungsmethoden wie NanoDrop zu verwenden.
- Es wird empfohlen, die qPCR-Methode zur Quantifizierung von Bibliotheken zu verwenden: Fluoreszenzbasierte Methoden wie Qubit und PicoGreen können die unvollständigen dsDNA-Strukturen (Inserts ohne Adapter oder mit nur einem der mit Adapter ligierten Enden) nicht von den vollständigen Bibliotheken unterscheiden. Die qPCR-Methode amplifiziert und misst nur die vollständigen Bibliotheken, deren beide Enden mit Adaptern ligiert sind (die sequenzierbaren Bibliotheken) und bietet somit eine genauere Messung zum Laden.
- Die Größenverteilung von Bibliotheken kann mit Agilent Bioanalyzer oder anderen Geräten analysiert werden, die auf den Prinzipien der Kapillarelektrophorese oder Mikrofluidik basieren.
Andere Materialien
- 1.Magnetische Perlen zur DNA-Reinigung: Hieff NGS™ DNA Selection Beads (Yeasen Cat#12601) oder AMPure®XP Beads (A63880) oder andere gleichwertige Produkte.
2.Adapter: Komplettadapter für Illumina (Yeasen Cat#13519-13520 oder andere gleichwertige Produkte) oder Komplettadapter für MGI (Yeasen Cat#13360-13362 oder andere gleichwertige Produkte).
- Qualitätsanalyse der Bibliothek: Agilent 2100 Bioanalyzer DNA 1000 Chip/High Sensitivity Chip oder andere gleichwertige Produkte; quantitative Reagenzien für die Bibliothek.
- Andere Materialien: absoluter Ethanol, steriles Reinstwasser, Pipettenspitzen mit geringer Retention, PCR-Röhrchen, Magnetständer, Thermocycler usw.
Unterlagen:
12305ES-Hieff NGS® DNA&RNA Library Co-Prep Kit V2.pdf
Zahlung und Sicherheit
Ihre Zahlungsinformationen werden sicher verarbeitet. Wir speichern weder Kreditkartendaten noch Zugriff auf Ihre Kreditkarteninformationen.
Anfrage
Sie können auch mögen




FAQ
Das Produkt ist nur für Forschungszwecke bestimmt und nicht für die therapeutische oder diagnostische Anwendung bei Menschen oder Tieren. Produkte und Inhalte sind durch Patente, Marken und Urheberrechte von
Für bestimmte Anwendungen sind möglicherweise zusätzliche geistige Eigentumsrechte Dritter erforderlich.



