Beschreibung
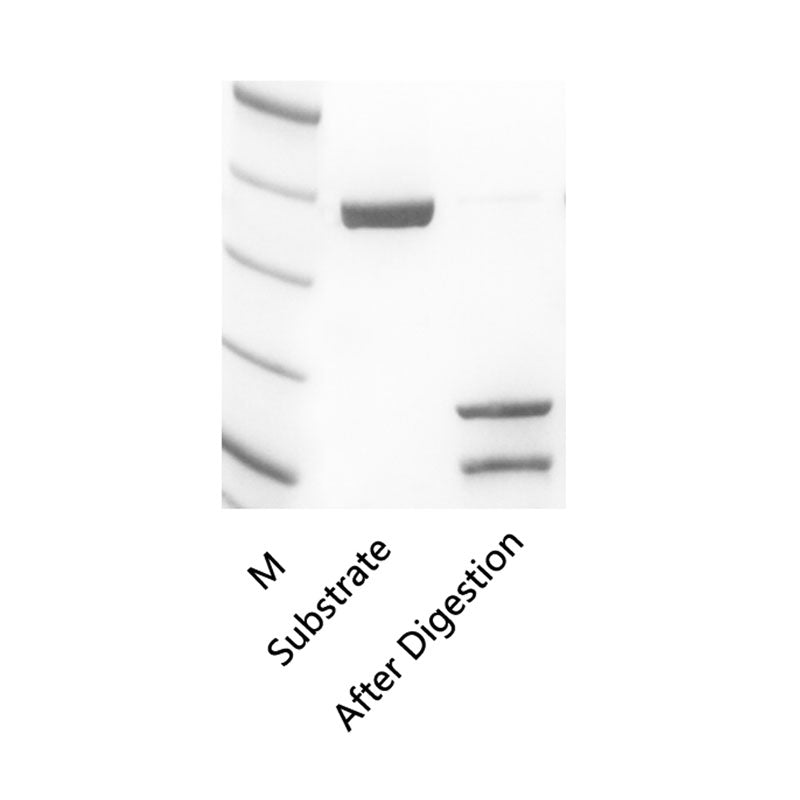
Rekombinante Enterokinase (rEK) ist ein hochreines Fragment der rekombinanten leichten Kette der bovinen Enterokinase. Seine Aminosäuresequenz ist identisch mit der leichten Kette der bovinen Enterokinase und weist enzymatische Spaltstellen auf, die so spezifisch sind wie die in natürlich extrahierter Enterokinase, mit Schnittstellen bei Asp-Asp-Asp-Asp-Lys. Dies ermöglicht die Entfernung des Fusionsproteins am N-Terminus des Proteins, wodurch unnötige Fusionsmarkierungen eliminiert werden. Darüber hinaus weist rEK im Vergleich zum natürlichen Enzym eine höhere Spaltungsaktivität auf.
Die rekombinante Enterokinase ist eine hochreine, hochaktive und hochspezifische bovine Enterokinase, die durch rekombinante Expression in Escherichia coli hergestellt wird. Da sie keine anderen Proteasen enthält, kann sie Fusionsproteine über einen breiten pH-Bereich (4,5–9,5) und einen weiten Temperaturbereich effektiv spalten. Sie behält ihre teilweise Aktivität sogar in Gegenwart verschiedener Detergenzien und Denaturierungsmittel. Dieses Produkt ist markierungsfrei und aufgrund seiner extrem hohen enzymatischen Spaltungsaktivität werden für Spaltungsreaktionen nur minimale Mengen benötigt, wodurch keine Interferenzen mit nachfolgenden Proteinanwendungen auftreten und eine Entfernung unnötig wird.
Besonderheit
Besonderheit: Das Enzym ist spezifitätsbezogen für eine bestimmte Aminosäuresequenz und spaltet an der Carboxylterminalstelle, die vier Asparaginsäuren gefolgt von Lysin enthält (DDDDK).
Tierfrei: Durch rekombinante Methoden hergestellt, wodurch eine Kontamination durch exogene Viren ausgeschlossen ist. Im Produktionsprozess werden keine Materialien tierischen Ursprungs verwendet.
Qualitätsstabilität: Durch die Chargenproduktion werden gleichbleibend stabile Chargen garantiert, ohne dass es zwischen verschiedenen Chargen zu Qualitätsschwankungen kommt.
Hohe Reinheit: Frei von anderen Proteasen, wodurch eine unspezifische Spaltung gewährleistet wird.
Einhaltung von Vorschriften: Produktionsanlagen und -umgebungen erfüllen die entsprechenden gesetzlichen Anforderungen. Der Herstellungsprozess entspricht den GMP-Richtlinien.
Umfassende Qualitätsdokumentation: Kann gemäß den Kundenanforderungen relevante behördliche Unterstützungsdokumente bereitstellen.
Spezifikation
| Quelle | Ausgedrückt in E.coli. |
| Molekulargewicht | 25,85 kDa |
| Aussehen | Klare, farblose Flüssigkeit. |
| Konzentration | ≥5 U/uL |
| Aktivitätsdefinition | Eine Aktivitätseinheit ist definiert als die Menge an Enzym, die erforderlich ist, um 95 % der 500 μg eines 30 kD Fusionsproteins mit Enterokinase-Spaltstellen unter folgenden Bedingungen: 25 °C, 12–16 Stunden, in einem Puffersystem bestehend aus 25 mM Tris-HCl, pH 8,0. |
| Endotoxin | <1 EU/µg |
| HCP | ≤ 0,01 % |
| Etikett | NEIN |
| Speicherpuffer | 50 mM Tris-HCl, pH 8.0,250 mM NaCl, 2 mM CaCl2, 50 % Glycerin |
Die Menge des pro Einheit Enterokinase (EK) gespaltenen rekombinanten Proteins
| Lieferanten | Yeasen 5 U/μL | Thermo 1 U/µL | NEB 16 U/μL |
| Aktivität | 500 μg/Einheit | 20 μg/Einheit | 25 μg/Einheit |
Lagerung
Bei -25 bis -15 °C lagern. für 1 Jahr.
Unterlagen:
Sicherheitsdatenblatt
Benutzerhandbücher
Zahlung und Sicherheit
Ihre Zahlungsinformationen werden sicher verarbeitet. Wir speichern weder Kreditkartendaten noch Zugriff auf Ihre Kreditkarteninformationen.
Anfrage
Sie können auch mögen
FAQ
Das Produkt ist nur für Forschungszwecke bestimmt und nicht für die therapeutische oder diagnostische Anwendung bei Menschen oder Tieren. Produkte und Inhalte sind durch Patente, Marken und Urheberrechte von
Für bestimmte Anwendungen sind möglicherweise zusätzliche geistige Eigentumsrechte Dritter erforderlich.