با عمیق تر شدن تحقیقات در مورد ارگانوئیدها، تعداد فزاینده ای از افراد به آن ملحق می شوند. این مقاله برخی از نکات دانش رایج در مورد ارگانوئیدها را خلاصه می کند [1-5]، امید است که برای همه مفید باشد.
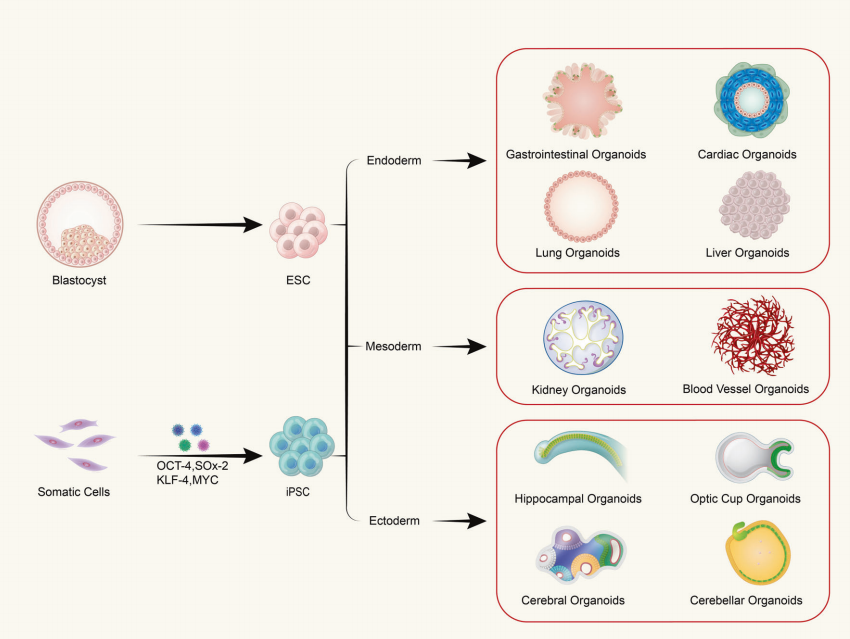
س: آیا ارگانوئیدها از یک نوع سلول یا بافت های چند سلولی تشکیل شده اند؟
ارگانوئیدها از کشت سه بعدی (3D) in vitro سلول های بنیادی بالغ یا سلول های بنیادی پرتوان تشکیل می شوند که در نتیجه ساختارهای بافت مانندی با سازمان فضایی مشخص ایجاد می شود. ارگانوئیدها ساختارهایی متشکل از سلول های منفرد نیستند. بلکه با القای تقسیم و تمایز سلولهای آغازگر با خواص سلولهای بنیادی تشکیل میشوند که سپس به صورت خودآرایی به بافتهایی با ساختار فضایی، مورفولوژی و عملکردی مشابه با اندامهای مربوطه در داخل بدن تبدیل میشوند.
س: منابع برای کشت ارگانوئیدها چیست؟
(1) ارگانوئیدهای مشتق شده از سلول های بنیادی پرتوان شامل سلول های بنیادی بالغ (ASC)، سلول های بنیادی پرتوان (PSC) و سلول های بنیادی پرتوان القایی (iPSC) هستند. (2) ارگانوئیدهای مشتق شده از سلول های استخراج شده از بافت معمولاً در بافت های تومور یافت می شوند.
س: آیا در غیاب بافت تازه می توان از بافت منجمد برای کشت سه بعدی استفاده کرد؟
بله، اما نیازهای بیشتری برای اندازه بافت منجمد وجود دارد، و زنده ماندن بافتها و سلولهای منجمد اولیه به میزان قابلتوجهی کاهش مییابد، که منجر به کاهش بسیار زیادی میزان موفقیت در کشت بعدی میشود.
س: ارگانوئیدها چگونه منجمد و احیا می شوند؟
زمان بهینه برای انجماد ارگانوئیدها در معابر 2-5 است، زمانی که فعالیت و پتانسیل تمایز ارگانوئیدها در بهترین حالت است. احیای ارگانوئیدها می تواند از روش های مورد استفاده برای احیای سلولی پیروی کند.
س: آیا کنترل اندازه ارگانوئیدهای کشت شده ضروری است و اگر خیلی بزرگ باشند مفید است؟
بله، کنترل اندازه، ترجیحاً در 500 میکرومتر ضروری است، زیرا ارگانوئیدها فاقد سیستم گردش خون عروقی و گاز مایع هستند. هنگامی که اندازه ارگانوئیدها بزرگ است، سلول های نزدیک به مرکز برای تبادل اکسیژن و مواد مغذی با محیط خارجی تلاش می کنند. بنابراین، هر چه ساختار بزرگتر باشد، تعداد سلول های مرده بیشتر می شود.
س: علاوه بر استفاده از ژل ماتریکس، چه چیز دیگری می تواند برای کشت ارگانوئیدها استفاده شود؟
علاوه بر ژل ماتریکس، جایگزینهایی برای کشت ارگانوئیدها شامل (1) ماتریکس خارج سلولی سلولزدایی شده و سایر پروتئینهای مشتق شده، (2) هیدروژلهای مصنوعی و (3) ژلهای پروتئین نوترکیب مهندسیشده است.
س: چگونه می توان به تمایز مستقیم ارگانوئیدها دست یافت؟
توسعه اولیه تمایز ناشی از سلول های بنیادی در ارگانوئیدها به طور مشترک توسط مسیرهای سیگنال دهی متعدد تنظیم می شود. کشت آزمایشگاهی مستلزم افزودن فاکتورهای رشد برای شبیه سازی فعالیت این مسیرهای سیگنالینگ است که سلول ها را برای تمایز در جهت های خاص هدایت می کند. برای مثال، القای Y27632 و Activin A میتواند سلولهای بنیادی جنینی (ESCs) یا سلولهای بنیادی پرتوان القایی (iPSCs) را به اجسام جنینی (EBs) متمایز کند. متعاقبا، مسیرهای سیگنالینگ توسط عواملی مانند Wnt3a، FGF-4 و Noggin تنظیم می شوند تا تمایز سلول های بنیادی را در جهت های خاص القاء کنند.
س: چگونه می توان هنگام تهیه نمونه های بالینی از آلودگی جلوگیری کرد؟
(1) تا حد امکان از نمونه برداری آسپتیک اطمینان حاصل کنید. (2) قبل از استخراج، برای چند دقیقه در PBS حاوی آنتی بیوتیک غوطه ور شوید: برای تومورهایی که در مناطقی با تماس بالقوه با محیط خارجی مانند معده، روده و مثانه قرار دارند، توصیه می شود به مدت 5-10 دقیقه در PBS حاوی 3 تا 5 درصد آنتی بیوتیک غوطه ور شود. برای سایر تومورهای رایج، حدود 5 دقیقه در PBS حاوی 1 تا 2 درصد آنتی بیوتیک غوطه ور شوید. (3) تمام معرف های مورد استفاده در طول استخراج سلول باید حاوی 1٪ آنتی بیوتیک و غلظت مناسب آنتی بیوتیک های اولیه باشد.
س: چه اقدامات احتیاطی برای جمع آوری، حفظ و حمل و نقل بافت های تومور باید انجام شود؟
بافت های تومور با محتوای بالای سلول های تومور را تا حد امکان جمع آوری کنید و زمان قرار گرفتن نمونه های بافت در معرض هوا را به حداقل برسانید تا احتمال آلودگی کاهش یابد. نمونههای بافت تومور جمعآوریشده را در اسرع وقت در لولههای استریل حاوی محلول مخصوص نگهداری نمونه قرار دهید و آنها را به سرعت در دمای پایین (حدود 4 درجه سانتیگراد) به واحد آزمایش انتقال دهید (تلاش کنید ظرف 2 تا 4 ساعت پس از نمونهبرداری تحویل دهید).
س: آیا بین ارگانوئیدهای کشت شده از ضایعات و ارگانوئیدهای کشت شده از بافت های مجاور تفاوت وجود دارد؟
شرایط مورد نیاز برای مکان های نمونه برداری از بافت های تومور چیست؟ بله، تفاوت وجود دارد. تومورها خود ناهمگنی از خود نشان می دهند، بنابراین مشاهده تفاوت بین ارگانوئیدهای مشتق شده از منابع مختلف معمول است. از نظر مورفولوژیکی، ارگانوئیدهای مشتق شده از ضایعات اولیه، ساختار تهاجمی تری نسبت به بافت های مجاور دارند و معمولاً نامنظم تر به نظر می رسند. برای به حداقل رساندن خطاها در مدل سازی یا غربالگری دارو، نمونه های متعددی باید از مناطق با فعالیت خوب گرفته شود.
س: چه نوع داروهایی را می توان برای تست حساسیت دارویی ارگانوئیدهای تومور استفاده کرد؟
انواع اصلی داروهای ضد تومور در عمل بالینی را می توان به سه دسته طبقه بندی کرد: داروهای سیتوتوکسیک (مانند پاکلی تاکسل، سیس پلاتین/کاربوپلاتین، 5-FU، و غیره)، داروهای هدفمند (داروهایی که EGFR، HER2، VEGFR، و غیره را هدف قرار می دهند)، و داروهای ایمونوتراپی که توسط آنتی بیوتیک های PD-1، نشان داده می شوند. آنتی بادی ها و غیره).
س: میزان موفقیت کشت PDO چقدر است؟
میزان موفقیت کشت PDO بسته به منبع کمی متفاوت است. اکثر PDO ها دارای میزان موفقیت بین 63 تا 70 درصد یا حتی بالاتر، تا 90 درصد هستند که تا حد زیادی با فعالیت خود بافت مرتبط است. علاوه بر این، درمان های بالینی ممکن است بر میزان موفقیت تأثیر بگذارد. میزان موفقیت را می توان با کاهش زمان بافت برون تنی و مراحل عملیاتی بهبود بخشید.
س: آیا می توان از بافت منجمد برای کشت ارگانوئید استفاده کرد؟
به طور کلی، انجماد بافت به دلیل از دست دادن قابل توجه زنده ماندن توصیه نمی شود. با این حال، اگر بافت ها در دمای 80- درجه سانتیگراد نگهداری شوند، پنجره بهینه برای کشت ارگانوئید ظرف 6 هفته پس از نگهداری است. اگر بافت ها در نیتروژن مایع ذخیره شوند، زمان نگهداری می تواند طولانی تر باشد اما ترجیحاً بیش از شش ماه نباشد.
س: هنگام استخراج سلول های اولیه، معمولاً فیبروبلاست ها مخلوط می شوند. چگونه باید با آنها برخورد کرد؟
(1) به دلیل چسبندگی ضعیف فیبروبلاست ها، می توان آنها را با چسبندگی مکرر حذف کرد.(2) می توان از معرف های حذف فیبروبلاست استفاده کرد، اما اینکه آیا آنها بر کشت ارگانوئید تأثیر می گذارند نیاز به تأیید تجربی دارد.
س: چه مقدار بافت تومور اصلی برای کشت ارگانوئیدهای تومور مورد نیاز است؟ آیا نمونه بیوپسی کافی است؟
به طور کلی، بافت های جراحی باید بزرگتر از اندازه 2-3 دانه سویا باشد. اگر از طریق بیوپسی سوزنی به دست آید، حداقل 2-3 نمونه مورد نیاز است، در حالی که بیوپسی آندوسکوپی به حداقل شش یا بیشتر بافت تومور نیاز دارد تا گیره شود.
س: اگر نمونه بافت تومور خیلی کوچک باشد و تعداد ارگانوئیدهای کشت شده برای آزمایش بعدی کافی نباشد، چه باید کرد؟
از آنجایی که ارگانوئیدهای مشتق شده از منابع تومور ممکن است پس از عبور، تفاوت های فنوتیپی را نشان دهند، عبور دادن به طور کلی توصیه نمی شود. در ادبیات توصیه می شود که عبور ارگانوئیدها را به 2-3 نسل و حداکثر 5 نسل محدود کنید. اگر تعداد سلول ها خیلی کوچک است و نمی تواند الزامات آزمایش را بعد از 5 نسل برآورده کند، روش آزمایش را تغییر دهید، مانند استفاده از یک صفحه کوچکتر 384 چاهی یا آزمایش تراشه های میکروسیال برای آزمایش.
س: آیا سلول های طبیعی در بافت های تومور وجود خواهد داشت؟ چگونه این سلول های طبیعی را حذف کنیم؟
ممکن است تعداد کمی سلول طبیعی وجود داشته باشد. ابتدا سعی کنید از نمونه برداری از بافت های طبیعی در طول جمع آوری خودداری کنید. در مرحله دوم، پس از استخراج سلول های اولیه، می توان از مرتب سازی دانه های مغناطیسی یا فلوسیتومتری برای کشت بیشتر ارگانوئید استفاده کرد. هنگامی که تعداد بسیار کمی از سلول های طبیعی وجود داشته باشد، به طور قابل توجهی بر مدل سازی و کشت ارگانوئید بعدی تأثیر نمی گذارد، بنابراین حذف ممکن است ضروری نباشد.
س: هنگام استخراج سلول های اولیه از بافت های تومور، چرا سلول ها قرمز به نظر می رسند؟
بافت ها در داخل بدن غنی از خون هستند، بنابراین گلبول های قرمز زیادی وجود دارد. در بیشتر موارد، این نیاز به پردازش ندارد و بر کشت ارگانوئید تأثیر نمی گذارد. اگر تعداد گلبولهای قرمز خون خیلی زیاد باشد، میتوان آنها را قبل از کشت با بافر لیز درمان کرد.
س: در طول کشت ارگانوئید، ذرات سیاه رنگ یافت می شود. چگونه آنها را حذف کنیم؟
ذرات سیاه به احتمال زیاد ناخالصی یا بقایای سلولی هستند. آنها را می توان به دو روش حذف کرد:
ارگانوئیدها را هضم کرده و مرتباً با محیط بشویید تا ناخالصی ها رقیق شوند.
از یک چاقوی جراحی استریل برای نصف کردن ارگانوئیدها استفاده کنید، سپس از یک سرنگ 1 میلی لیتری پر از محیط استفاده کنید تا به آرامی ناخالصی ها را از ارگانوئیدها خارج کنید.
س: آیا محدودیتی برای تعداد معابر برای کشت ارگانوئید وجود دارد و چند پاساژ می توان انجام داد؟
تعداد پاساژها به طور کلی به ویژگی های سلول های منبع بستگی دارد. اکثر ارگانوئیدها را می توان تا 10 بار (بیش از 6 ماه) در شرایط آزمایشگاهی عبور داد. انتخاب شرایط کشت نیز ممکن است تا حدودی تأثیر داشته باشد، با محیط مطبوع به طور کلی برتر از محیط فاکتور مصنوعی.
س: آیا می توان رده های سلولی تومور (مانند رده سلولی HepG2) را در PDO کشت کرد؟
PDO ها ساختارهای پیچیده ای هستند که خود مونتاژ می شوند. سیستم های کشت سه بعدی که توسط رده های سلولی منفرد تشکیل شده اند را نمی توان PDO نامید. آنها به سادگی به عنوان حالت های کروی سه بعدی شناخته می شوند.
س: معیارهای عبور ارگانوئیدها چیست؟
بسته به وضعیت رشد ارگانوئیدها، زمان، معمولا بین 5-10 روز، با قطر حدود 100-200 میکرومتر متغیر است. برخی از ارگانوئیدهای آهسته در حال رشد ممکن است چندین هفته طول بکشد تا به وضعیت عبور مناسب برسند.
س: چگونه تعداد ارگانوئیدهای زنده را بشماریم؟
در طول آزمایش، محلول ذخیره سازی Calcein-AM از پیش آماده شده را خارج کرده و محلول Calcein-AM را تا غلظت نهایی 0.2μmol/L به محیط اضافه کنید. به مدت 60 دقیقه در دمای 37 درجه سانتیگراد انکوبه کنید. پس از سپری شدن زمان، محیط حاوی Calcein-AM را به آرامی با PBS بشویید و محیط تازه را اضافه کنید. از یک میکروسکوپ فلورسانس با طول موج تحریک 490 نانومتر و طول موج انتشار 515 نانومتر برای مشاهده و عکسبرداری از ارگانوئیدها استفاده کنید. ارگانوئیدهای زنده سبز به نظر می رسند و دارای لبه های شفاف هستند. ارگانوئیدها را با قطر بیش از 20 میکرومتر بشمارید.
س: چگونه می توان زنده ماندن ارگانوئیدها را محاسبه کرد؟
زنده ماندن ارگانوئیدها بر اساس فرمول محاسبه می شود: X=(Nlive/Ntotal)×100% که در آن: X نشان دهنده زنده بودن ارگانوئیدها است. Nlive تعداد ارگانوئیدهای زنده را نشان می دهد. Ntotal تعداد کل ارگانوئیدها را نشان می دهد.
س: روش های شناسایی ارگانوئیدها چیست؟
اساسی ترین روش مشاهده مورفولوژی ارگانوئیدها از طریق میکروسکوپ و انجام رنگ آمیزی H&E است. روشهای دیگر شامل وسترن بلات، qRT-PCR، ایمونوفلورسانس، فلوسیتومتری برای تشخیص اینکه آیا ارگانوئیدها نشانگرهای زیستی مربوطه را بیان میکنند یا خیر. توالی یابی ژنتیکی می تواند تطابق ژنتیکی بین ارگانوئیدهای کشت شده و بافت منبع را شناسایی کند. برای برخی از ارگانوئیدها، آزمایشهای عملکردی میتواند انجام شود تا ببینیم آیا عملکردهای خاصی دارند یا خیر. به عنوان مثال، مطالعات نشان داده اند که ارگانوئیدهای معده می توانند اسید معده ترشح کنند و ارگانوئیدهای قلبی می توانند به طور مستقل تپش کنند.
س: آیا سلول های طبیعی نیز می توانند به ارگانوئیدها تبدیل شوند؟ چگونه ارگانوئیدهای طبیعی را در طی کشت ارگانوئید تومور حذف کنیم؟
سلول های طبیعی نیز می توانند به ارگانوئیدها تبدیل شوند. روشهای حذف ارگانوئیدهای طبیعی عبارتند از: (1) انتخاب دستی بر اساس نتایج رنگآمیزی HE در زیر میکروسکوپ. (2) خالص سازی PDO ها با تنظیم ترکیب محیط کشت (مانند فاکتورهای رشد/مهارکننده های مولکول کوچک). (3) پراکندگی PDO ها به سلول های منفرد برای فلوسیتومتری یا مرتب سازی مهره های مغناطیسی.
س: در طی آزمایشات حساسیت دارویی، آیا PDO ها باید از ژل ماتریکس هضم شوند؟
خیر، PDO ها برای شبیه سازی شرایط in vivo به ساختار سه بعدی نیاز دارند. اگر هیچ پشتیبانی از ژل ماتریکس وجود نداشته باشد، دقت آزمایش های حساسیت دارویی تحت تأثیر قرار می گیرد. به طور کلی، داروهای محلول می توانند به ژل ماتریکس نفوذ کنند تا روی ارگانوئیدها تأثیر بگذارند، اما هنگام انجام آزمایشات ایمونوسیتوشیمیایی، حذف ژل ماتریکس ضروری است.
س: آیا آزمایشات PDO می تواند به طور کامل جایگزین مدل های حیوانی (PDX) شود؟
PDO ها می توانند تا حدی جایگزین PDX شوند، اما نمی توانند به طور کامل جایگزین آنها شوند.
س: دلایل رشد غیرعادی PDOs در طول کشت که با چرخه های رشد کوتاه و تکثیر سریع در مقایسه با شرایط قبلی مشخص می شود، چه می تواند باشد؟
عوامل خارجی: (1) این ناهنجاری ممکن است به دلیل رشد گسترده برخی از سلول های آلوده کننده مانند فیبروبلاست ها ایجاد شود. در چنین مواردی توصیه می شود برای تایید وجود این سلول های آلوده، رنگ آمیزی و مشاهده مقطعی انجام شود و سپس اقدام به حذف آنها شود. (2) تغییرات در شرایط کشت، از جمله افزودن عوامل خاص یا مولکولهای کوچک، میتواند مسیرهای تکثیر PDOs را بیشتر فعال کند.
عوامل داخلی: جهش های ژنتیکی احتمالی برای تأیید این موضوع، توالی یابی توصیه می شود، و نتایج باید با نتایج PDO های اولیه مقایسه شود تا مشخص شود که آیا جهش ژنتیکی وجود دارد یا خیر.
س: چگونه می توان حساسیت PDO ها به داروها را آزمایش کرد؟
PDO ها را می توان با استفاده از روش هایی مانند سنجش CCK8، سنجش زنده ماندن سلول های ATP و رنگ آمیزی زنده/مرده آزمایش کرد. ارزیابی فعالیت ATP ارگانوئیدهای تومور رایج ترین روش است. ATP مهم ترین مولکول انرژی در سلول ها است و می توان از آن برای اندازه گیری سطوح متابولیک سلولی استفاده کرد که منعکس کننده تعداد سلول های زنده است. بر اساس تأثیر تجویز دارو بر محتوای ATP سلولی، مقدار IC50 (نیم حداکثر غلظت مهاری داروی آزمایش شده) برای هر رژیم دارویی را می توان با استفاده از نرم افزار تجزیه و تحلیل برای انتخاب مؤثرترین داروها برای مهار تومور محاسبه کرد.
س: آیا محدوده غلظت برای آزمایش های حساسیت دارویی PDOs با محدوده غلظت سلول های تومور اولیه یکسان است؟
نه، آنها یکسان نیستند. به طور معمول، غلظت دارو برای PDO ها باید بیشتر از سلول های اولیه باشد. آزمایشهای اولیه را میتوان برای تجزیه و تحلیل غلظتهای بهینه برای آزمایشهای رسمی حساسیت دارویی انجام داد.
س: در چه مرحله ای از رشد باید از ارگانوئیدها برای آزمایش دارو استفاده کرد؟
به طور کلی توصیه می شود از ارگانوئیدها در 5 پاساژ برای آزمایش دارو استفاده کنید. در این مرحله ارگانوئیدها بهترین ثبات و فعالیت را از خود نشان می دهند.
س: معیارهای تعیین موفقیت استقرار ارگانوئید چیست؟
(1) ارزیابی اولیه اولیه: مورفولوژی ارگانوئید از حالت سلولی به اشکالی مانند واکوئلی، جوانه زدن، فشرده یا شل تغییر می کند. (2) شناسایی بیان نشانگرهای زیستی خاص، که باید مشابه توزیع در برشهای بافت باشد. تجزیه و تحلیل توالی بیشتر را می توان برای مقایسه های دقیق تر انجام داد.
س: کشت ارگانوئید چه تفاوتی با کشت سلولی معمولی دارد؟
(1) روش های مختلف کشت سلولی: ارگانوئیدها برای حفظ ساختار سه بعدی خود به حمایت از بسترها یا ساختارهای فضایی نیاز دارند، در حالی که کشت سلولی معمولی به این نیاز ندارد. (2) کشت ارگانوئیدی مستلزم دستیابی به تمایز و خودآرایی ex vivo است، بنابراین نیاز به استفاده از ترکیبی از سیتوکینهای مختلف برای القاء دارد که منجر به اجزای محیط کشت نسبتاً پیچیده میشود. کشت سلولی منظم معمولاً تنها شامل یک نوع سلول می شود، بنابراین اجزای محیط کشت نسبتاً ساده هستند.(3) منابع سلولی مختلف: ارگانوئیدها از سلول های اپیتلیال چند توان مشتق می شوند، در حالی که کشت سلولی معمولی برای کشت انواع مختلف سلول های انتخاب شده مناسب است.
س: چگونه می توانم تشخیص دهم که کره های سه بعدی که من کشت دادم ارگانوئید هستند و آیا با بافت هدف سازگار هستند یا خیر؟
روشهای شناسایی ارگانوئیدها شامل رنگآمیزی H&E، ایمونوهیستوشیمی (IHC)، توالییابی تک سلولی و غیره است. لازم است قضاوت های چند بعدی از دیدگاه های مورفولوژیکی، هیستوپاتولوژیکی و ژنتیکی مولکولی انجام شود تا مشخص شود که آیا آنها با اندام یا بافت هدف سازگار هستند یا خیر. برای ارگانوئیدهای تومور، تشخیص بیومارکرهای خاص می تواند برای تایید استفاده شود.
س: اگر مورفولوژی ارگانوئیدهای مشاهده شده در طول کشت با آنچه در ادبیات گزارش شده متفاوت است، دلیل آن چه می تواند باشد؟
اولاً، ممکن است تفاوتهای فردی و ناهمگونی در منابع نمونه و زیرگروهها وجود داشته باشد. ثانیاً، تفاوت در کیفیت سیتوکینهای انتخابی و برخی از مهارکنندههای مولکولی کوچک که برای القا استفاده میشوند ممکن است منجر به تغییرات در مورفولوژی تمایز ارگانوئیدهای مختلف شود. پیشنهاد میشود که سازگاری بین مورفولوژی ارگانوئید و بافت منبع از طریق روشهایی مانند رنگآمیزی HE، IHC، و توالییابی ژنتیکی، به جای تکیه بر توصیفات ادبیات، تأیید شود.
س: هنگام انجام آزمایش های حساسیت دارویی با ارگانوئیدها، آیا کنترل مقدار DMSO به عنوان حلال برای داروها ضروری است؟
بله، معمولاً آزمایشهای حساسیت دارویی نیاز دارند که درصد حجمی DMSO کمتر از 0.5٪ باشد.
س: چگونه می توان ارگانوئیدها را از ژل ماتریکس بازیابی کرد؟
روش های زیر توصیه می شود: (1) محلول های بازیابی ارگانوئیدی موجود در بازار (CAT#41421ES) را می توان برای به دست آوردن آرام و موثر سوسپانسیون های سلولی بدون آسیب رساندن به سلول ها یا پروتئین های سطح سلولی استفاده کرد. (2) ژل ماتریکس را می توان در دمای پایین ذوب کرد تا نرم شود و ارگانوئیدها آزاد شوند.
س: بسیاری از ارگانوئیدها در طول بازیابی به دیواره های لوله سانتریفیوژ می چسبند. چگونه می توان میزان بهبودی را بهبود بخشید؟
هنگام سانتریفیوژ کردن پس از جمع آوری، از یک سانتریفیوژ روتور افقی استفاده کنید و سرعت سانتریفیوژ را به طور مناسب افزایش دهید. به طور کلی، نیروی گریز از مرکز حدود 300 گرم و سرعت تقریباً 1000-1200 دور در دقیقه مناسب است.
| پمحصول نآمی | گربه | اندازه |
| انسان Wnt-3a | 92276ES10 | 10μg |
| 92278ES20 | 20μg | |
| 92701ES10 | 10μg | |
| انسان نوگین | 92528ES10 | 10μg |
| 91330ES10 | 10μg | |
| 91306ES10 | 10μg | |
| 91502ES10 | 10μg | |
| 91701ES08 | 10μg | |
| 92602ES60 | 100μg | |
| 91204ES10 | 10μg | |
| 90601ES10 | 10μg | |
| 91113ES10 | 10μg | |
| 92279ES10 | 10μg | |
| 92055ES10 | 10μg | |
| 92053ES10 | 10μg | |
| 92129ES08 | 5μg | |
| 91304ES10 | 10μg | |
| 91702ES10 | 10μg | |
| 92252ES60 | 100μg | |
| 90103ES10 | 10μg | |
| 90104ES10 | 10μg | |
| 90197ES10 | 10μg | |
| 90144ES08 | 10μg | |
| 90196ES10 | 10μg | |
| 90194ES10 | 10μg | |
| 90111ES10 | 10μg | |
| 90120ES10 | 10μg | |
| 90198ES10 | 10μg | |
| 91605ES10 | 10μg | |
| 92251ES10 | 10μg | |
| 92566ES08 | 5μg | |
| 92102ES10 | 10μg | |
| 91103ES10 | 10μg | |
| 92711ES10 | 10μg | |
| 92122ES60 | 100μg | |
| 92201ES60 | 100μg | |
| 92275ES20 | 20μg | |
| انسان BMP-2 | 92051ES10 | 10μg |
مطالب مرتبط:
مرجع
