La technologie de « détection » par imagerie in vivo empêche les cellules « cachées » de se cacher
Vous souhaitez contrôler la croissance tumorale chez la souris nude en temps réel ? Vous souhaitez connaître l'emplacement de la colonisation cellulaire chez la souris ? Vous souhaitez connaître l'effet du traitement médicamenteux sur les tumeurs in vivo? Cela peut être réalisé en installant un tracker sur la cellule, vous permettant de contrôler l'emplacement et le nombre de cellules à tout moment. Cette technologie est une technologie de « détection » par imagerie in vivo. Qu'est-ce donc que la technologie d'imagerie in vivo ?
1. Qu’est-ce que la technologie d’imagerie in vivo ?
2. Caractéristiques de l'imagerie de la luciférase
3. Direction d'application de l'imagerie de la luciférase
4. Partage d'exemples expérimentaux
5. FAQ
6. Informations sur le produit
7. Concernant la lecture
1. Qu’est-ce que la technologie d’imagerie in vivo ?
Dès 1999, le Dr Weissleder de l'Université Harvard aux États-Unis a proposé le concept d'imagerie moléculaire, c'est-à-dire l'utilisation de méthodes d'imagerie pour mener des recherches qualitatives et quantitatives sur les processus biologiques in vivo aux niveaux cellulaire et moléculaire. L'imagerie in vivo est basée sur l'imagerie moléculaire. Grâce à ce système d'imagerie, des processus biologiques tels que la croissance tumorale et les métastases, le développement de maladies infectieuses et l'expression de gènes spécifiques peuvent être observés chez des animaux vivants.
In vivo, l'imagerie optique des animaux vivants adopte principalement deux technologies : la bioluminescence et la fluorescence. La bioluminescence est le gène de la luciférase pour marquer les cellules ou l'ADN, tandis que la technologie de fluorescence utilise des gènes rapporteurs fluorescents tels que la protéine fluorescente verte et la protéine fluorescente rouge et la fluorescence telle que FITC, Cy5 et Cy7. Éléments et points quantiques (QD) pour l'étiquetage. La bioluminescence des mammifères intègre généralement le gène de la luciférase de la luciole (composé de 554 nucléotides, environ 50 KD), c'est-à-dire le gène de la luciférase, dans l'ADN chromosomique de la cellule d'observation attendue pour exprimer la luciférase. Ensuite, cultivez une lignée cellulaire qui peut exprimer de manière stable la luciférase, et lorsque les cellules se divisent, se différencient et se transfèrent, la luciférase continuera également à s'exprimer de manière stable. Les gènes, les cellules et les animaux vivants peuvent tous être marqués avec le gène de la luciférase. La luciférase est une sorte d'enzyme qui peut catalyser des substrats pour produire une bioluminescence. Les luciférases de différentes sources ont leurs caractéristiques et peuvent catalyser des substrats pour émettre différentes couleurs de lumière. Parmi elles, la luciférase de luciole a une sensibilité élevée et une large plage linéaire de 7 à 8 ordres de grandeur. Elle est devenue le gène rapporteur de cellules de mammifères le plus couramment utilisé. Le plasmide rapporteur de la luciférase a été transféré dans les cellules et son substrat, la luciférine, a été ajouté pour incuber les cellules. En présence d'ATP, O2, et les ions magnésium, la luciférase pourrait oxyder le substrat de la luciférine pour produire une réaction de lumière visible. Réalisez une « installation unique de « tracker », et suivez et détectez à tout moment ». En plus de la luciférase de luciole, la luciférase de renille est parfois utilisée. Les substrats des deux sont différents, le substrat de la première est la D-luciférine et le substrat de la seconde est la cœlenterazine. Les longueurs d'onde d'émission de lumière des deux sont différentes, la plage de longueurs d'onde de la lumière émise par la première est de 540 à 600 nm et la plage de longueurs d'onde de la lumière émise par la seconde est de 460 à 540 nm. La lumière émise par la première traverse plus facilement les tissus, tandis que la seconde est métabolisée plus rapidement dans le corps et sa spécificité n'est pas aussi bonne que la première. Par conséquent, la plupart des expériences in vivo n'utilisent pas la luciférase de luciole comme gène rapporteur.
Figure 1.Localisation des cellules marquées à la luciférase
Le principe optique de la bioluminescence : la lumière sera diffusée et absorbée lors de sa propagation dans les tissus des mammifères, et les photons seront réfractés lorsqu'ils rencontrent la membrane cellulaire et le cytoplasme, et différents types de cellules et de tissus ont des caractéristiques différentes d'absorption des photons. L'hémoglobine est la principale cause de l'absorption de la lumière visible dans le corps et peut absorber la majeure partie de la bande bleu-vert de la lumière visible. Mais dans la bande de lumière rouge de la lumière visible supérieure à 600 nm, l'absorption de l'hémoglobine est très faible. Par conséquent, une grande quantité de lumière peut traverser les tissus et la peau pour être détectée dans la région rougeâtre. Au moins quelques centaines de cellules sous-cutanées peuvent être détectées à l'aide de la technologie d'imagerie bioluminescente d'animaux vivants. Cependant, en fonction de la profondeur de la source lumineuse chez la souris, le nombre minimum de cellules visibles varie. D'une manière générale, pour chaque augmentation de 1 cm, l'intensité lumineuse s'atténue de 10 fois, et l'atténuation est plus importante pour les tissus et organes riches en sang, et moins pour les tissus et organes adjacents aux os. Dans le cas d'une même profondeur, l'intensité lumineuse détectée a une relation linéaire significative avec le nombre de cellules, et l'intensité lumineuse détectée peut être quantifiée par l'instrument pour refléter le nombre de cellules.
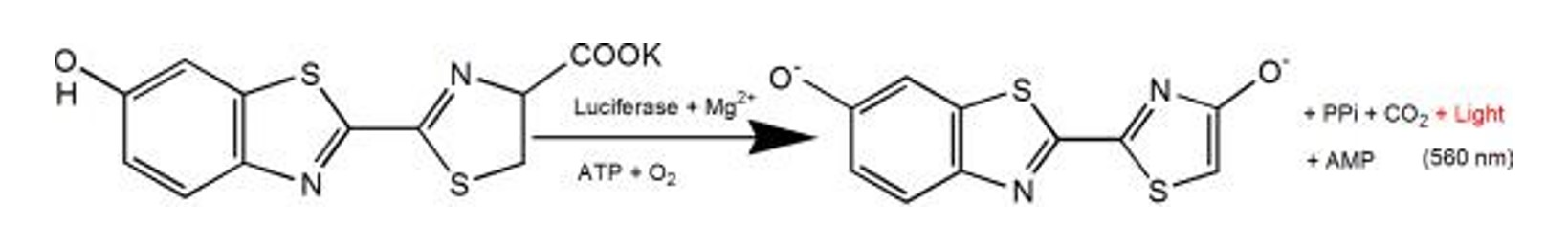
Figure 2. Principe luminescent de la luciférase et réaction du sel de potassium de la luciférine
Contrairement à la bioluminescence, la technologie de fluorescence utilise des gènes rapporteurs fluorescents ou des colorants fluorescents (y compris de nouveaux matériaux de nano-étiquetage tels que les points quantiques fluorescents) pour l'étiquetage. En utilisant la fluorescence des gènes rapporteurs, des protéines fluorescentes ou des colorants, une source de lumière biologique in vivo peut être créée. La bioluminescence est une autofluorescence chez les animaux sans source de lumière d'excitation, tandis que la fluorescence nécessite une excitation par une source de lumière d'excitation externe avant de pouvoir être détectée par le système d'imagerie. Les marqueurs fluorescents sont largement utilisés, notamment pour les animaux, les cellules, les micro-organismes, les anticorps, les médicaments, les nanomatériaux, etc.
2. Caractéristiques de l'imagerie de la luciférase
◎ pas de rayonnement, presque inoffensif pour les organismes.
◎ bioluminescence sans source lumineuse d'excitation.
◎ haute sensibilité, des centaines de cellules peuvent être détectées.
◎ bonne pénétrabilité, une profondeur de tissu de 3 à 4 cm peut encore être détectée.
◎ rapport signal/bruit élevé, signal de fluorescence puissant et bonne anti-interférence.
3. Direction d'application de l'imagerie de la luciférase
3.1 Croissance tumorale
Dans l'expérience de tumorigenèse chez la souris nude, la croissance tumorale a été observée en temps réel sans invasion, et il n'a pas été nécessaire de décaper la tumeur pour la mesure.
3.2 Médicaments oncologiques
L'influence de l'administration sur la croissance tumorale ou les métastases a été détectée et le substrat de fluorescéine a pu être éliminé dans les 3 heures, sans interférence avec l'expérience du médicament.
3.3 Localisation cellulaire
La localisation et la distribution de cellules étrangères chez les animaux ont été détectées.
3.4 Régulation de l'expression génétique
Le gène cible ou le promoteur du gène cible a été fusionné avec le gène de la luciférase pour détecter les changements d’expression génétique pendant le traitement médicamenteux ou l’évolution de la maladie.
3.5 Recherche sur les cellules souches
Suivi de la transplantation, de la survie et de la prolifération des cellules souches ; suivi de la distribution et de la migration des cellules souches in vivo.
4. Expérimentez exemple partage

Figure 3. in vivo détection par imagerie de l'effet thérapeutique du CAR-MUC1 T/CAR-MUC1-IL22 Les lymphocytes T sur la formation de tumeurs par injection sous-cutanée de cellules HN4 dans souris[1].
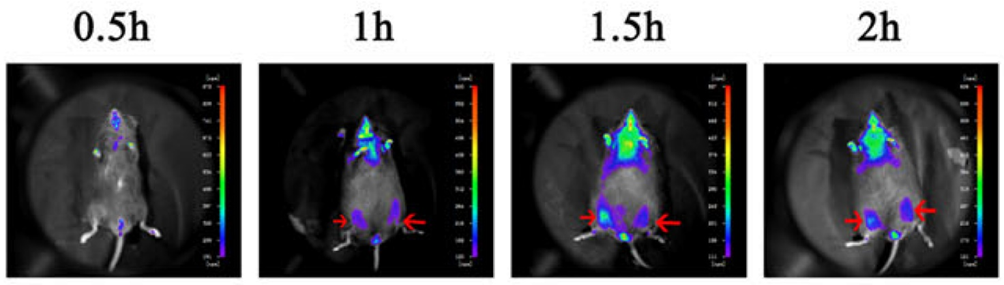
Figure 4. Après l'injection de cellules HUC-MSC dans le muscle squelettique de la souris, la localisation des cellules a été détectée par in vivo imagerie (indiquée par une flèche rouge)[2].
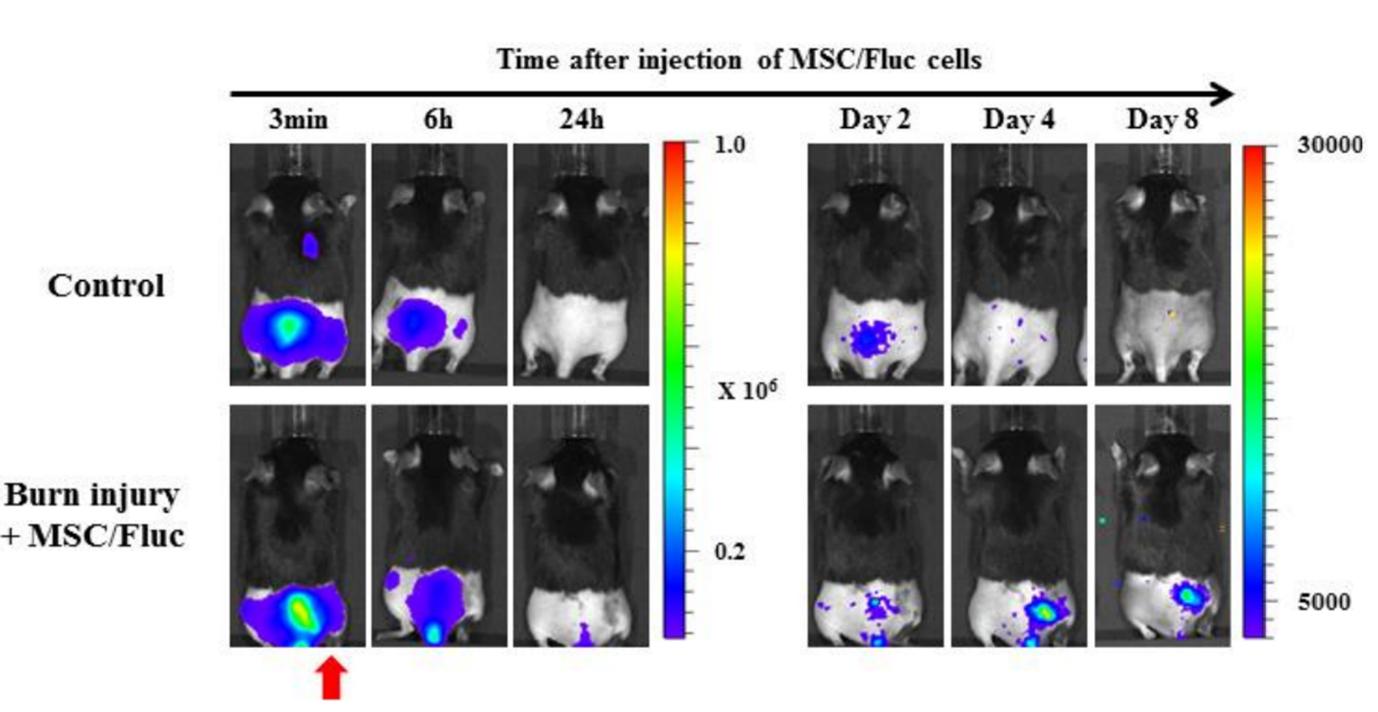
Figure 5. La capacité de in vivo imagerie pour détecter la migration des cellules souches mésenchymateuses (MSC) vers les sites de brûlure. Des cellules souches mésenchymateuses (MSC/FLuc) ont été injectées par voie intraveineuse dans le modèle de souris brûlée dans le dos. Quatre jours après l'injection, des signaux de bioluminescence sont apparus au niveau du site lésé de la brûlure, puis ont progressivement diminué (la flèche rouge indique le site de la brûlure)[3].
5. FAQ
Q1 : Par rapport à la technologie traditionnelle, quels sont les avantages de la technologie d’imagerie par bioluminescence ?
Par rapport aux technologies traditionnelles, cette technologie est plus sensible que les méthodes traditionnelles dans la recherche sur les métastases tumorales, la thérapie génique, l'épidémiologie, le traçage des cellules souches, la leucémie et d'autres recherches connexes. Elle peut également étudier rapidement et intuitivement la pathogénèse et le dépistage de médicaments de maladies connexes grâce à une série de modèles de maladies animales transgéniques.
Q2 : Comment étiqueter les cellules souches avec le gène de la luciférase ?
Les gènes exprimés de manière constitutive peuvent être étiquetés pour créer des souris transgéniques, et les cellules souches sont étiquetées. Les cellules souches hématopoïétiques sont prélevées dans la moelle osseuse de la souris et transplantées dans la moelle osseuse d'une autre souris. Cette technologie peut être utilisée pour suivre la prolifération, la différenciation et la migration des cellules souches hématopoïétiques dans le corps. Une autre méthode consiste à étiqueter les cellules souches avec un lentivirus.
Q3 : Combien de temps est-il approprié d’effectuer le test après l’injection de fluorescéine et combien de temps la luminescence peut-elle durer ?
En général, le signal de fluorescence atteint sa période stable la plus forte après une injection intrapéritonéale de 10 à 15 minutes et commence à diminuer après 20 à 30 minutes. Après 3 heures, la fluorescéine est éliminée et la luminescence disparaît complètement.
Q4 : Comment injecter de la fluorescéine chez la souris ? Quelle est la différence entre les méthodes d'injection ?
La fluorescéine peut être injectée à la souris par injection intrapéritonéale ou par injection dans la veine de la queue. Elle peut se propager à tout le corps de la souris en environ 1 min. Dans la plupart des cas, la concentration de fluorescéine est de 150 mg/kg. Pour des souris de 20 g, environ 3 mg de fluorescéine peuvent être utilisés. Pour l'injection intrapéritonéale, la diffusion est lente, la luminescence initiale est lente et le temps de luminescence continue est long. Pour l'injection de fluorescéine dans la veine de la queue, elle se diffuse rapidement et commence à émettre de la lumière rapidement, mais la durée de luminescence est courte.
6.Informations sur le produit
Yeasen est une société de biotechnologie spécialisée dans la recherche, le développement, la production et la vente de trois principaux réactifs biologiques : les molécules, les protéines et les cellules. Les produits proposés par Yeasen sont les suivants.
Tableau 1. Informations sur le produit
| Informations sur le produit | Code produit | Caractéristiques |
| D-Luciférine, sel de sodium | 40901ES01/02/03/08/10 | 0,1/0,5/1/5/10 g |
| D-Luciférine, sel de potassium | 40902ES01/02/03/08 | 0,1/0,5/1/5 g |
| D-Luciferine Firefly, acide libre (Renseigner) | 40903ES01/02/03 | 0,1/0,5/1 |
| Cœlentérazine h (Renseigner) | 40906ES02/03/08 | 0,5/1/5 mg |
| Coelentérazine h prête à l'emploi (Renseigner) | 40907ES10 | 10 flacons |
| Kit d'analyse du gène rapporteur de la double luciférase (Renseigner) | 11402ES60/80 | 100/1000T |
| Kit d'analyse du gène rapporteur de la luciférase (Renseigner) | 11401ES60/76/80 | 100/500/1000T |
| Plasmide rapporteur de luciférase VDR (récepteur de la vitamine D) (Renseigner) | 11502ES03 | 1 μg |
| Plasmide rapporteur de la luciférase STAT1 (Renseigner) | 11504ES03 | 1 μg |
7. Concernant la lecture
Une nouvelle génération de système de détection du gène rapporteur de la luciférase — plus simple, plus sensible et plus précis
