Seiring dengan semakin mendalamnya penelitian tentang organoid, semakin banyak pula individu yang ikut serta. Artikel ini merangkum beberapa poin pengetahuan umum tentang organoid [1-5], dengan harapan dapat bermanfaat bagi semua orang.
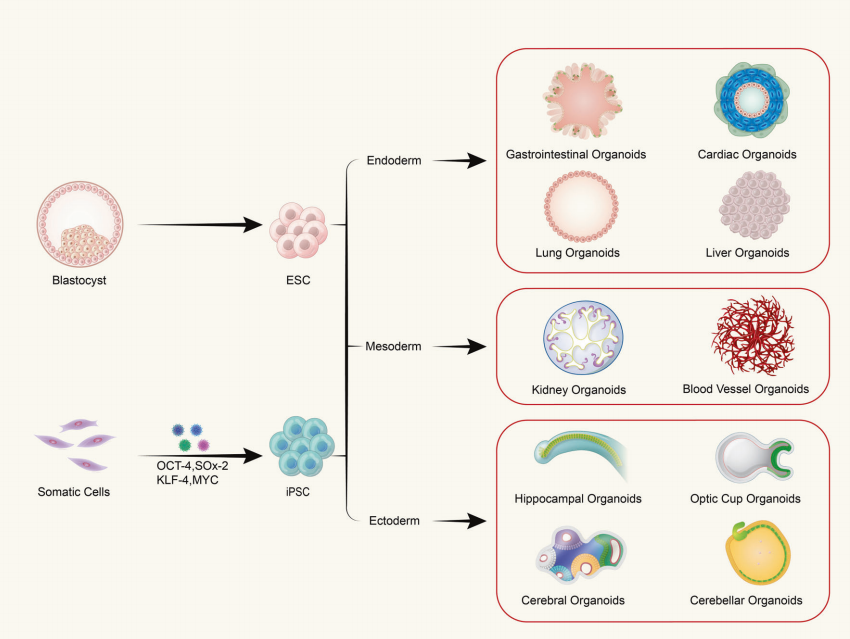
T: Apakah organoid tersusun dari satu jenis sel atau jaringan multiseluler?
Organoid terbentuk dari kultivasi sel punca dewasa atau sel punca pluripoten tiga dimensi (3D) in vitro, yang menghasilkan struktur mirip jaringan dengan organisasi spasial tertentu. Organoid bukanlah struktur yang terdiri dari sel tunggal; melainkan, organoid terbentuk dengan menginduksi pembelahan dan diferensiasi sel inisiasi dengan sifat sel punca, yang kemudian merakit diri menjadi jaringan dengan struktur spasial, morfologi, dan fungsi tertentu yang mirip dengan organ terkait secara in vivo.
T: Apa saja sumber untuk membudidayakan organoid?
(1) Organoid yang berasal dari sel punca pluripoten meliputi sel punca dewasa (ASC), sel punca pluripoten (PSC), dan sel punca pluripoten yang diinduksi (iPSC). (2) Organoid yang berasal dari sel yang diekstraksi dari jaringan umumnya ditemukan pada jaringan tumor.
T: Dapatkah jaringan beku digunakan untuk budidaya 3D tanpa adanya jaringan segar?
Ya, tetapi ada persyaratan yang lebih tinggi untuk ukuran jaringan beku, dan viabilitas jaringan dan sel beku primer akan menurun secara signifikan, yang mengarah pada tingkat keberhasilan yang sangat berkurang dalam budidaya berikutnya.
T: Bagaimana organoid dibekukan dan diresusitasi?
Waktu optimal untuk membekukan organoid adalah pada lintasan 2-5, saat aktivitas dan potensi diferensiasi organoid berada pada kondisi terbaiknya. Resusitasi organoid dapat mengikuti metode yang digunakan untuk resusitasi sel.
T: Apakah perlu untuk mengontrol ukuran organoid yang dikultur, dan apakah bermanfaat jika ukurannya terlalu besar?
Ya, perlu untuk mengontrol ukuran, sebaiknya dalam 500μm, karena organoid tidak memiliki sistem sirkulasi gas-cair dan pembuluh darah internal. Ketika ukuran organoid besar, sel-sel di dekat pusat berjuang untuk bertukar oksigen dan nutrisi dengan lingkungan eksternal. Oleh karena itu, semakin besar strukturnya, semakin banyak sel yang mati.
T: Selain menggunakan gel matriks, apa lagi yang bisa digunakan untuk membudidayakan organoid?
Selain gel matriks, alternatif untuk membudidayakan organoid meliputi (1) matriks ekstraseluler yang dideselularisasi dan protein turunan lainnya, (2) hidrogel sintetis, dan (3) gel protein rekombinan yang direkayasa.
T: Bagaimana diferensiasi organoid yang terarah dapat dicapai?
Perkembangan awal diferensiasi yang diinduksi sel punca dalam organoid diatur bersama oleh beberapa jalur pensinyalan. Kultur in vitro memerlukan penambahan faktor pertumbuhan untuk mensimulasikan aktivitas jalur pensinyalan ini, yang mengarahkan sel untuk berdiferensiasi ke arah tertentu. Misalnya, induksi dengan Y27632 dan Activin A dapat membedakan sel punca embrionik (ESC) atau sel punca pluripoten yang diinduksi (iPSC) menjadi badan embrioid (EB). Selanjutnya, jalur pensinyalan diatur oleh faktor-faktor seperti Wnt3a, FGF-4, dan Noggin untuk menginduksi diferensiasi sel punca ke arah tertentu.
T: Bagaimana kontaminasi dapat dihindari saat mengambil sampel klinis?
(1) Pastikan pengambilan sampel aseptik sebanyak mungkin. (2) Sebelum ekstraksi, rendam dalam PBS yang mengandung antibiotik selama beberapa menit: untuk tumor yang terletak di area dengan potensi kontak dengan lingkungan luar, seperti lambung, usus, dan kandung kemih, disarankan untuk merendam dalam PBS yang mengandung antibiotik 3%-5% selama 5-10 menit; untuk tumor umum lainnya, rendam dalam PBS yang mengandung antibiotik 1%-2% selama sekitar 5 menit. (3) Semua reagen yang digunakan selama ekstraksi sel harus mengandung antibiotik 1% dan konsentrasi antibiotik primer yang sesuai.
T: Tindakan pencegahan apa yang harus diambil untuk pengumpulan, pengawetan, dan pengangkutan jaringan tumor?
Kumpulkan jaringan tumor dengan kandungan sel tumor yang tinggi sebanyak mungkin, dan minimalkan waktu paparan sampel jaringan ke udara untuk mengurangi kemungkinan kontaminasi. Tempatkan sampel jaringan tumor yang terkumpul ke dalam tabung steril yang berisi larutan pengawet sampel khusus sesegera mungkin dan angkut dengan cepat ke unit pengujian pada suhu rendah (sekitar 4°C) (usahakan untuk mengirimkannya dalam waktu 2~4 jam setelah pengambilan sampel).
T: Apakah ada perbedaan antara organoid yang dikultur dari lesi dan yang dikultur dari jaringan yang berdekatan?
Apa saja persyaratan untuk lokasi pengambilan sampel jaringan tumor? Ya, ada perbedaan. Tumor sendiri menunjukkan heterogenitas, jadi biasanya terlihat perbedaan antara organoid yang berasal dari sumber yang berbeda. Secara morfologis, organoid yang berasal dari lesi primer cenderung memiliki struktur yang lebih invasif dibandingkan dengan organoid yang berasal dari jaringan yang berdekatan, umumnya tampak lebih tidak teratur. Untuk meminimalkan kesalahan dalam pemodelan atau penyaringan obat, beberapa sampel harus diambil dari area dengan aktivitas yang baik.
T: Jenis obat apa yang dapat digunakan untuk pengujian kepekaan obat pada organoid tumor?
Jenis utama obat antitumor dalam praktik klinis dapat diklasifikasikan ke dalam tiga kategori: obat sitotoksik (seperti paclitaxel, cisplatin/carboplatin, 5-FU, dll.), obat target (obat yang menargetkan EGFR, HER2, VEGFR, dll.), dan obat imunoterapi yang diwakili oleh penghambat titik pemeriksaan imun (antibodi PD-1, antibodi PD-L1, dll.).
T: Berapa tingkat keberhasilan budidaya PDO?
Tingkat keberhasilan budidaya PDO sedikit bervariasi tergantung pada sumbernya. Sebagian besar PDO memiliki tingkat keberhasilan antara 63% dan 70%, atau bahkan lebih tinggi, hingga 90%, yang sebagian besar berkorelasi dengan aktivitas jaringan itu sendiri. Selain itu, perawatan klinis dapat memengaruhi tingkat keberhasilan. Tingkat keberhasilan dapat ditingkatkan dengan mengurangi waktu jaringan ex vivo dan langkah operasional.
T: Bisakah jaringan beku digunakan untuk budidaya organoid?
Secara umum, kriopreservasi jaringan tidak direkomendasikan karena dapat menyebabkan hilangnya viabilitas secara signifikan. Namun, jika jaringan disimpan pada suhu -80°C, waktu optimal untuk budidaya organoid adalah dalam waktu 6 minggu setelah pengawetan. Jika jaringan disimpan dalam nitrogen cair, waktu pengawetan dapat lebih lama tetapi sebaiknya tidak melebihi enam bulan.
T: Ketika mengekstraksi sel primer, biasanya ada fibroblas yang tercampur di dalamnya. Bagaimana cara menanganinya?
(1) Karena adhesi fibroblas yang buruk, mereka dapat dihilangkan dengan adhesi berulang.(2) Reagen penghilang fibroblast dapat digunakan, namun apakah reagen tersebut mempengaruhi kultivasi organoid masih memerlukan validasi eksperimental.
T: Berapa banyak jaringan tumor asli yang dibutuhkan untuk membudidayakan organoid tumor? Apakah sampel biopsi mencukupi?
Secara umum, jaringan bedah harus berukuran lebih besar dari 2-3 kacang kedelai; jika diperoleh melalui biopsi jarum, setidaknya diperlukan 2-3 sampel, sedangkan biopsi endoskopi memerlukan setidaknya enam atau lebih jaringan tumor untuk dijepit.
T: Jika sampel jaringan tumor terlalu kecil, dan jumlah organoid yang dikultur tidak mencukupi untuk pengujian selanjutnya, apa yang harus dilakukan?
Karena organoid yang berasal dari sumber tumor dapat menunjukkan perbedaan fenotip setelah pengoperan, pengoperan umumnya tidak direkomendasikan. Dalam literatur, pengoperan organoid direkomendasikan untuk dibatasi hingga 2-3 generasi, dengan maksimum 5 generasi. Jika jumlah sel terlalu kecil dan tidak dapat memenuhi persyaratan pengujian setelah 5 generasi, pertimbangkan untuk mengubah metode pengujian, seperti menggunakan pelat 384-well yang lebih kecil atau mencoba chip mikrofluida untuk pengujian.
T: Apakah akan ada sel normal di jaringan tumor? Bagaimana cara membuang sel normal ini?
Mungkin ada sejumlah kecil sel normal. Pertama, cobalah untuk menghindari pengambilan sampel jaringan normal selama pengumpulan. Kedua, setelah mengekstraksi sel primer, penyortiran manik magnetik atau flow cytometry dapat digunakan untuk budidaya organoid lebih lanjut. Ketika jumlah sel normal yang ada sangat sedikit, hal itu tidak secara signifikan memengaruhi pemodelan dan budidaya organoid berikutnya, sehingga pengambilan mungkin tidak diperlukan.
T: Saat mengekstraksi sel primer dari jaringan tumor, mengapa sel-selnya tampak merah?
Jaringan kaya akan suplai darah in vivo, jadi terdapat banyak sel darah merah. Dalam kebanyakan kasus, hal ini tidak memerlukan pemrosesan dan tidak memengaruhi kultivasi organoid. Jika terdapat terlalu banyak sel darah merah, sel darah merah tersebut dapat diobati dengan tepat menggunakan buffer lisis sebelum kultivasi.
T: Selama kultivasi organoid, ditemukan partikel hitam. Bagaimana cara menghilangkannya?
Partikel hitam kemungkinan besar adalah kotoran atau serpihan sel. Partikel hitam dapat dihilangkan dengan dua cara:
Cerna organoid dan cuci berulang kali dengan media untuk mengencerkan kotoran.
Gunakan pisau bedah steril untuk memotong organoid menjadi dua, kemudian gunakan jarum suntik 1 ml yang diisi dengan medium untuk mengeluarkan kotoran dari organoid secara perlahan.
T: Apakah ada batasan jumlah lintasan untuk budidaya organoid, dan berapa banyak lintasan yang dapat dilakukan?
Jumlah lintasan umumnya bergantung pada sifat sel sumber. Sebagian besar organoid dapat dilintasi secara in vitro hingga 10 kali (>6 bulan). Pilihan kondisi kultur juga dapat memengaruhi, dengan media terkondisi umumnya lebih unggul daripada media faktor sintetis.
T: Dapatkah garis sel tumor (seperti garis sel HepG2) dikulturkan ke dalam PDO?
PDO merupakan struktur kompleks yang dirakit sendiri. Sistem kultur 3D yang dibentuk oleh garis sel tunggal tidak dapat disebut PDO; mereka hanya disebut sebagai keadaan bulat 3D.
T: Apa saja kriteria untuk meloloskan organoid?
Bergantung pada status perkembangan organoid, waktunya bervariasi, biasanya antara 5-10 hari, dengan diameter sekitar 100-200μm. Beberapa organoid yang berkembang lambat mungkin memerlukan waktu beberapa minggu untuk mencapai kondisi yang sesuai.
T: Bagaimana cara menghitung jumlah organoid yang layak?
Selama percobaan, keluarkan larutan penyimpanan Calcein-AM yang telah disiapkan sebelumnya dan tambahkan larutan Calcein-AM ke dalam medium hingga mencapai konsentrasi akhir 0,2μmol/L. Inkubasi pada suhu 37°C selama 60 menit. Setelah waktu berlalu, bilas perlahan medium yang mengandung Calcein-AM dengan PBS dan tambahkan medium baru. Gunakan mikroskop fluoresensi dengan panjang gelombang eksitasi 490 nm dan panjang gelombang emisi 515 nm untuk mengamati dan memotret organoid. Organoid hidup akan tampak hijau dan memiliki tepi yang jelas. Hitung organoid dengan diameter >20μm.
T: Bagaimana cara menghitung viabilitas organoid?
Viabilitas organoid dihitung berdasarkan rumus: X=(Nlive/Ntotal)×100%, di mana: X merupakan representasi viabilitas organoid; Nlive merupakan representasi jumlah organoid yang hidup; Ntotal merupakan representasi jumlah total organoid.
T: Apa saja metode untuk mengidentifikasi organoid?
Metode yang paling mendasar adalah mengamati morfologi organoid melalui mikroskop dan melakukan pewarnaan H&E. Metode lebih lanjut meliputi Western Blot, qRT-PCR, imunofluoresensi, flow cytometry untuk mendeteksi apakah organoid mengekspresikan biomarker yang sesuai. Pengurutan genetik dapat mengidentifikasi kecocokan genetik antara organoid yang dikultur dan jaringan sumber. Untuk beberapa organoid, uji fungsional dapat dilakukan untuk melihat apakah mereka memiliki fungsi tertentu. Misalnya, penelitian telah menunjukkan bahwa organoid lambung dapat mengeluarkan asam lambung, dan organoid jantung dapat berdetak secara otonom.
T: Bisakah sel normal juga tumbuh menjadi organoid? Bagaimana cara menghilangkan organoid normal selama pembudidayaan organoid tumor?
Sel normal juga dapat tumbuh menjadi organoid. Metode untuk menghilangkan organoid normal meliputi: (1) Seleksi manual berdasarkan hasil pewarnaan HE di bawah mikroskop; (2) Pemurnian PDO dengan menyesuaikan komposisi media kultur (seperti faktor pertumbuhan/inhibitor molekul kecil); (3) Dispersi PDO ke dalam sel tunggal untuk flow cytometry atau magnetic bead sorting.
T: Selama percobaan sensitivitas obat, haruskah PDO dicerna dari gel matriks?
Tidak, PDO memerlukan struktur tiga dimensi untuk mensimulasikan kondisi in vivo. Jika tidak ada dukungan dari gel matriks, keakuratan eksperimen sensitivitas obat akan terpengaruh. Umumnya, obat yang larut dapat menembus gel matriks untuk bekerja pada organoid, tetapi saat melakukan eksperimen imunositokimia, gel matriks perlu dihilangkan.
T: Bisakah eksperimen PDO sepenuhnya menggantikan model hewan (PDX)?
PDO dapat menggantikan PDX sebagian, tetapi tidak dapat menggantikannya sepenuhnya.
T: Apa saja yang dapat menjadi penyebab pertumbuhan PDO yang tidak normal selama pembudidayaan, yang ditandai dengan siklus pertumbuhan yang lebih pendek dan perkembangbiakan yang lebih cepat dibandingkan dengan kondisi sebelumnya?
Faktor eksternal: (1) Kelainan ini dapat disebabkan oleh pertumbuhan sel-sel kontaminan tertentu yang berlebihan, seperti fibroblas. Dalam kasus seperti itu, disarankan untuk melakukan pewarnaan dan pengamatan bagian untuk memastikan keberadaan sel-sel yang terkontaminasi ini dan kemudian membuangnya. (2) Perubahan kondisi kultur, termasuk penambahan faktor atau molekul kecil tertentu, dapat lebih mengaktifkan jalur proliferasi PDO.
Faktor internal: Kemungkinan mutasi genetik. Untuk memverifikasi hal ini, direkomendasikan untuk melakukan sekuensing, dan hasilnya harus dibandingkan dengan PDO primer untuk menentukan apakah ada mutasi genetik.
T: Bagaimana sensitivitas PDO terhadap obat dapat diuji?
PDO dapat diuji kepekaannya terhadap obat menggunakan metode seperti uji CCK8, uji viabilitas sel ATP, dan pewarnaan hidup/mati. Menilai aktivitas ATP pada organoid tumor merupakan metode yang paling umum. ATP merupakan molekul energi terpenting dalam sel dan dapat digunakan untuk mengukur kadar metabolisme sel, yang mencerminkan jumlah sel yang hidup. Berdasarkan efek pemberian obat pada kandungan ATP sel, nilai IC50 (konsentrasi penghambatan setengah maksimal obat yang diuji) untuk setiap rejimen obat dapat dihitung menggunakan perangkat lunak analisis untuk memilih obat yang paling efektif untuk penghambatan tumor.
T: Apakah kisaran konsentrasi untuk eksperimen sensitivitas obat PDO sama dengan sel tumor primer?
Tidak, keduanya tidak sama. Biasanya, konsentrasi obat untuk PDO harus lebih tinggi daripada konsentrasi untuk sel primer. Eksperimen pendahuluan dapat dilakukan untuk menganalisis konsentrasi optimal untuk eksperimen sensitivitas obat formal.
T: Pada tahap pertumbuhan apa organoid harus digunakan untuk pengujian narkoba?
Umumnya, disarankan untuk menggunakan organoid dalam 5 lintasan untuk pengujian obat. Pada tahap ini, organoid menunjukkan stabilitas dan aktivitas terbaik.
T: Apa saja kriteria untuk menentukan keberhasilan pembentukan organoid?
(1) Penilaian awal: Morfologi organoid berubah dari keadaan seluler menjadi bentuk seperti vakuola, bertunas, kompak, atau longgar. (2) Identifikasi ekspresi biomarker spesifik, yang seharusnya serupa dengan distribusi pada irisan jaringan. Analisis sekuensing lebih lanjut dapat dilakukan untuk perbandingan yang lebih rinci.
T: Apa yang membedakan budidaya organoid dengan kultur sel biasa?
(1) Berbagai metode kultur sel: Organoid memerlukan dukungan substrat atau struktur spasial untuk mempertahankan struktur tiga dimensinya, sedangkan kultur sel biasa tidak memerlukan hal ini. (2) Kultur organoid memerlukan pencapaian diferensiasi dan perakitan mandiri secara eks vivo, sehingga memerlukan penggunaan kombinasi berbagai sitokin untuk induksi, yang menghasilkan komponen media kultur yang relatif kompleks. Kultur sel biasa biasanya hanya melibatkan satu jenis sel, sehingga komponen media kultur relatif sederhana.(3) Sumber sel yang berbeda: Organoid berasal dari sel epitel multipotensi, sedangkan kultur sel biasa cocok untuk membudidayakan berbagai jenis sel terpilih.
T: Bagaimana saya dapat menentukan apakah bola 3D yang saya kultur adalah organoid dan apakah mereka konsisten dengan jaringan target?
Metode untuk mengidentifikasi organoid meliputi pewarnaan H&E, imunohistokimia (IHC), pengurutan sel tunggal, dan lain-lain. Penilaian multidimensi dari perspektif morfologi, histopatologi, dan genetik molekuler perlu dilakukan untuk menentukan apakah penilaian tersebut konsisten dengan organ atau jaringan target. Untuk organoid tumor, deteksi biomarker spesifik dapat digunakan untuk konfirmasi.
T: Jika morfologi organoid yang diamati selama budidaya berbeda dari apa yang dilaporkan dalam literatur, apa alasannya?
Pertama, mungkin ada perbedaan individu dan heterogenitas dalam sumber sampel dan subtipe. Kedua, perbedaan kualitas sitokin terpilih dan beberapa inhibitor molekul kecil yang digunakan untuk induksi dapat menyebabkan variasi morfologi diferensiasi organoid yang berbeda. Disarankan untuk mengonfirmasi konsistensi antara morfologi organoid dan jaringan sumber melalui metode seperti pewarnaan HE, IHC, dan sekuensing genetik, daripada hanya mengandalkan deskripsi literatur.
T: Saat melakukan eksperimen sensitivitas obat dengan organoid, apakah perlu mengontrol jumlah DMSO yang digunakan sebagai pelarut obat?
Ya, biasanya percobaan sensitivitas obat memerlukan persentase volume DMSO kurang dari 0,5%.
T: Bagaimana organoid dapat dipulihkan dari gel matriks?
Metode berikut direkomendasikan: (1) Solusi pemulihan organoid yang tersedia secara komersial (CAT#41421ES) dapat digunakan untuk mendapatkan suspensi sel dengan lembut dan efektif tanpa merusak sel atau protein permukaan sel. (2) Gel matriks dapat dicairkan pada suhu rendah untuk melunakkannya dan melepaskan organoid.
T: Banyak organoid yang menempel pada dinding tabung sentrifus selama pemulihan. Bagaimana tingkat pemulihan dapat ditingkatkan?
Saat melakukan sentrifugasi setelah pengumpulan, gunakan sentrifugasi rotor horizontal dan tingkatkan kecepatan sentrifugasi dengan tepat. Umumnya, gaya sentrifugal sekitar 300g dan kecepatan sekitar 1000-1200rpm sudah sesuai.
| Pproduk Nsaya | KUCING | Ukuran |
| Manusia Wnt-3a | 92276ES10 | 10akuG |
| 92278ES20 | 20akuG | |
| 92701ES10 | 10akuG | |
| Kepala Manusia | 92528ES10 | 10akuG |
| 91330ES10 | 10akuG | |
| 91306ES10 | 10akuG | |
| 91502ES10 | 10akuG | |
| 91701ES08 | 10akuG | |
| 92602ES60 | 100akuG | |
| 91204ES10 | 10akuG | |
| 90601ES10 | 10akuG | |
| 91113ES10 | 10akuG | |
| 92279ES10 | 10akuG | |
| 92055ES10 | 10akuG | |
| 92053ES10 | 10akuG | |
| 92129ES08 | 5akuG | |
| 91304ES10 | 10akuG | |
| 91702ES10 | 10akuG | |
| 92252ES60 | 100akuG | |
| 90103ES10 | 10akuG | |
| 90104ES10 | 10akuG | |
| 90197ES10 | 10akuG | |
| nomor 90144ES08 | 10akuG | |
| 90196ES10 | 10akuG | |
| 90194ES10 | 10akuG | |
| nomor 90111ES10 | 10akuG | |
| Nomor telepon 90120ES10 | 10akuG | |
| 90198ES10 | 10akuG | |
| 91605ES10 | 10akuG | |
| 92251ES10 | 10akuG | |
| 92566ES08 | 5akuG | |
| 92102ES10 | 10akuG | |
| 91103ES10 | 10akuG | |
| 92711ES10 | 10akuG | |
| 92122ES60 | 100akuG | |
| 92201ES60 | 100akuG | |
| 92275ES20 | 20akuG | |
| Manusia BMP-2 | 92051ES10 | 10akuG |
Bacaan terkait:
Referensi
