La tecnologia di "rilevamento" delle immagini in vivo impedisce alle cellule "nascoste" di nascondersi
Vuoi controllare la crescita del tumore nei topi nudi in tempo reale? Vuoi conoscere la posizione della colonizzazione cellulare nei topi? Vuoi conoscere l'effetto del trattamento farmacologico sui tumori in vivoCiò può essere ottenuto installando un localizzatore sulla cella, che consente di controllare la posizione e il numero di celle in qualsiasi momento. Questa tecnologia è la tecnologia di "rilevamento" dell'imaging in vivo. Quindi cos'è la tecnologia di imaging in vivo?
1. Che cos'è la tecnologia di imaging in vivo?
2. Caratteristiche dell'imaging della luciferasi
3. Direzione di applicazione dell'imaging della luciferasi
4. Condivisione di esempi sperimentali
5. Domande frequenti
6. Informazioni sul prodotto
7. Riguardo alla lettura
1. Che cos'è la tecnologia di imaging in vivo?
Già nel 1999, il dott. Weissleder dell'Università di Harvard negli Stati Uniti propose il concetto di imaging molecolare, ovvero l'uso di metodi di imaging per condurre ricerche qualitative e quantitative sui processi biologici in vivo a livello cellulare e molecolare. L'imaging in vivo si basa sull'imaging molecolare. Attraverso questo sistema di imaging, processi biologici come la crescita tumorale e le metastasi, lo sviluppo di malattie infettive e l'espressione di geni specifici possono essere osservati negli animali viventi.
In vivo, l'imaging ottico di animali viventi adotta principalmente due tecnologie: bioluminescenza e fluorescenza. La bioluminescenza è il gene della luciferasi per marcare le cellule o il DNA, mentre la tecnologia della fluorescenza utilizza geni reporter fluorescenti come la proteina fluorescente verde e la proteina fluorescente rossa e la fluorescenza come FITC, Cy5 e Cy7. Elementi e punti quantici (QD) per l'etichettatura. La bioluminescenza dei mammiferi generalmente integra il gene della luciferasi della lucciola (composto da 554 nucleotidi, circa 50 KD), ovvero il gene della luciferasi, nel DNA cromosomico della cellula di osservazione prevista per esprimere la luciferasi. Quindi coltiva una linea cellulare che può esprimere stabilmente la luciferasi e quando le cellule si dividono, si differenziano e si trasferiscono, anche la luciferasi continuerà a esprimersi stabilmente. Geni, cellule e animali vivi possono essere tutti etichettati con il gene della luciferasi. La luciferasi è un tipo di enzima che può catalizzare i substrati per produrre bioluminescenza. Le luciferasi provenienti da diverse fonti hanno le loro caratteristiche e possono catalizzare i substrati per emettere diversi colori di luce. Tra queste, la luciferasi di lucciola ha un'elevata sensibilità e un ampio intervallo lineare di 7~8 ordini di grandezza. È diventato il gene reporter delle cellule di mammifero più comunemente utilizzato. Il plasmide reporter della luciferasi è stato trasferito nelle cellule e il suo substrato luciferina è stato aggiunto per incubare le cellule. In presenza di ATP, O2, e ioni di magnesio, la luciferasi potrebbe ossidare il substrato della luciferina per produrre una reazione di luce visibile. Realizzare "l'installazione di un 'tracker' una tantum, e tracciare e rilevare in qualsiasi momento". Oltre alla luciferasi di lucciola, a volte viene utilizzata la luciferasi di renilla. I substrati dei due sono diversi, il substrato del primo è la D-luciferina e il substrato del secondo è la celenterazina. Le lunghezze d'onda di emissione della luce dei due sono diverse, l'intervallo della lunghezza d'onda della luce emessa dal primo è 540-600 nm e l'intervallo della lunghezza d'onda della luce emessa dal secondo è 460-540 nm. La luce emessa dal primo è più facile da attraversare i tessuti, mentre il secondo viene metabolizzato più velocemente nel corpo e la sua specificità non è buona come il primo. Pertanto, non la maggior parte degli esperimenti in vivo che utilizzano la luciferasi di lucciola come gene reporter.
Figura 1.Localizzazione delle cellule marcate con luciferasi
Il principio ottico della bioluminescenza: la luce verrà dispersa e assorbita quando si propaga nei tessuti dei mammiferi e i fotoni verranno rifratti quando incontrano la membrana cellulare e il citoplasma e diversi tipi di cellule e tessuti hanno diverse caratteristiche di assorbimento dei fotoni. L'emoglobina è la causa principale dell'assorbimento della luce visibile nel corpo e può assorbire la maggior parte della banda blu-verde della luce visibile. Ma nella banda di luce rossa della luce visibile maggiore di 600 nm, l'assorbimento dell'emoglobina è molto piccolo. Pertanto, una grande quantità di luce può passare attraverso i tessuti e la pelle per essere rilevata nella regione rossastra. Almeno alcune centinaia di cellule sottocutanee possono essere rilevate utilizzando la tecnologia di imaging bioluminescente di animali vivi. Tuttavia, a seconda della profondità della sorgente luminosa nel topo, il numero minimo di cellule che possono essere viste varia. In generale, per ogni aumento di 1 cm, l'intensità luminosa si attenua di 10 volte e l'attenuazione è maggiore per i tessuti e gli organi ricchi di sangue e minore attenuazione per i tessuti e gli organi adiacenti alle ossa. A parità di profondità, l'intensità luminosa rilevata ha una relazione lineare significativa con il numero di celle e l'intensità luminosa rilevata può essere quantificata dallo strumento per riflettere il numero di celle.
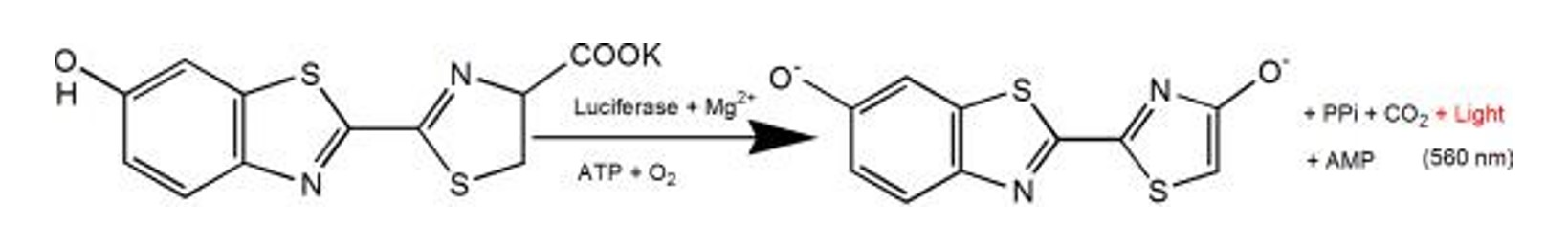
Figura 2. Il principio luminescente della luciferasi e della reazione del sale di potassio della luciferina
Diversamente dalla bioluminescenza, la tecnologia della fluorescenza utilizza geni reporter fluorescenti o coloranti fluorescenti (inclusi nuovi materiali di nano-etichettatura come i punti quantici fluorescenti) per l'etichettatura. Utilizzando la fluorescenza da geni reporter, proteine fluorescenti o coloranti, è possibile creare una sorgente di luce biologica in vivo. La bioluminescenza è autofluorescenza negli animali senza una sorgente di luce di eccitazione, mentre la fluorescenza richiede l'eccitazione da una sorgente di luce di eccitazione esterna prima di poter essere rilevata dal sistema di imaging. Le etichette fluorescenti sono ampiamente utilizzate, inclusi animali, cellule, microrganismi, anticorpi, farmaci, nanomateriali, ecc.
2. Caratteristiche dell'imaging della luciferasi
◎ nessuna radiazione, pressoché innocuo per gli organismi.
◎ bioluminescenza senza fonte di luce di eccitazione.
◎ elevata sensibilità, è possibile rilevare centinaia di cellule.
◎ Buona penetrabilità, è ancora possibile rilevare una profondità tissutale di 3-4 cm.
◎ elevato rapporto segnale/rumore, forte segnale di fluorescenza e buona anti-interferenza.
3. Direzione di applicazione dell'imaging della luciferasi
3.1 Crescita del tumore
Nell'esperimento di tumorigenesi su topi nudi, la crescita del tumore è stata osservata in tempo reale, senza invasione, e non è stato necessario asportare il tumore per la misurazione.
3.2 Farmaci oncologici
È stata rilevata l'influenza della somministrazione sulla crescita del tumore o sulle metastasi e il substrato della fluoresceina è stato eliminato entro 3 ore, senza interferire con l'esperimento sul farmaco.
3.3 Localizzazione cellulare
Sono state rilevate la localizzazione e la distribuzione di cellule estranee negli animali.
3.4 Regolazione dell'espressione genica
Il gene bersaglio o il promotore del gene bersaglio è stato fuso con il gene della luciferasi per rilevare cambiamenti nell'espressione genica durante il trattamento farmacologico o il decorso della malattia.
3.5 Ricerca sulle cellule staminali
Monitoraggio del trapianto, della sopravvivenza e della proliferazione delle cellule staminali; Tracciamento della distribuzione e della migrazione delle cellule staminali in vivo.
4. Esperimento esempio condivisione

Figura 3. in vivo rilevamento tramite imaging dell'effetto terapeutico di CAR-MUC1 T/CAR-MUC1-IL22 Cellule T sulla formazione del tumore mediante iniezione sottocutanea di cellule HN4 in topi[1].
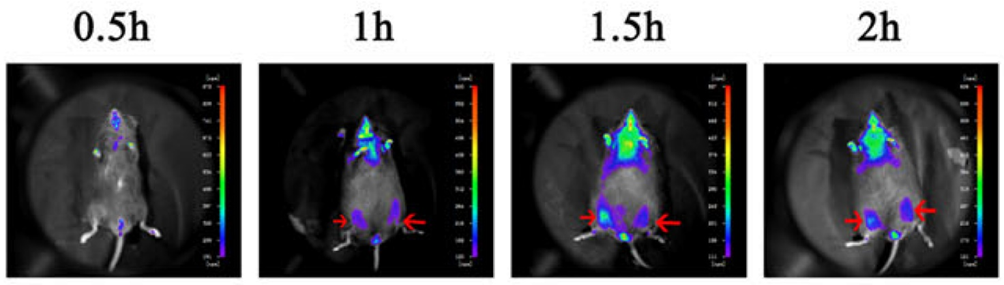
Figura 4. Dopo che le cellule HUC-MSC sono state iniettate nel muscolo scheletrico del topo, la localizzazione delle cellule è stata rilevata da in vivo imaging (contrassegnato dalla freccia rossa)[2].
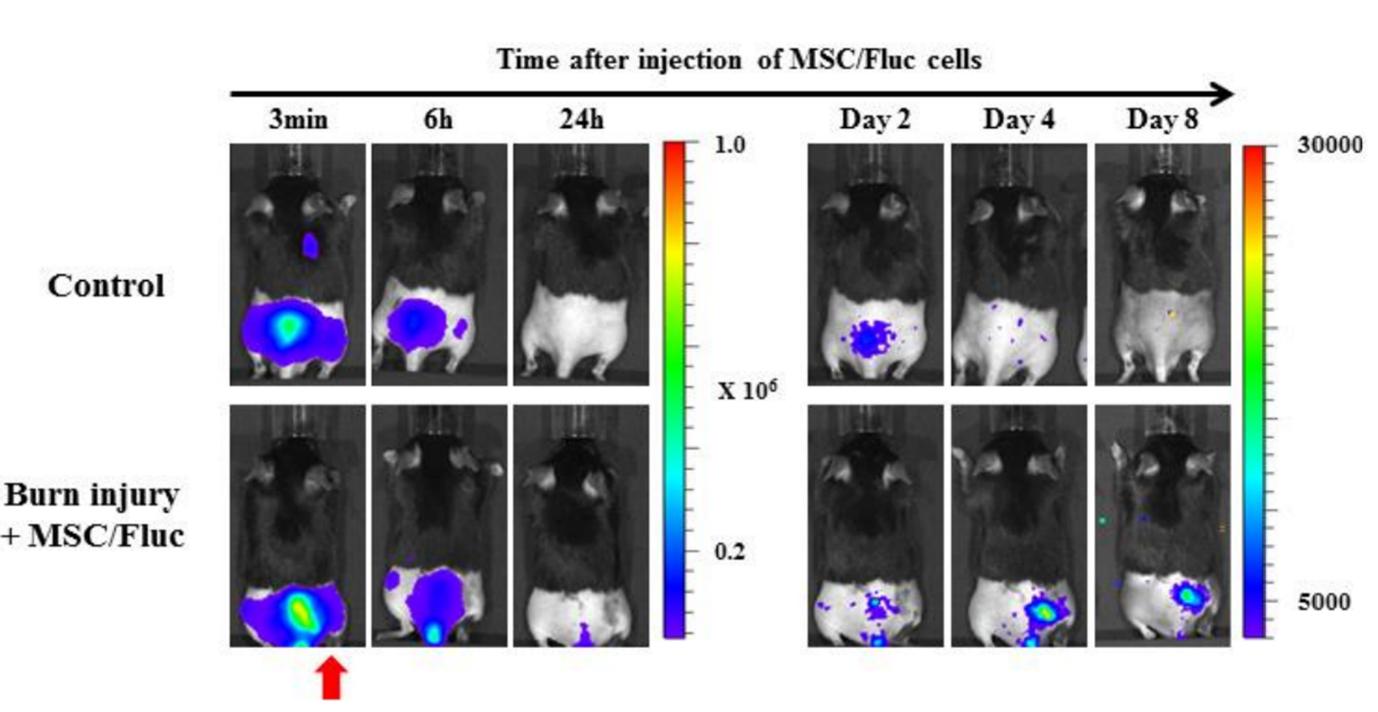
Figura 5. La capacità di in vivo imaging per rilevare la migrazione delle cellule staminali mesenchimali (MSC) verso i siti delle ustioni. Le cellule staminali mesenchimali (MSC/FLuc) sono state iniettate per via endovenosa nel modello di ustione posteriore del topo. Quattro giorni dopo l'iniezione, i segnali di bioluminescenza sono apparsi nel sito leso della ferita da ustione, per poi diminuire gradualmente (la freccia rossa indica il sito dell'ustione)[3].
5. Domande frequenti
D1: Quali sono i vantaggi della tecnologia di imaging mediante bioluminescenza rispetto alla tecnologia tradizionale?
Rispetto alla tecnologia tradizionale, questa tecnologia è più sensibile dei metodi tradizionali nella ricerca di metastasi tumorali, terapia genica, epidemiologia, tracciamento delle cellule staminali, leucemia e altre ricerche correlate. Può anche studiare in modo rapido e intuitivo la patogenesi e lo screening farmacologico di malattie correlate attraverso una serie di modelli di malattie animali transgeniche.
D2: Come etichettare le cellule staminali con il gene della luciferasi?
I geni espressi costitutivamente possono essere etichettati per creare topi transgenici e le cellule staminali vengono etichettate. Le cellule staminali ematopoietiche vengono prelevate dal midollo osseo del topo e trapiantate nel midollo osseo di un altro topo. Questa tecnologia può essere utilizzata per tracciare la proliferazione, la differenziazione e la migrazione delle cellule staminali ematopoietiche nel corpo. Un altro metodo è quello di etichettare le cellule staminali con lentivirus.
D3: Quanto tempo è opportuno effettuare il test dopo l'iniezione di fluoresceina e quanto può durare la luminescenza?
Generalmente, il segnale di fluorescenza raggiunge il periodo stabile più forte dopo l'iniezione intraperitoneale per 10-15 minuti e inizia a decadere dopo 20-30 minuti. Dopo 3 ore, la fluoresceina viene eliminata e la luminescenza scompare completamente.
D4: Come iniettare la fluoresceina nei topi? Qual è la differenza tra i metodi di iniezione?
La fluoresceina può essere iniettata nei topi tramite iniezione intraperitoneale o iniezione nella vena della coda. Può diffondersi a tutto il corpo dei topi in circa 1 min. Nella maggior parte dei casi, la concentrazione di fluoresceina è di 150 mg/kg. Per topi da 20 g, possono essere utilizzati circa 3 mg di fluoresceina. Per l'iniezione intraperitoneale, la diffusione è lenta, la luminescenza iniziale è lenta e il tempo di luminescenza continua è lungo. Per l'iniezione nella vena della coda di fluoresceina, si diffonde rapidamente e inizia a emettere luce rapidamente, ma la durata della luminescenza è breve.
6.Informazioni sul prodotto
Yeasen è una società di biotecnologia impegnata nella ricerca, sviluppo, produzione e vendita di tre principali reagenti biologici: molecole, proteine e cellule. I prodotti forniti da Yeasen sono i seguenti.
Tabella 1. Informazioni sul prodotto
| Informazioni sul prodotto | Codice prodotto | Specifiche |
| D-Luciferina, sale di sodio | 40901ES01/02/03/08/10 | 0,1/0,5/1/5/10 g |
| D-Luciferina, Sale di Potassio | 40902ES01/02/03/08 | 0,1/0,5/1/5 g |
| D-Luciferina Firefly, Acido libero (Informarsi) | 40903ES01/02/03 | 0,1/0,5/1 |
| Celenterazina h (Informarsi) | 40906ES02/03/08 | 0,5/1/5 mg |
| Celenterazina pronta all'uso h (Informarsi) | 40907ES10 | 10 fiale |
| Kit di analisi del gene reporter della luciferasi doppia (Informarsi) | 11402ES60/80 | 100/1000T |
| Kit di analisi del gene reporter della luciferasi (Informarsi) | 11401ES60/76/80 | 100/500/1000T |
| Plasmide reporter della luciferasi VDR (recettore della vitamina D)Informarsi) | 11502ES03 | 1 μg |
| Plasmide reporter della luciferasi STAT1 (Informarsi) | 11504ES03 | 1 μg |
7. Riguardo alla lettura
Una nuova generazione di sistemi di rilevamento del gene reporter della luciferasi: più semplice, più sensibile, più preciso
