T4 DNA 리가제 개요
과학자들은 어떤 효소를 사용하여 새로운 유전자를 결합할까요? 말할 것도 없이 DNA 리가제가 포함됩니다. 그렇다면 재조합 DNA에서 DNA 리가제가 왜 그렇게 중요할까요? DNA 리가제는 실험의 성공을 결정하는 핵심 요소 중 하나인 벡터에 표적 단편을 연결하는 역할을 하기 때문입니다. 일종의 DNA 리가제로서 T4 DNA 리가제는 분자 복제 실험에서 어떤 역할을 할까요? 어떻게 작동할까요? T4 DNA 리가제는 다음에 자세히 소개하겠습니다.
1. T4 DNA 리가제란 무엇입니까?
2. T4 DNA 리가제의 기능은 무엇입니까?
3.
4.
1. T4 DNA 리가제란 무엇입니까?
T4 DNA 리가제는 DNA 분자 간의 연결 반응을 촉매하는 ATP 의존성 리가제입니다. 주로 3'-하이드록실과 5'-인산 말단을 연결하여 인산디에스터를 형성합니다. DNA 리가제는 모든 유기체에서 DNA 복제 및 복구 과정에 관여합니다. 파지 인코딩 T4 DNA 리가제는 E. coli의 파지 T4 감염 중에 생성됩니다.
유전자 공학에 사용되는 리가제는 주로 E. coli DNA 리가제와 T4 DNA 리가제이며, 후자는 현재 더 널리 사용되고 있습니다. T4 DNA 리가제는 이중 가닥 DNA, 이중 가닥 RNA 또는 DNA/RNA 하이브리드 가닥의 단일 가닥 틈을 복구하여 두 개의 인접한 뉴클레오타이드를 연결할 수 있으며 DNA 복구 및 재조합에서 중요한 역할을 합니다.
재조합 플라스미드 구축 과정에서 T4 DNA 리가제는 제한 효소와 함께 사용하여 재조합 플라스미드 구축 실험을 완료할 수 있습니다. 이는 이중 가닥 DNA의 5'-P 말단과 3'-OH 말단 사이에 인산디에스테르 결합 형성을 촉진할 수 있으며 점착성 말단 연결 및 평활 말단 연결에 대한 연결 효율이 좋습니다.
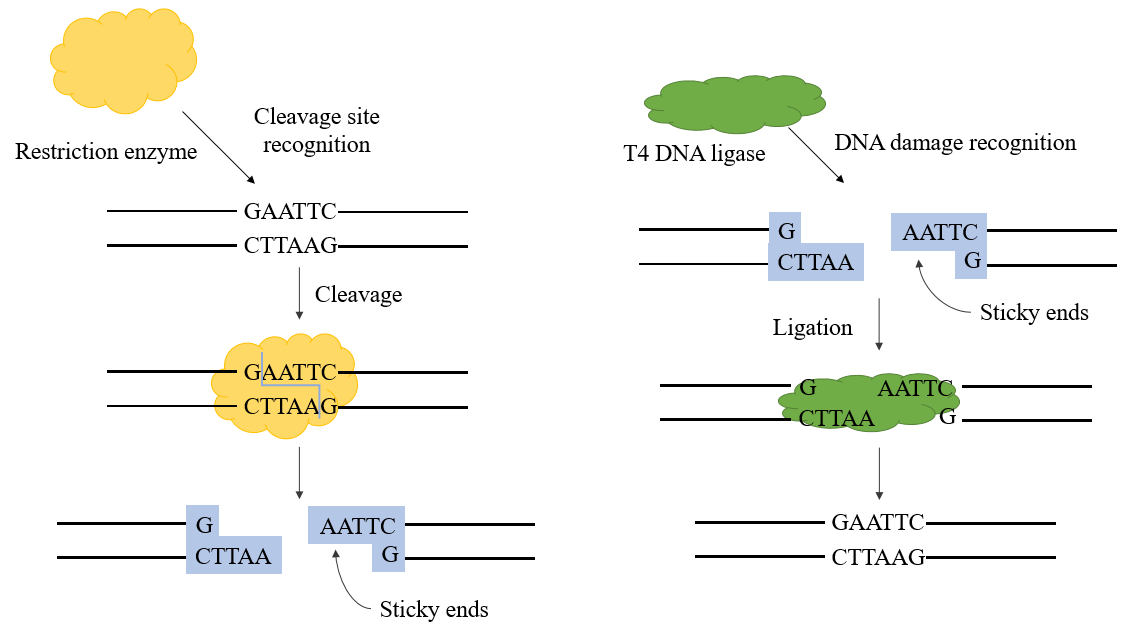
그림 1. T4 DNA 리가제 메커니즘
2. T4 DNA 리가제의 기능은 무엇입니까?
2.1 벡터 구성
벡터 구축 실험에서, 다른 제한 효소는 다른 유형의 끝을 생성할 수 있습니다. 다른 끝의 경우, T4 DNA 리가제는 다른 연결 전략을 가질 것입니다.
2.1.1 제한효소를 이용한 클로닝, 단일 소화에 의해 생성된 점착성 말단
벡터를 구축하는 동안 동일한 제한 효소를 사용하여 표적 유전자의 DNA 단편을 절단하고 벡터 분자가 동일한 스티키 엔드를 생성할 수 있는 경우 T4 DNA 리가제는 직접 재조합 연결을 수행할 수 있습니다. 그러나 스티키 엔드가 동일하기 때문에 표적 유전자를 정방향 또는 역방향으로 벡터에 삽입할 수 있으며, 이는 올바른 재조합 클론에 대한 스크리닝 작업 부하를 쉽게 증가시킬 것입니다. 벡터 구축을 위해 이중 효소 소화 방법을 사용하는 것을 고려하십시오.
또한, 단일 효소 소화에 의해 제조된 벡터의 응집성 말단도 쌍을 이룰 수 있으며, 그런 다음 T4 DNA 리가제의 작용 하에 뉴클레오타이드 사이에 인산디에스테르 결합이 형성되어 벡터의 자가 결찰이 발생한다. 알칼리성 인산가수분해효소를 사용하여 소화된 벡터를 처리하면 벡터의 5' 말단에 있는 인산기를 제거하여 벡터가 자가 결찰을 완료할 수 없게 된다. 따라서 T4 DNA 리가제의 작용 하에 벡터와 표적 단편이 연결되어 재조합 벡터의 구축이 완료된다.
2.1.2 제한효소를 이용한 클로닝, 이중 소화에 의해 생성된 점착성 말단
벡터 구축 과정에서 서로 다른 스티키 엔드를 갖는 두 가지 제한 효소를 사용하여 타겟 단편과 벡터를 각각 소화하면 두 가지 다른 스티키 엔드를 생성할 수 있습니다. 이 시점에서 T4 DNA 리가제는 동일한 스티키 엔드를 선택적으로 연결하여 타겟 단편이 올바른 방향으로 벡터에 삽입되도록 할 수 있습니다. 그림 2의 타겟 단편과 벡터를 동시에 EcoR I과 BamH I로 소화하면 동일한 스티키 엔드를 연결할 수 있습니다. 타겟 단편과 벡터 사이에는 연결 방향이 하나뿐입니다.

그림 2. 이중 효소 소화에 의해 생성된 Sticky end ligation [1]
2.1.3 제한 단편의 클로닝, 블런트 엔드
일부 제한 엔도뉴클레아제는 Sma I 및 기타와 같이 효소적 절단 중에 블런트 말단을 생성할 수도 있습니다. T4 DNA 리가제는 벡터와 삽입물 사이에 인산디에스테르 결합을 직접 형성할 수 있으며, 염기 간의 페어링이 필요하지 않습니다. 그러나 이 방법은 라이게이션 효율이 낮고 벡터 자가 라이게이션이 발생하기 쉽습니다. 일반적으로 블런트 말단은 스티키 말단으로 전환한 다음 라이게이션할 수 있습니다. 예를 들어, 타겟 단편과 벡터의 말단에 상보적 폴리 A 및 폴리 T 염기를 추가하고 인공적으로 스티키한 상보적 말단을 각각 추가하면 말단 데옥시뉴클레오티딜 전이효소에 의한 연결 효율이 향상됩니다.
2.1.4 TA 클로닝
TA 클로닝에 사용되는 T 벡터는 3' 말단에 T-오버행이 있다. 타겟 단편의 DNA 서열이 불분명한 경우, 타겟 유전자 단편은 TA 클로닝에 의해 T 벡터에 연결될 수 있으며, 타겟 유전자는 시퀀싱에 의해 결정될 수 있다. PCR에 사용되는 Taq DNA 중합효소는 말단 전이효소 활성을 가지고 있으며, DNA 단편의 3' 말단에 뉴클레오타이드 "A"를 추가할 수 있다. T4 DNA 리가제는 Taq DNA 중합효소에 의해 증폭된 생성물을 T 벡터에 직접 연결할 수 있으며, PCR 증폭 생성물은 인공 어댑터를 추가하지 않고도 효율적인 클로닝의 목적을 달성할 수 있다.
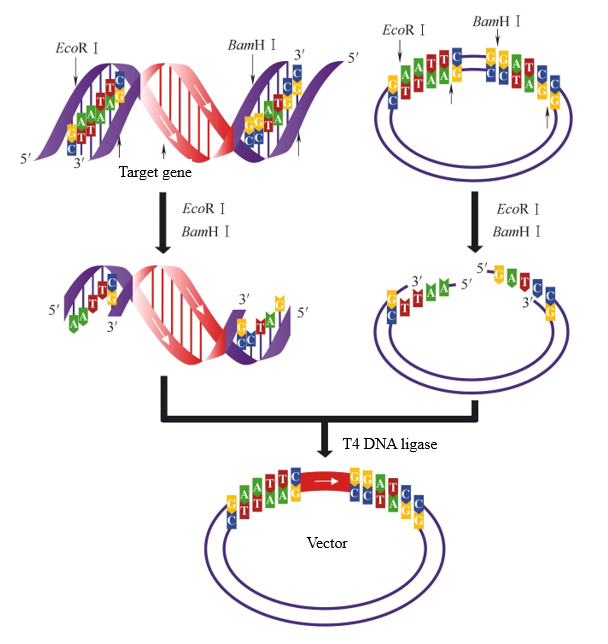
그림 3. TA 클로닝의 워크플로우 [2]
2.2 NGS 어댑터 결찰
차세대 시퀀싱 라이브러리를 구축하는 동안 시퀀싱 칩의 유동 셀에 고정하여 시퀀싱을 완료하기 전에 인공 어댑터를 PCR 생성물에 연결해야 합니다. TA 클로닝 라이게이션 링커 라이브러리 구축은 매우 일반적인 기술적 수단이며, 그 원리는 위에서 언급한 TA 클로닝과 유사합니다. 시퀀싱할 DNA 단편을 5' 말단에서 인산화하고 3' 말단에 "A"를 첨가한 후, "T" 스티키 말단이 있는 어댑터와 상보적이고 쌍을 이룹니다. 그런 다음 완전한 이중 가닥이 형성되고 기계에 의해 시퀀싱됩니다.
TA 라이게이션 중에 다양한 샘플 유형이나 핵산 단편 구조의 복잡성은 라이게이션의 효율성에 영향을 미치므로 다양한 플랫폼의 어댑터도 최종 라이브러리 결과에 영향을 미칩니다.
예를 들어, MGI 플랫폼의 Bubble 어댑터는 특수한 2차 구조를 가지고 있어 T4 DNA 리가제에 대해 매우 높은 연결 효율이 필요하며, 연결 효율의 감소는 라이브러리 출력에 직접적인 영향을 미칩니다.
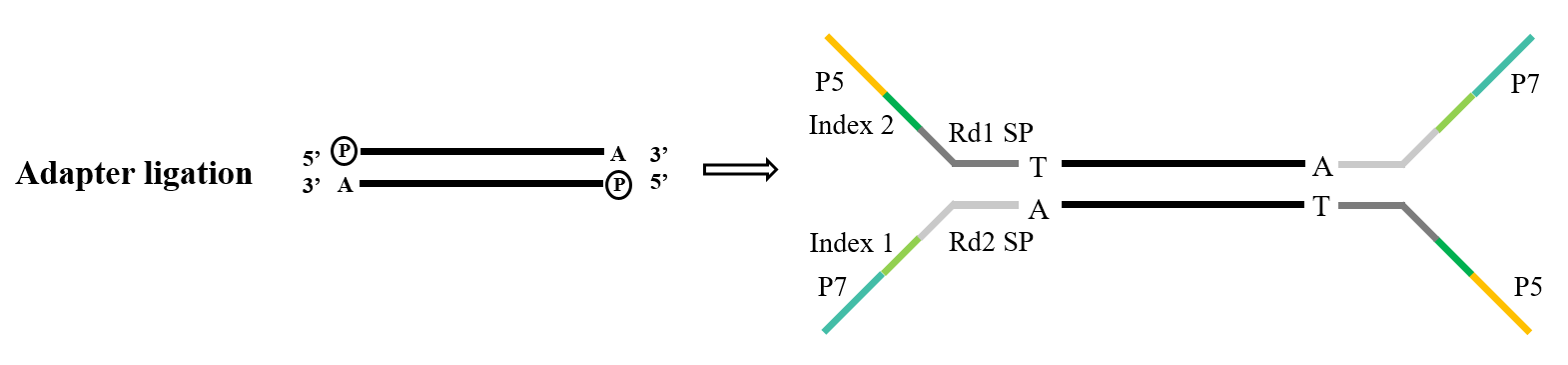
그림 4. 일반적인 어댑터 결찰 과정
3. Yeasen Biotech T4 DNA 리가제는 NGS 어댑터 라이게이션에 사용 가능
3.1 초고 결합 효율을 가진 Yeasen Biotech Fast T4 DNA 리가제
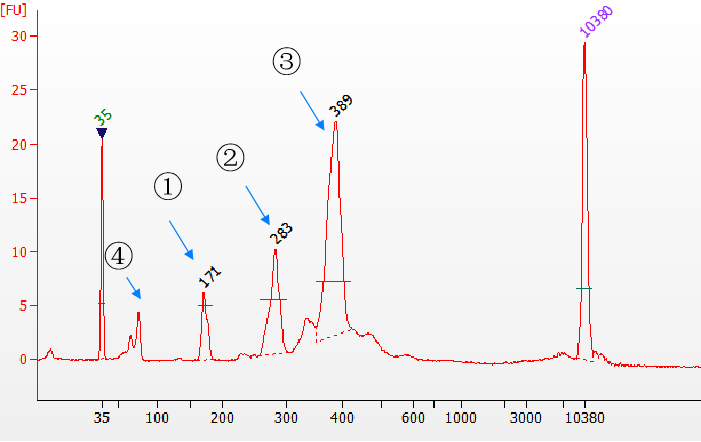
그림 5. Agilent 2100에서 감지된 다양한 유형의 라이게이션 제품
3.2 Yeasen Biotech Fast T4 DNA 리가제, 우수한 라이브러리 수율
다른 T4 DNA 리가제와 비교해 다양한 유형의 라이브러리 구축에 Fast T4 DNA 리가제를 사용하면 라이브러리 수율이 더 우수합니다.
표 1. 도서관에서 다양한 종류의 샘플 제공
|
샘플의 종류 |
장내 미생물군 gDNA |
cfDNA |
FFPE HD200 gDNA |
|||
|
T4 DNA 리가제 (동일한 단위) |
예센 |
N* |
예센 |
N* |
예센 |
N* |
|
입력 DNA(ng) |
10 |
10 |
50 |
|||
|
증폭주기수 |
10 |
10 |
8 |
|||
|
평균수율(μg) 일루미나 플랫폼 |
3.3 |
2.8 |
2.7 |
2.2 |
3 |
2.5 |
|
평균수율(μg) MGI 플랫폼 |
2.7 |
0.9 |
2.0 |
0.7 |
2.3 |
0.8 |
4. Yeasen Biotech T4 DNA 리가제 선택 가이드
표 2: 관련 제품
|
제품 포지셔닝 |
제품 이름 |
고양이# |
애플리케이션 |
|
만능인 |
Hieff™ Gold T4 DNA 리가제( 문의 ) |
10300ES |
분자 복제. |
|
만능인 |
10301ES |
NGS 라이브러리 구축. |
|
|
높은 결찰 효율성 및 낮은 숙주 대장균 잔류물 |
10299ES |
NGS 라이브러리 구축은 특히 병원균 검출, NIPT 검출 등에 적합합니다. |
|
|
높은 감도 |
10298ES |
NGS 라이브러리 구축은 특히 cfDNA 샘플의 라이브러리 구축에 적합합니다. |
참고문헌
[1] W. Yuan. 유전자공학[M]. 화학산업출판사, 2019.
[2] Clark DP, Pazdernik NJ, Mcgehee M R. 합성생물학을 위한 유전자 복제 - ScienceDirect[J]. 분자생물학(제3판), 2019:199-239.
[3] Tomkinson AE, Vijayakumar S, Pascal JM, et al. DNA 리가제: 구조, 반응 메커니즘 및 기능[J]. 화학 리뷰, 2006, 106(2):687-699.
[4] Shuman S. DNA 리가제: 진행 상황 및 전망[J]. 생화학 저널, 2009, 284(26):17365-17369.
