Visão geral da T4 DNA Ligase
Quais enzimas os cientistas usam para ligar um novo gene? Nem é preciso dizer que a DNA ligase está incluída. Então por que a DNA ligase é tão importante no DNA recombinante? Porque a DNA ligase é responsável por ligar o fragmento alvo ao vetor, que é um dos elementos-chave que determinam o sucesso do experimento. Como um tipo de DNA ligase, qual o papel da T4 DNA ligase em experimentos de clonagem molecular? Como funciona? A T4 DNA ligase será completamente introduzida a seguir.
1. O que é T4 DNA Ligase?
2. Qual é a função da T4 DNA ligase?
3. A ligase de DNA T4 da
4. Um guia de seleção para a ligase de DNA T4 da
1. O que é T4 DNA Ligase?
A ligase de DNA T4 é uma ligase dependente de ATP que catalisa a reação de ligação entre moléculas de DNA. Ela forma principalmente fosfodiéster ligando as extremidades 3'-hidroxila e 5'-fosfato. As ligases de DNA estão envolvidas nos processos de replicação e reparo de DNA em todos os organismos. A ligase de DNA T4 codificada por fago é produzida durante a infecção por fago T4 de E. coli.
As ligases usadas na engenharia genética são principalmente a E. coli DNA ligase e a T4 DNA ligase, sendo esta última mais amplamente usada atualmente. A T4 DNA ligase pode reparar cortes de fita simples em DNA fita dupla, RNA fita dupla ou fitas híbridas de DNA/RNA para conectar dois nucleotídeos adjacentes, e desempenha um papel importante no reparo e recombinação de DNA.
No processo de construção de plasmídeo recombinante, a ligase de DNA T4 pode ser usada junto com enzimas de restrição para completar o experimento de construção de plasmídeo recombinante. Ela pode catalisar a formação de uma ligação fosfodiéster entre a extremidade 5'-P e a extremidade 3'-OH do DNA fita dupla e tem uma boa eficiência de conexão para conexão de extremidade pegajosa e conexão de extremidade romba.
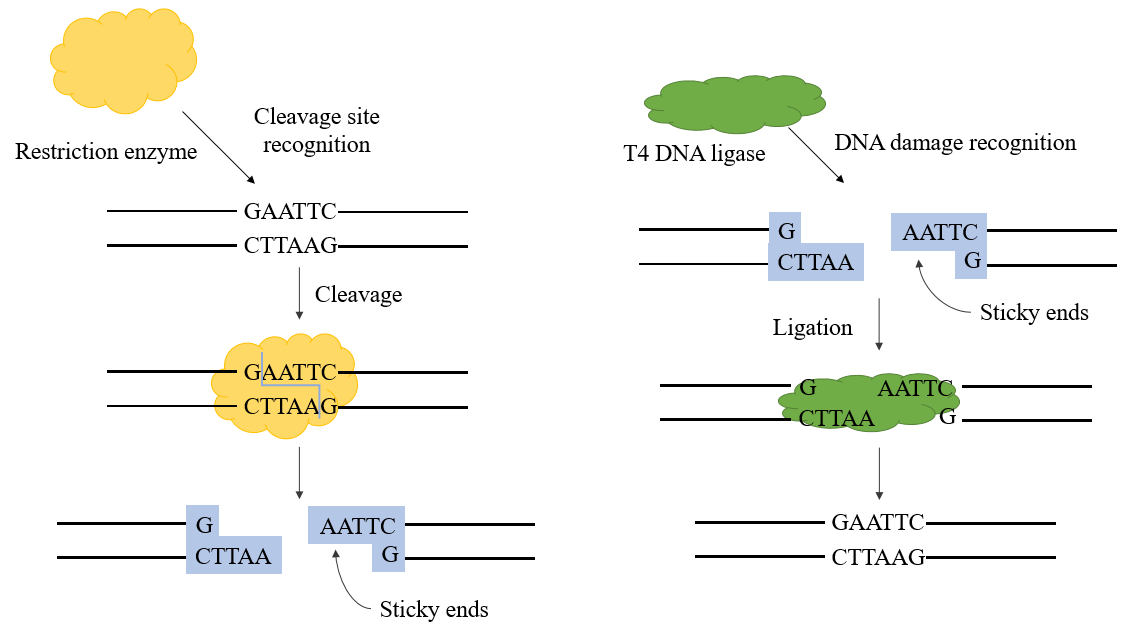
Figura 1. Mecanismo da ligase de DNA T4
2. Qual é a função da T4 DNA ligase?
2.1 Construção de vetores
Em experimentos de construção de vetores, diferentes enzimas de restrição podem produzir diferentes tipos de extremidades. Para diferentes extremidades, a T4 DNA ligase terá diferentes estratégias de ligação.
2.1.1 Clonagem com enzimas de restrição, extremidades pegajosas produzidas por digestão única
Durante a construção do vetor, se a mesma endonuclease de restrição for usada para cortar o fragmento de DNA do gene alvo e a molécula do vetor puder produzir a mesma extremidade pegajosa, a ligase de DNA T4 pode realizar diretamente a conexão de recombinação. No entanto, como as extremidades pegajosas são as mesmas, o gene alvo pode ser inserido no vetor na direção direta ou reversa, o que aumentará facilmente a carga de trabalho da triagem para clones recombinantes corretos. Considere usar o método de digestão de enzima dupla para a construção do vetor.
Além disso, as extremidades coesivas do vetor preparado por digestão enzimática única também podem ser pareadas, e então ligações fosfodiéster são formadas entre nucleotídeos sob a ação da T4 DNA ligase, resultando na autoligação do vetor. Usar fosfatase alcalina para tratar o vetor digerido pode remover o grupo fosfato na extremidade 5' do vetor para que o vetor não possa completar a autoligação. Assim, sob a ação da T4 DNA ligase, o vetor e o fragmento alvo são conectados para completar a construção do vetor recombinante.
2.1.2 Clonagem com enzimas de restrição, extremidades pegajosas produzidas por digestões duplas
No processo de construção do vetor, se duas enzimas de restrição com diferentes extremidades pegajosas forem usadas para digerir o fragmento alvo e o vetor, respectivamente, duas extremidades pegajosas diferentes podem ser geradas. Neste ponto, a ligase de DNA T4 pode ligar seletivamente as mesmas extremidades pegajosas para garantir que o fragmento alvo seja inserido no vetor na direção correta. Quando o fragmento alvo e o vetor na Figura 2 são digeridos com EcoR I e BamH I ao mesmo tempo, as mesmas extremidades pegajosas podem ser conectadas. Há apenas uma direção de ligação entre o fragmento alvo e o vetor.

Figura 2. Ligação de extremidade pegajosa gerada pela digestão de enzima dupla[1]
2.1.3 Clonagem de fragmentos de restrição, extremidade romba
Algumas endonucleases de restrição também podem gerar extremidades rombas durante clivagens enzimáticas, como Sma I e outras. A ligase de DNA T4 pode formar diretamente uma ligação fosfodiéster entre o vetor e o inserto, e não há necessidade de pareamento entre as bases. No entanto, esse método tem baixa eficiência de ligação e é propenso à autoligação do vetor. Geralmente, as extremidades rombas podem ser convertidas em extremidades pegajosas e então ligadas. Por exemplo, adicionar bases poli A e poli T complementares às extremidades do fragmento alvo e o vetor e as extremidades complementares artificialmente pegajosas, respectivamente, melhoram a eficiência da conexão pela desoxinucleotidil transferase terminal.
2.1.4 Clonagem de TA
O vetor T usado na clonagem TA tem uma saliência T na extremidade 3'. Quando a sequência de DNA do fragmento alvo não está clara, o fragmento do gene alvo pode ser conectado ao vetor T pela clonagem TA, e o gene alvo pode ser determinado pelo sequenciamento. A Taq DNA polimerase usada na PCR tem atividade de transferase terminal e pode adicionar um nucleotídeo "A" à extremidade 3' do fragmento de DNA. A T4 DNA ligase pode conectar diretamente o produto amplificado pela Taq DNA polimerase ao vetor T, e o produto amplificado pela PCR pode atingir o propósito de clonagem eficiente sem adicionar adaptadores artificiais.
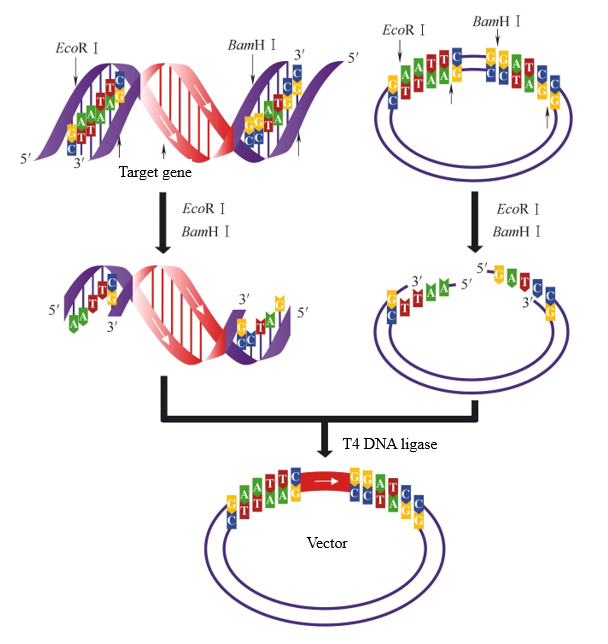
Figura 3. O fluxo de trabalho da clonagem de TA[2]
2.2 Ligação do adaptador NGS
Durante a construção da biblioteca de sequenciamento de próxima geração, é necessário conectar o adaptador artificial ao produto de PCR antes que ele possa ser fixado na célula de fluxo no chip de sequenciamento para concluir o sequenciamento. A construção da biblioteca de ligação de ligação de clonagem TA é um meio técnico muito comum, e seu princípio é semelhante à clonagem TA mencionada acima. Depois que o fragmento de DNA a ser sequenciado é fosforilado na extremidade 5' e "A" é adicionado na extremidade 3', ele é complementar e pareado com o adaptador com a extremidade adesiva "T". A fita dupla completa é então formada e sequenciada pela máquina.
Durante a ligação TA, diferentes tipos de amostra ou a complexidade da estrutura do fragmento de ácido nucleico afetarão a eficiência da ligação, de modo que os adaptadores de diferentes plataformas também terão impacto no resultado final da biblioteca.
Por exemplo, o adaptador Bubble da plataforma MGI tem uma estrutura secundária especial e requer eficiência de ligação muito alta para a ligase de DNA T4, e a redução da eficiência de ligação afeta diretamente a saída da biblioteca.
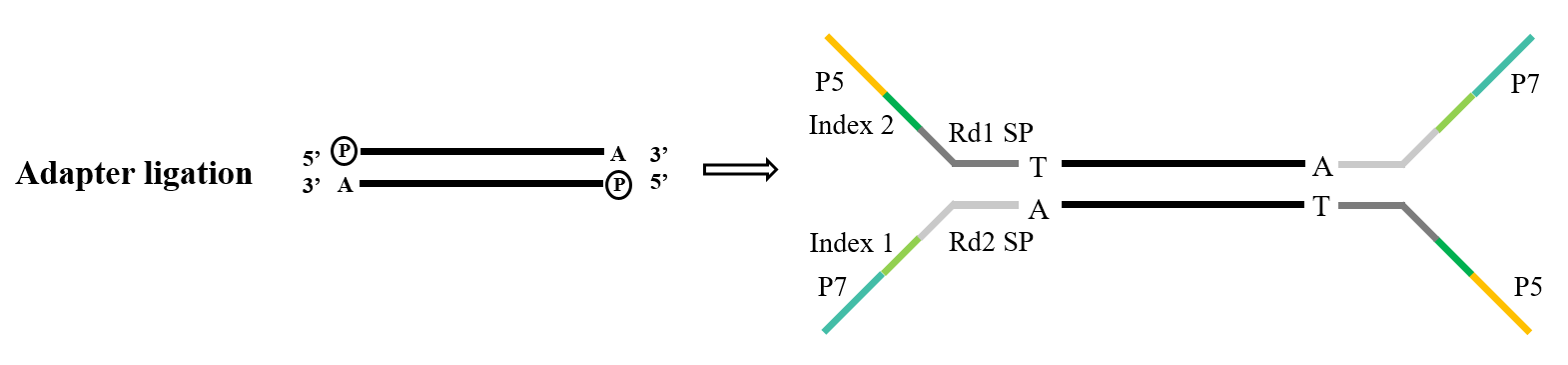
Figura 4. Processo geral de ligação do adaptador
3.A ligase de DNA T4 da Yeasen Biotech pode ser usada para ligação do adaptador NGS
A
3.1 Yeasen Biotech Fast T4 DNA ligase com eficiência de ligação ultra-alta
Use a ligase de DNA Fast T4 da
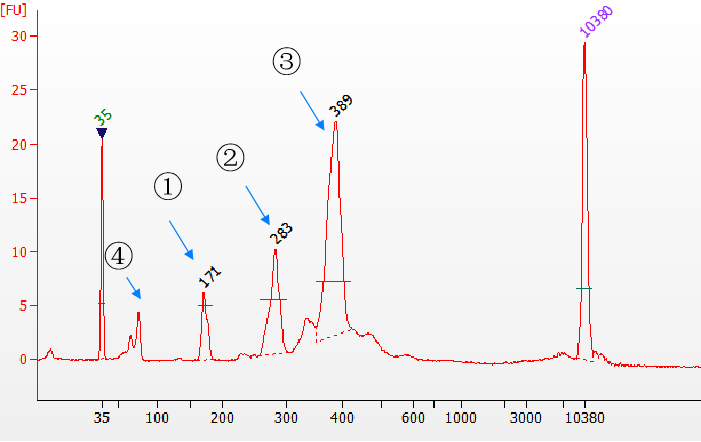
Figura 5. Diferentes tipos de produtos de ligação detectados pelo Agilent 2100
3.2 Yeasen Biotech Fast T4 DNA ligase com excelente rendimento de biblioteca
Usando a ligase de DNA T4 rápida para diferentes tipos de construção de biblioteca, em comparação com outras ligases de DNA T4, os rendimentos da biblioteca são melhores.
Tabela 1. Bibliotecas produzem diferentes tipos de amostras
| Tipos de amostras | Microbiota intestinal gDNA | ADNc | FFPE HD200 gDNA | |||
| Ligase de DNA T4 (mesma unidade) | | Não | | Não | | Não |
| DNA de entrada (ng) | 10 | 10 | 50 | |||
| Número do ciclo de amplificação | 10 | 10 | 8 | |||
| Rendimento médio (μg) Plataforma Illumina | 3.3 | 2.8 | 2.7 | 2.2 | 3 | 2,5 |
| Rendimento médio (μg) Plataforma MGI | 2.7 | 0,9 | 2.0 | 0,7 | 2.3 | 0,8 |
4. Um guia de seleção para a ligase de DNA T4 da Yeasen Biotech
A
Tabela 2: Produtos relacionados
| Posicionamento do produto | Nome do produto | Gato# | Aplicativo |
| Universal | Hieff™ Gold T4 DNA Ligase(Inquirir) | 10300ES | Clonagem molecular. |
| Universal | 10301ES | Construção da biblioteca NGS. | |
| Alta eficiência de ligação e baixa E. coli hospedeira resíduos | 10299ES | Construção de biblioteca NGS, especialmente adequada para detecção de patógenos, detecção de NIPT, etc. | |
| Alta sensibilidade | 10298ES | Construção de biblioteca NGS, especialmente adequada para construção de bibliotecas de amostras de cfDNA. |
Referências
[1] W. Yuan. Engenharia genética[M]. Imprensa da indústria química, 2019.
[2] Clark DP, Pazdernik NJ, Mcgehee M R. Clonagem de genes para biologia sintética - ScienceDirect[J]. Biologia molecular (terceira edição), 2019:199-239.
[3] Tomkinson AE, Vijayakumar S, Pascal JM, et al. Ligases de DNA: Estrutura, Mecanismo de Reação e Função[J]. Chemical Reviews, 2006, 106(2):687-699.
[4] Shuman S. DNA Ligases: Progresso e Perspectivas[J]. Journal of Biological Chemistry, 2009, 284(26):17365-17369.
