Com o aprofundamento da pesquisa sobre organoides, um número crescente de indivíduos está aderindo. Este artigo resume alguns pontos de conhecimento comum sobre organoides [1-5], esperando ser útil a todos.
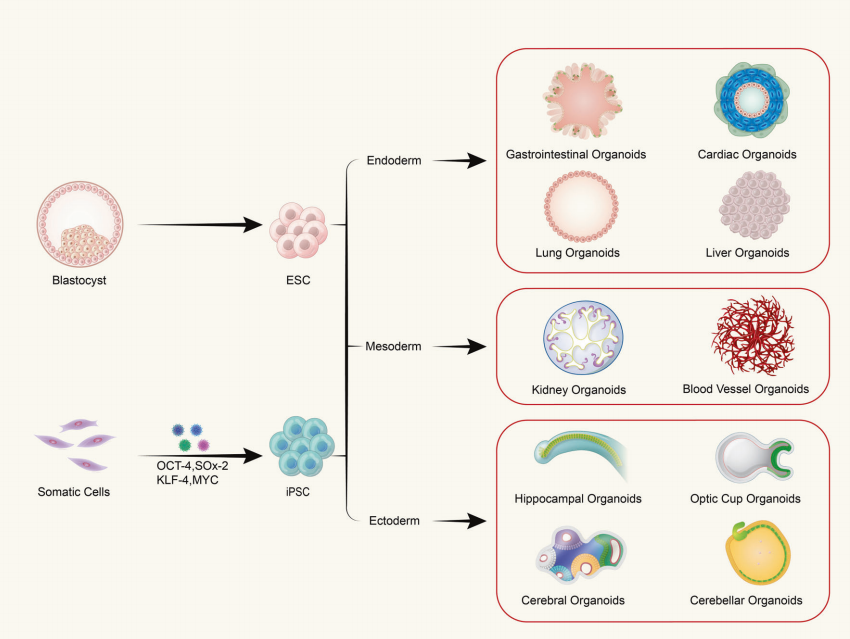
P: Os organoides são compostos de um único tipo de célula ou de tecidos multicelulares?
Organoides são formados a partir do cultivo tridimensional (3D) in vitro de células-tronco adultas ou células-tronco pluripotentes, resultando em estruturas semelhantes a tecidos com uma certa organização espacial. Organoides não são estruturas compostas de células únicas; em vez disso, eles são formados pela indução de divisão e diferenciação de células iniciadoras com propriedades de células-tronco, que então se automontam em tecidos com uma certa estrutura espacial, morfologia e funcionalidade semelhantes aos órgãos correspondentes in vivo.
P: Quais são as fontes para o cultivo de organoides?
(1) Organoides derivados de células-tronco pluripotentes incluem células-tronco adultas (ASC), células-tronco pluripotentes (PSC) e células-tronco pluripotentes induzidas (iPSC). (2) Organoides derivados de células extraídas de tecidos são comumente encontrados em tecidos tumorais.
P: O tecido congelado pode ser usado para cultivo 3D na ausência de tecido fresco?
Sim, mas há requisitos maiores para o tamanho do tecido congelado, e a viabilidade do tecido e das células primárias congeladas diminuirá significativamente, levando a uma taxa de sucesso muito reduzida no cultivo subsequente.
P: Como os organoides são congelados e ressuscitados?
O momento ideal para congelar organoides é nas passagens 2-5, quando a atividade e o potencial de diferenciação dos organoides estão no seu melhor. A ressuscitação de organoides pode seguir os métodos usados para ressuscitação celular.
P: É necessário controlar o tamanho dos organoides cultivados e é benéfico se eles forem muito grandes?
Sim, é necessário controlar o tamanho, preferencialmente dentro de 500μm, pois os organoides não têm sistemas de circulação interna vascular e gás-líquido. Quando o tamanho dos organoides é grande, as células próximas ao centro lutam para trocar oxigênio e nutrientes com o ambiente externo. Portanto, quanto maior a estrutura, maior o número de células mortas.
P: Além de usar gel de matriz, o que mais pode ser usado para cultivar organoides?
Além do gel de matriz, as alternativas para o cultivo de organoides incluem (1) matriz extracelular descelularizada e outras proteínas derivadas, (2) hidrogéis sintéticos e (3) géis de proteína recombinante projetados.
P: Como a diferenciação direcionada de organoides pode ser alcançada?
O desenvolvimento inicial da diferenciação induzida por células-tronco em organoides é regulado conjuntamente por múltiplas vias de sinalização. O cultivo in vitro requer a adição de fatores de crescimento para simular a atividade dessas vias de sinalização, guiando as células para se diferenciarem em direções específicas. Por exemplo, a indução com Y27632 e Activina A pode diferenciar células-tronco embrionárias (ESCs) ou células-tronco pluripotentes induzidas (iPSCs) em corpos embrionários (EBs). Posteriormente, as vias de sinalização são reguladas por fatores como Wnt3a, FGF-4 e Noggin para induzir a diferenciação de células-tronco em direções específicas.
P: Como a contaminação pode ser evitada ao obter amostras clínicas?
(1) Garantir a amostragem asséptica tanto quanto possível. (2) Antes da extração, imergir em PBS contendo antibióticos por vários minutos: para tumores localizados em áreas com potencial contato com o ambiente externo, como estômago, intestinos e bexiga, é recomendado imergir em PBS contendo 3%-5% de antibióticos por 5-10 minutos; para outros tumores comuns, imergir em PBS contendo 1%-2% de antibióticos por cerca de 5 minutos. (3) Todos os reagentes usados durante a extração de células devem conter 1% de antibióticos e uma concentração apropriada de antibióticos primários.
P: Quais precauções devem ser tomadas para a coleta, preservação e transporte de tecidos tumorais?
Colete tecidos tumorais com alto teor de células tumorais o máximo possível e minimize o tempo de exposição das amostras de tecido ao ar para reduzir a probabilidade de contaminação. Coloque as amostras de tecido tumoral coletadas em tubos estéreis contendo solução especial de preservação de amostra o mais rápido possível e transporte-as rapidamente para a unidade de teste em baixa temperatura (em torno de 4°C) (esforce-se para entregar dentro de 2 a 4 horas após a amostragem).
P: Existe alguma diferença entre organoides cultivados de lesões e aqueles cultivados de tecidos adjacentes?
Quais são os requisitos para os locais de amostragem de tecidos tumorais? Sim, há uma diferença. Os próprios tumores exibem heterogeneidade, então é comum observar diferenças entre organoides derivados de diferentes fontes. Morfologicamente, organoides derivados de lesões primárias tendem a ter uma estrutura mais invasiva em comparação com aqueles de tecidos adjacentes, geralmente parecendo mais irregulares. Para minimizar erros na modelagem ou triagem de drogas, várias amostras devem ser coletadas de áreas com boa atividade.
P: Que tipos de medicamentos podem ser usados para testes de sensibilidade a medicamentos de organoides tumorais?
Os principais tipos de medicamentos antitumorais na prática clínica podem ser classificados em três categorias: medicamentos citotóxicos (como paclitaxel, cisplatina/carboplatina, 5-FU, etc.), medicamentos direcionados (medicamentos que têm como alvo EGFR, HER2, VEGFR, etc.) e medicamentos de imunoterapia representados por inibidores de ponto de controle imunológico (anticorpos PD-1, anticorpos PD-L1, etc.).
P: Qual é a taxa de sucesso do cultivo de DOP?
A taxa de sucesso do cultivo de PDO varia ligeiramente dependendo da fonte. A maioria dos PDOs tem uma taxa de sucesso entre 63% e 70%, ou até mais, até 90%, o que é amplamente correlacionado com a atividade do próprio tecido. Além disso, tratamentos clínicos podem afetar a taxa de sucesso. As taxas de sucesso podem ser melhoradas reduzindo o tempo de etapas ex vivo e operacionais do tecido.
P: O tecido congelado pode ser usado para cultivo de organoides?
Geralmente, a criopreservação de tecidos não é recomendada devido à perda significativa de viabilidade. No entanto, se os tecidos forem armazenados a -80 °C, a janela ideal para o cultivo de organoides é dentro de 6 semanas após a preservação. Se os tecidos forem armazenados em nitrogênio líquido, o tempo de preservação pode ser maior, mas de preferência não exceder seis meses.
P: Ao extrair células primárias, geralmente há fibroblastos misturados. Como eles devem ser tratados?
(1) Devido à baixa adesão dos fibroblastos, eles podem ser removidos por adesão repetida.(2) Reagentes de remoção de fibroblastos podem ser usados, mas se eles afetam o cultivo de organoides precisa de validação experimental.
P: Quanto tecido tumoral original é necessário para cultivar organoides tumorais? A amostra de biópsia é suficiente?
Geralmente, os tecidos cirúrgicos devem ser maiores que o tamanho de 2 a 3 grãos de soja; se obtidos por biópsia por agulha, são necessárias pelo menos 2 a 3 amostras, enquanto biópsias endoscópicas exigem que pelo menos seis ou mais tecidos tumorais sejam pinçados.
P: Se a amostra de tecido tumoral for muito pequena e o número de organoides cultivados for insuficiente para testes subsequentes, o que deve ser feito?
Como organoides derivados de fontes tumorais podem exibir diferenças fenotípicas após a passagem, a passagem geralmente não é recomendada. É recomendado na literatura limitar a passagem de organoides a 2-3 gerações, com um máximo de 5 gerações. Se o número de células for muito pequeno e não puder atender aos requisitos de teste após 5 gerações, considere mudar o método de teste, como usar uma placa menor de 384 poços ou tentar chips microfluídicos para teste.
P: Haverá células normais em tecidos tumorais? Como remover essas células normais?
Pode haver um pequeno número de células normais. Primeiro, tente evitar amostrar tecidos normais durante a coleta. Segundo, após extrair células primárias, a classificação de esferas magnéticas ou citometria de fluxo pode ser usada para posterior cultivo de organoides. Quando um número muito pequeno de células normais está presente, isso não afeta significativamente a modelagem e o cultivo subsequentes de organoides, então a remoção pode não ser necessária.
P: Ao extrair células primárias de tecidos tumorais, por que as células parecem vermelhas?
Os tecidos são ricos em suprimento sanguíneo in vivo, então há muitas hemácias. Na maioria dos casos, isso não requer processamento e não afeta o cultivo de organoides. Se houver muitas hemácias, elas podem ser tratadas adequadamente com tampão de lise antes do cultivo.
P: Durante o cultivo de organoides, partículas pretas são encontradas. Como removê-las?
Partículas pretas são provavelmente impurezas ou restos celulares. Elas podem ser removidas de duas maneiras:
Digerir os organoides e lavá-los repetidamente com meio para diluir as impurezas.
Use um bisturi cirúrgico esterilizado para cortar os organoides ao meio e, em seguida, use uma seringa de 1 ml cheia de meio para remover suavemente as impurezas dos organoides.
P: Existe um limite para o número de passagens para cultivo de organoides e quantas passagens podem ser conduzidas?
O número de passagens geralmente depende das propriedades das células de origem. A maioria dos organoides pode ser passada in vitro por até 10 vezes (>6 meses). A escolha das condições de cultura também pode ter alguma influência, com o meio condicionado geralmente superior ao meio de fator sintético.
P: As linhas de células tumorais (como a linha celular HepG2) podem ser cultivadas em PDOs?
PDOs são estruturas automontadas complexas. Sistemas de cultura 3D formados por linhagens celulares únicas não podem ser chamados de PDOs; eles são simplesmente chamados de estados esféricos 3D.
P: Quais são os critérios para passagem de organoides?
Dependendo do estado de desenvolvimento dos organoides, o tempo varia, geralmente entre 5-10 dias, com um diâmetro de cerca de 100-200μm. Alguns organoides de desenvolvimento lento podem levar várias semanas para atingir um estado de passagem adequado.
P: Como contar o número de organoides viáveis?
Durante o experimento, retire a solução de armazenamento Calcein-AM pré-preparada e adicione a solução Calcein-AM ao meio até uma concentração final de 0,2 μmol/L. Incube a 37 °C por 60 minutos. Após o tempo ter decorrido, lave lentamente o meio contendo Calcein-AM com PBS e adicione meio fresco. Use um microscópio de fluorescência com um comprimento de onda de excitação de 490 nm e um comprimento de onda de emissão de 515 nm para observar e fotografar os organoides. Os organoides vivos aparecerão verdes e terão bordas claras. Conte os organoides com um diâmetro > 20 μm.
P: Como calcular a viabilidade de organoides?
A viabilidade dos organoides é calculada de acordo com a fórmula: X=(Nlive/Ntotal)×100%, onde: X representa a viabilidade dos organoides; Nlive representa o número de organoides vivos; Ntotal representa o número total de organoides.
P: Quais são os métodos para identificar organoides?
O método mais básico é observar a morfologia dos organoides por meio de um microscópio e realizar a coloração H&E. Outros métodos incluem Western Blot, qRT-PCR, imunofluorescência, citometria de fluxo para detectar se os organoides expressam biomarcadores correspondentes. O sequenciamento genético pode identificar a correspondência genética entre os organoides cultivados e o tecido de origem. Para alguns organoides, testes funcionais podem ser conduzidos para ver se eles possuem funções específicas. Por exemplo, estudos mostraram que organoides gástricos podem secretar ácido gástrico, e organoides cardíacos podem bater autonomamente.
P: Células normais também podem crescer em organoides? Como remover organoides normais durante o cultivo de organoides tumorais?
Células normais também podem crescer em organoides. Os métodos para remover organoides normais incluem: (1) Seleção manual com base nos resultados de coloração HE sob um microscópio; (2) Purificação de PDOs ajustando a composição do meio de cultura (como fatores de crescimento/inibidores de moléculas pequenas); (3) Dispersão de PDOs em células únicas para citometria de fluxo ou classificação de esferas magnéticas.
P: Durante experimentos de sensibilidade a medicamentos, os PDOs devem ser digeridos do gel da matriz?
Não, os PDOs precisam de uma estrutura tridimensional para simular condições in vivo. Se não houver suporte do gel de matriz, a precisão dos experimentos de sensibilidade a medicamentos será afetada. Geralmente, medicamentos solúveis podem penetrar no gel de matriz para atuar em organoides, mas ao conduzir experimentos imunocitoquímicos, é necessário remover o gel de matriz.
P: Os experimentos com PDO podem substituir completamente os modelos animais (PDX)?
Os PDOs podem substituir parcialmente os PDX, mas não podem substituí-los completamente.
P: Quais poderiam ser as razões para o crescimento anormal de PDOs durante o cultivo, caracterizado por ciclos de crescimento mais curtos e rápida proliferação em comparação às condições anteriores?
Fatores externos: (1) Essa anormalidade pode ser causada pelo crescimento extensivo de certas células contaminantes, como fibroblastos. Nesses casos, é recomendado realizar coloração de corte e observação para confirmar a presença dessas células contaminadas e então proceder para removê-las. (2) Mudanças nas condições de cultura, incluindo a adição de certos fatores ou pequenas moléculas, podem ativar ainda mais as vias de proliferação de PDOs.
Fatores internos: Possíveis mutações genéticas. Para verificar isso, o sequenciamento é recomendado, e os resultados devem ser comparados com aqueles dos PDOs primários para determinar se há alguma mutação genética.
P: Como a sensibilidade dos PDOs aos medicamentos pode ser testada?
Os PDOs podem ser testados para sensibilidade a medicamentos usando métodos como ensaio CCK8, ensaio de viabilidade celular ATP e coloração viva/morta. Avaliar a atividade ATP de organoides tumorais é o método mais comum. O ATP é a molécula de energia mais importante nas células e pode ser usado para medir os níveis metabólicos celulares, refletindo o número de células viáveis. Com base no efeito da administração do medicamento no conteúdo de ATP celular, o valor IC50 (concentração inibitória metade máxima do medicamento testado) para cada regime de medicamento pode ser calculado usando software de análise para selecionar os medicamentos mais eficazes para inibição tumoral.
P: As faixas de concentração para experimentos de sensibilidade a medicamentos de PDOs são as mesmas que aquelas para células tumorais primárias?
Não, elas não são as mesmas. Normalmente, a concentração de fármaco para PDOs precisa ser maior do que para células primárias. Experimentos preliminares podem ser conduzidos para analisar as concentrações ótimas para experimentos formais de sensibilidade a fármacos.
P: Em que estágio de crescimento os organoides devem ser usados para testes de drogas?
Geralmente é recomendado usar organoides dentro de 5 passagens para teste de drogas. Nesta fase, os organoides exibem a melhor estabilidade e atividade.
P: Quais são os critérios para determinar o sucesso do estabelecimento do organoide?
(1) Avaliação preliminar inicial: a morfologia organoide muda de um estado celular para formas como vacuolar, brotamento, compacto ou solto. (2) Identificação da expressão de biomarcadores específicos, que devem ser semelhantes à distribuição em fatias de tecido. Análises de sequenciamento adicionais podem ser realizadas para comparações mais detalhadas.
P: Como o cultivo de organoides difere da cultura celular regular?
(1) Diferentes métodos de cultura de células: Organoides requerem o suporte de substratos ou estruturas espaciais para manter sua estrutura tridimensional, enquanto a cultura de células regular não requer isso. (2) A cultura de organoides requer a obtenção de diferenciação ex vivo e automontagem, exigindo assim o uso de combinações de várias citocinas para indução, resultando em componentes de meio de cultura relativamente complexos. A cultura de células regular geralmente envolve apenas um único tipo de célula, então os componentes do meio de cultura são relativamente simples.(3) Diferentes fontes de células: Os organoides são derivados de células epiteliais multipotentes, enquanto a cultura celular regular é adequada para cultivar vários tipos de células selecionadas.
P: Como posso determinar se as esferas 3D que cultivei são organoides e se são consistentes com o tecido alvo?
Os métodos para identificar organoides incluem coloração H&E, imuno-histoquímica (IHC), sequenciamento de célula única e outros. É necessário fazer julgamentos multidimensionais de perspectivas morfológicas, histopatológicas e genéticas moleculares para determinar se são consistentes com o órgão ou tecido alvo. Para organoides tumorais, a detecção de biomarcadores específicos pode ser usada para confirmação.
P: Se a morfologia dos organoides observados durante o cultivo diferir do que é relatado na literatura, qual poderia ser o motivo?
Em primeiro lugar, podem existir diferenças individuais e heterogeneidade em fontes e subtipos de amostra. Em segundo lugar, diferenças na qualidade de citocinas selecionadas e alguns inibidores de moléculas pequenas usados para indução podem levar a variações na morfologia de diferenciação de diferentes organoides. É sugerido confirmar a consistência entre a morfologia do organoide e o tecido de origem por meio de métodos como coloração HE, IHC e sequenciamento genético, em vez de confiar apenas em descrições da literatura.
P: Ao conduzir experimentos de sensibilidade a medicamentos com organoides, é necessário controlar a quantidade de DMSO usada como solvente para medicamentos?
Sim, normalmente experimentos de sensibilidade a medicamentos exigem que a porcentagem de volume de DMSO seja inferior a 0,5%.
P: Como os organoides podem ser recuperados do gel da matriz?
Os seguintes métodos são recomendados: (1) Soluções de recuperação de organoides disponíveis comercialmente (CAT#41421ES) podem ser usadas para obter suspensões de células de forma suave e eficaz, sem danificar células ou proteínas da superfície celular. (2) O gel da matriz pode ser descongelado em baixa temperatura para amolecê-lo e liberar os organoides.
P: Muitos organoides aderem às paredes do tubo de centrífuga durante a recuperação. Como a taxa de recuperação pode ser melhorada?
Ao centrifugar após a coleta, use uma centrífuga de rotor horizontal e aumente a velocidade de centrifugação apropriadamente. Geralmente, uma força centrífuga de cerca de 300g e uma velocidade de aproximadamente 1000-1200rpm são adequadas.
Citocinas relacionadas Informação
| Pproduto Nãoeu sou | GATO | Tamanho |
| Wnt-3a humano | 92276ES10 | 10µg |
| 92278ES20 | 20µg | |
| 92701ES10 | 10µg | |
| Cabeça Humana | 92528ES10 | 10µg |
| 91330ES10 | 10µg | |
| 91306ES10 | 10µg | |
| 91502ES10 | 10µg | |
| 91701ES08 | 10µg | |
| 92602ES60 | 100µg | |
| 91204ES10 | 10µg | |
| 90601ES10 | 10µg | |
| 91113ES10 | 10µg | |
| 92279ES10 | 10µg | |
| 92055ES10 | 10µg | |
| 92053ES10 | 10µg | |
| 92129ES08 | 5µg | |
| 91304ES10 | 10µg | |
| 91702ES10 | 10µg | |
| 92252ES60 | 100µg | |
| 90103ES10 | 10µg | |
| 90104ES10 | 10µg | |
| 90197ES10 | 10µg | |
| 90144ES08 | 10µg | |
| 90196ES10 | 10µg | |
| 90194ES10 | 10µg | |
| 90111ES10 | 10µg | |
| 90120ES10 | 10µg | |
| 90198ES10 | 10µg | |
| 91605ES10 | 10µg | |
| 92251ES10 | 10µg | |
| 92566ES08 | 5µg | |
| 92102ES10 | 10µg | |
| 91103ES10 | 10µg | |
| 92711ES10 | 10µg | |
| 92122ES60 | 100µg | |
| 92201ES60 | 100µg | |
| 92275ES20 | 20µg | |
| BMP-2 humana | 92051ES10 | 10µg |
Leitura relacionada:
Referência
