По мере углубления исследований органоидов к ним присоединяется все больше людей. В этой статье обобщены некоторые общие сведения об органоидах [1–5], и мы надеемся, что она будет полезна всем.
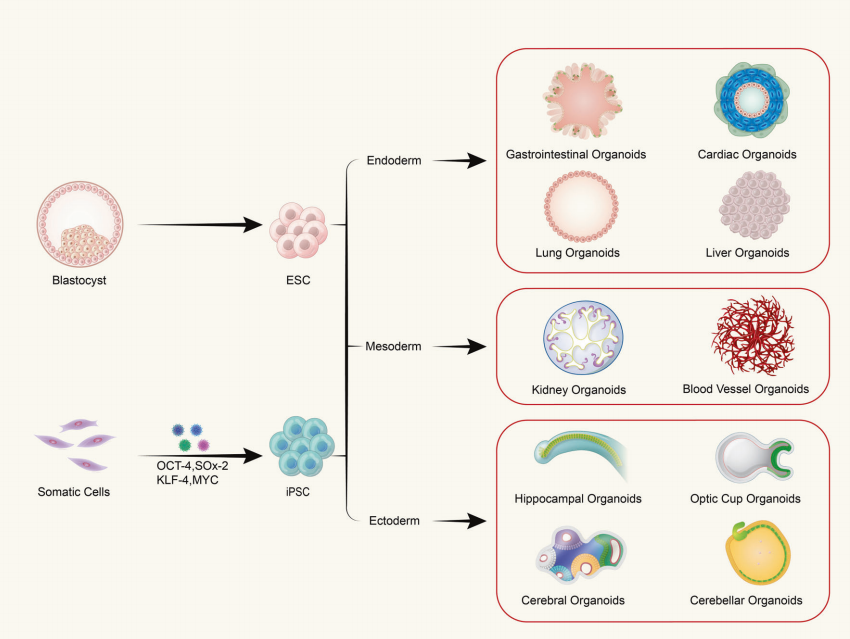
В: Состоят ли органоиды из одного типа клеток или из многоклеточных тканей?
Органоиды формируются в результате in vitro трехмерного (3D) культивирования взрослых стволовых клеток или плюрипотентных стволовых клеток, что приводит к образованию тканеподобных структур с определенной пространственной организацией. Органоиды не являются структурами, состоящими из отдельных клеток; скорее, они формируются путем индукции деления и дифференциации инициирующих клеток со свойствами стволовых клеток, которые затем самоорганизуются в ткани с определенной пространственной структурой, морфологией и функциональностью, подобной соответствующим органам in vivo.
В: Каковы источники культивирования органоидов?
(1) Органоиды, полученные из плюрипотентных стволовых клеток, включают взрослые стволовые клетки (ASC), плюрипотентные стволовые клетки (PSC) и индуцированные плюрипотентные стволовые клетки (iPSC). (2) Органоиды, полученные из клеток, извлеченных из тканей, обычно встречаются в опухолевых тканях.
В: Можно ли использовать замороженную ткань для 3D-культивирования при отсутствии свежей ткани?
Да, но требования к размеру замороженной ткани выше, а жизнеспособность первично замороженных тканей и клеток значительно снизится, что приведет к значительному снижению успешности последующего культивирования.
В: Как замораживают и реанимируют органоиды?
Оптимальное время для заморозки органоидов — 2-5 пассажи, когда активность и потенциал дифференциации органоидов находятся на самом высоком уровне. Реанимация органоидов может осуществляться по тем же методам, что и реанимация клеток.
В: Необходимо ли контролировать размер культивируемых органоидов, и полезно ли, если они слишком большие?
Да, необходимо контролировать размер, желательно в пределах 500 мкм, так как органоиды не имеют внутренних сосудистых и газожидкостных систем циркуляции. Когда размер органоидов большой, клетки около центра испытывают трудности с обменом кислородом и питательными веществами с внешней средой. Поэтому, чем больше структура, тем больше мертвых клеток.
В: Помимо матричного геля, что еще можно использовать для культивирования органоидов?
Помимо матричного геля, альтернативами для культивирования органоидов являются (1) децеллюляризованный внеклеточный матрикс и другие производные белки, (2) синтетические гидрогели и (3) сконструированные рекомбинантные белковые гели.
В: Как можно добиться направленной дифференциации органоидов?
Раннее развитие дифференциации, вызванной стволовыми клетками, в органоидах совместно регулируется несколькими сигнальными путями. Культивирование in vitro требует добавления факторов роста для имитации активности этих сигнальных путей, направляя клетки к дифференциации в определенных направлениях. Например, индукция с Y27632 и Activin A может дифференцировать эмбриональные стволовые клетки (ESC) или индуцированные плюрипотентные стволовые клетки (iPSC) в эмбриоидные тельца (EB). Впоследствии сигнальные пути регулируются такими факторами, как Wnt3a, FGF-4 и Noggin, для индукции дифференциации стволовых клеток в определенных направлениях.
В: Как можно избежать загрязнения при получении клинических образцов?
(1) Обеспечьте максимально возможную асептичность отбора проб. (2) Перед экстракцией погрузите в PBS, содержащий антибиотики, на несколько минут: для опухолей, расположенных в областях с потенциальным контактом с внешней средой, таких как желудок, кишечник и мочевой пузырь, рекомендуется погрузить в PBS, содержащий 3%-5% антибиотиков, на 5-10 минут; для других распространенных опухолей погрузить в PBS, содержащий 1%-2% антибиотиков, примерно на 5 минут. (3) Все реагенты, используемые во время экстракции клеток, должны содержать 1% антибиотиков и соответствующую концентрацию первичных антибиотиков.
В: Какие меры предосторожности следует соблюдать при сборе, сохранении и транспортировке опухолевых тканей?
Соберите как можно больше опухолевых тканей с высоким содержанием опухолевых клеток и минимизируйте время воздействия воздуха на образцы тканей, чтобы снизить вероятность заражения. Поместите собранные образцы опухолевой ткани в стерильные пробирки, содержащие специальный раствор для консервации образцов, как можно скорее и быстро транспортируйте их в испытательный блок при низкой температуре (около 4°C) (старайтесь доставить в течение 2~4 часов после взятия пробы).
В: Есть ли разница между органоидами, культивированными из пораженных участков, и органоидами, культивированными из соседних тканей?
Каковы требования к местам отбора образцов опухолевых тканей? Да, разница есть. Сами опухоли проявляют гетерогенность, поэтому часто можно наблюдать различия между органоидами, полученными из разных источников. Морфологически органоиды, полученные из первичных поражений, имеют тенденцию иметь более инвазивную структуру по сравнению с органоидами из соседних тканей, и, как правило, выглядят более нерегулярными. Чтобы свести к минимуму ошибки при моделировании или скрининге лекарственных препаратов, следует брать несколько образцов из областей с хорошей активностью.
В: Какие типы препаратов можно использовать для тестирования чувствительности опухолевых органоидов к препаратам?
Основные типы противоопухолевых препаратов, применяемых в клинической практике, можно разделить на три категории: цитотоксические препараты (такие как паклитаксел, цисплатин/карбоплатин, 5-ФУ и др.), таргетные препараты (препараты, воздействующие на EGFR, HER2, VEGFR и др.) и иммунотерапевтические препараты, представленные ингибиторами иммунных контрольных точек (антитела к PD-1, антитела к PD-L1 и др.).
В: Каков процент успешности выращивания PDO?
Успешность культивирования PDO немного варьируется в зависимости от источника. Большинство PDO имеют успешность от 63% до 70% или даже выше, до 90%, что в значительной степени коррелирует с активностью самой ткани. Кроме того, на успешность могут влиять клинические методы лечения. Успешность можно улучшить, сократив время ex vivo и операционные этапы.
В: Можно ли использовать замороженную ткань для выращивания органоидов?
Обычно криоконсервация тканей не рекомендуется из-за значительной потери жизнеспособности. Однако, если ткани хранятся при -80°C, оптимальное окно для культивирования органоидов составляет 6 недель после консервации. Если ткани хранятся в жидком азоте, время консервации может быть больше, но предпочтительно не превышать шести месяцев.
В: При извлечении первичных клеток обычно присутствуют фибробласты. Как с ними поступать?
(1) Из-за плохой адгезии фибробластов их можно удалить путем повторной адгезии.(2) Можно использовать реагенты для удаления фибробластов, но необходимо экспериментальное подтверждение того, влияют ли они на культивирование органоидов.
В: Сколько исходной опухолевой ткани необходимо для культивирования опухолевых органоидов? Достаточно ли образца биопсии?
Как правило, хирургические ткани должны быть больше по размеру, чем 2–3 соевых боба; при получении с помощью игольчатой биопсии требуется не менее 2–3 образцов, в то время как при эндоскопической биопсии требуется захватить не менее шести или более образцов опухолевой ткани.
В: Что следует делать, если образец опухолевой ткани слишком мал и количество культивированных органоидов недостаточно для последующего тестирования?
Поскольку органоиды, полученные из опухолевых источников, могут проявлять фенотипические различия после пассирования, пассирование, как правило, не рекомендуется. В литературе рекомендуется ограничивать пассирование органоидов 2-3 поколениями, максимум 5 поколениями. Если количество клеток слишком мало и не может соответствовать требованиям тестирования после 5 поколений, рассмотрите возможность изменения метода тестирования, например, использование меньшего 384-луночного планшета или попытки использования микрофлюидных чипов для тестирования.
В: Будут ли нормальные клетки в опухолевых тканях? Как удалить эти нормальные клетки?
Может быть небольшое количество нормальных клеток. Во-первых, постарайтесь избегать отбора проб нормальных тканей во время сбора. Во-вторых, после извлечения первичных клеток для дальнейшего культивирования органоидов можно использовать сортировку магнитными шариками или проточную цитометрию. Когда присутствует очень небольшое количество нормальных клеток, это не оказывает существенного влияния на последующее моделирование и культивирование органоидов, поэтому их удаление может не потребоваться.
В: Почему при извлечении первичных клеток из опухолевых тканей клетки выглядят красными?
Ткани богаты кровоснабжением in vivo, поэтому в них много эритроцитов. В большинстве случаев это не требует обработки и не влияет на культивирование органоидов. Если эритроцитов слишком много, их можно соответствующим образом обработать буфером лизиса перед культивированием.
В: При культивировании органоидов обнаруживаются черные частицы. Как их удалить?
Черные частицы, скорее всего, являются примесями или остатками клеток. Их можно удалить двумя способами:
Органоиды переваривают и многократно промывают средой для разбавления примесей.
Стерильным хирургическим ножом разрежьте органоиды пополам, затем с помощью шприца объемом 1 мл, наполненного средой, аккуратно вымойте примеси из органоидов.
В: Существует ли ограничение на количество пассажей при культивировании органоидов, и сколько пассажей можно провести?
Количество пассажей обычно зависит от свойств исходных клеток. Большинство органоидов можно пассировать in vitro до 10 раз (>6 месяцев). Выбор условий культивирования также может иметь некоторое влияние, при этом кондиционированная среда обычно превосходит среду с синтетическим фактором.
В: Можно ли культивировать линии опухолевых клеток (например, линию клеток HepG2) в ПДО?
PDO — это сложные самоорганизующиеся структуры. Трехмерные системы культивирования, образованные отдельными клеточными линиями, нельзя назвать PDO; их просто называют трехмерными сферическими состояниями.
В: Каковы критерии пассирования органоидов?
В зависимости от стадии развития органоидов время варьируется, обычно от 5 до 10 дней, с диаметром около 100-200 мкм. Некоторым медленно развивающимся органоидам может потребоваться несколько недель, чтобы достичь подходящего для пассажа состояния.
В: Как подсчитать количество жизнеспособных органоидов?
Во время эксперимента извлеките заранее приготовленный раствор для хранения Calcein-AM и добавьте раствор Calcein-AM в среду до конечной концентрации 0,2 мкмоль/л. Инкубируйте при 37°C в течение 60 минут. По истечении времени медленно смойте среду, содержащую Calcein-AM, с помощью PBS и добавьте свежую среду. Используйте флуоресцентный микроскоп с длиной волны возбуждения 490 нм и длиной волны испускания 515 нм, чтобы наблюдать и фотографировать органоиды. Живые органоиды будут выглядеть зелеными и иметь четкие края. Подсчитайте органоиды диаметром >20 мкм.
В: Как рассчитать жизнеспособность органоидов?
Жизнеспособность органоидов рассчитывается по формуле: X=(Nжив/Nобщ)×100%, где: X — жизнеспособность органоидов; Nжив — количество живых органоидов; Nобщ — общее количество органоидов.
В: Каковы методы идентификации органоидов?
Самый простой метод — наблюдение за морфологией органоидов через микроскоп и выполнение окраски H&E. Другие методы включают вестерн-блот, qRT-PCR, иммунофлуоресценцию, проточную цитометрию для определения того, экспрессируют ли органоиды соответствующие биомаркеры. Генетическое секвенирование может определить генетическое соответствие между культивируемыми органоидами и исходной тканью. Для некоторых органоидов можно провести функциональные тесты, чтобы увидеть, обладают ли они определенными функциями. Например, исследования показали, что желудочные органоиды могут секретировать желудочную кислоту, а сердечные органоиды могут сокращаться автономно.
В: Могут ли нормальные клетки также вырасти в органоиды? Как удалить нормальные органоиды во время выращивания опухолевых органоидов?
Нормальные клетки также могут превращаться в органоиды. Методы удаления нормальных органоидов включают: (1) Ручной отбор на основе результатов окрашивания HE под микроскопом; (2) Очистку PDO путем корректировки состава культуральной среды (например, факторов роста/малых молекулярных ингибиторов); (3) Диспергирование PDO в отдельные клетки для проточной цитометрии или сортировки магнитными шариками.
В: Следует ли в ходе экспериментов по изучению чувствительности к лекарственным препаратам выщелачивать ПДО из матричного геля?
Нет, PDOs нужна трехмерная структура для имитации условий in vivo. Если нет поддержки со стороны матричного геля, точность экспериментов по чувствительности к лекарствам будет нарушена. Как правило, растворимые лекарства могут проникать через матричный гель, чтобы воздействовать на органоиды, но при проведении иммуноцитохимических экспериментов необходимо удалить матричный гель.
В: Могут ли эксперименты PDO полностью заменить модели животных (PDX)?
PDO могут частично заменить PDX, но не могут заменить их полностью.
В: Каковы могут быть причины аномального роста PDO во время культивирования, характеризующегося укороченными циклами роста и быстрой пролиферацией по сравнению с предыдущими условиями?
Внешние факторы: (1) Эта аномалия может быть вызвана обширным ростом определенных загрязняющих клеток, таких как фибробласты. В таких случаях рекомендуется выполнить окрашивание срезов и наблюдение, чтобы подтвердить наличие этих загрязненных клеток, а затем приступить к их удалению. (2) Изменения условий культивирования, включая добавление определенных факторов или малых молекул, могут дополнительно активировать пути пролиферации PDO.
Внутренние факторы: Возможные генетические мутации. Для проверки рекомендуется секвенирование, а результаты следует сравнить с результатами первичных PDO, чтобы определить, есть ли какие-либо генетические мутации.
В: Как можно проверить чувствительность PDO к лекарственным препаратам?
PDO можно тестировать на чувствительность к препаратам с помощью таких методов, как анализ CCK8, анализ жизнеспособности клеток АТФ и окрашивание живых/мертвых клеток. Оценка активности АТФ опухолевых органоидов является наиболее распространенным методом. АТФ является самой важной энергетической молекулой в клетках и может использоваться для измерения уровней клеточного метаболизма, отражающих количество жизнеспособных клеток. На основе влияния введения препарата на содержание клеточного АТФ можно рассчитать значение IC50 (полумаксимальная ингибирующая концентрация тестируемого препарата) для каждого режима приема препарата с помощью аналитического программного обеспечения для выбора наиболее эффективных препаратов для ингибирования опухоли.
В: Являются ли диапазоны концентраций для экспериментов по определению чувствительности ПДО к препаратам такими же, как и для первичных опухолевых клеток?
Нет, это не одно и то же. Обычно концентрация препарата для PDO должна быть выше, чем для первичных клеток. Можно провести предварительные эксперименты для анализа оптимальных концентраций для формальных экспериментов по чувствительности к препаратам.
В: На какой стадии роста следует использовать органоиды для тестирования лекарств?
Обычно рекомендуется использовать органоиды в течение 5 пассажей для тестирования лекарств. На этой стадии органоиды проявляют наилучшую стабильность и активность.
В: Каковы критерии определения успешности создания органоида?
(1) Ранняя предварительная оценка: морфология органоида изменяется от клеточного состояния до таких форм, как вакуолярная, почковатая, компактная или рыхлая. (2) Идентификация экспрессии специфических биомаркеров, которая должна быть аналогична распределению в срезах тканей. Для более детального сравнения можно провести дополнительный анализ последовательности.
В: Чем выращивание органоидов отличается от обычной культуры клеток?
(1) Различные методы культивирования клеток: органоидам требуется поддержка субстратов или пространственных структур для поддержания их трехмерной структуры, в то время как обычная клеточная культура не требует этого. (2) Органоидная культура требует достижения дифференциации ex vivo и самосборки, что требует использования комбинаций различных цитокинов для индукции, что приводит к относительно сложным компонентам культуральной среды. Обычная клеточная культура обычно включает только один тип клеток, поэтому компоненты культуральной среды относительно просты.(3) Различные источники клеток: органоиды получают из мультипотентных эпителиальных клеток, тогда как обычная клеточная культура подходит для культивирования различных типов выбранных клеток.
В: Как я могу определить, являются ли культивированные мной 3D-сферы органоидами и соответствуют ли они целевой ткани?
Методы идентификации органоидов включают окрашивание H&E, иммуногистохимию (ИГХ), секвенирование отдельных клеток и другие. Необходимо делать многомерные суждения с морфологической, гистопатологической и молекулярно-генетической точек зрения, чтобы определить, соответствуют ли они целевому органу или ткани. Для опухолевых органоидов для подтверждения можно использовать обнаружение специфических биомаркеров.
В: Если морфология органоидов, наблюдаемых во время культивирования, отличается от описанной в литературе, в чем может быть причина?
Во-первых, могут существовать индивидуальные различия и гетерогенность в источниках образцов и подтипах. Во-вторых, различия в качестве выбранных цитокинов и некоторых ингибиторов малых молекул, используемых для индукции, могут привести к вариациям в морфологии дифференциации различных органоидов. Предлагается подтверждать согласованность между морфологией органоида и исходной тканью с помощью таких методов, как окрашивание HE, IHC и генетическое секвенирование, а не полагаться исключительно на литературные описания.
В: Необходимо ли при проведении экспериментов по изучению чувствительности органоидов к лекарственным препаратам контролировать количество ДМСО, используемого в качестве растворителя для лекарственных препаратов?
Да, обычно в экспериментах по определению чувствительности к лекарственным препаратам объемная доля ДМСО составляет менее 0,5%.
В: Как можно извлечь органоиды из матричного геля?
Рекомендуются следующие методы: (1) Коммерчески доступные растворы для восстановления органоидов (CAT#41421ES) можно использовать для бережного и эффективного получения клеточных суспензий без повреждения клеток или белков клеточной поверхности. (2) Матричный гель можно разморозить при низкой температуре, чтобы размягчить его и высвободить органоиды.
В: Многие органоиды прилипают к стенкам центрифужной пробирки во время восстановления. Как можно улучшить скорость восстановления?
При центрифугировании после сбора используйте горизонтальную роторную центрифугу и увеличьте скорость центрифугирования соответствующим образом. Обычно подходят центробежная сила около 300 г и скорость около 1000-1200 об/мин.
| Ппродукт Наме | КОТ | Размер |
| Человеческий Wnt-3a | 92276ES10 | 10μг |
| 92278ES20 | 20μг | |
| 92701ES10 | 10μг | |
| Человеческая голова | 92528ES10 | 10μг |
| 91330ES10 | 10μг | |
| 91306ES10 | 10μг | |
| 91502ES10 | 10μг | |
| 91701ES08 | 10μг | |
| 92602ES60 | 100μг | |
| 91204ES10 | 10μг | |
| 90601ES10 | 10μг | |
| 91113ES10 | 10μг | |
| 92279ES10 | 10μг | |
| 92055ES10 | 10μг | |
| 92053ES10 | 10μг | |
| 92129ES08 | 5μг | |
| 91304ES10 | 10μг | |
| 91702ES10 | 10μг | |
| 92252ES60 | 100μг | |
| 90103ES10 | 10μг | |
| 90104ES10 | 10μг | |
| 90197ES10 | 10μг | |
| 90144ES08 | 10μг | |
| 90196ES10 | 10μг | |
| 90194ES10 | 10μг | |
| 90111ES10 | 10μг | |
| 90120ES10 | 10μг | |
| 90198ES10 | 10μг | |
| 91605ES10 | 10μг | |
| 92251ES10 | 10μг | |
| 92566ES08 | 5μг | |
| 92102ES10 | 10μг | |
| 91103ES10 | 10μг | |
| 92711ES10 | 10μг | |
| 92122ES60 | 100μг | |
| 92201ES60 | 100μг | |
| 92275ES20 | 20μг | |
| Человеческий BMP-2 | 92051ES10 | 10μг |
Связанное чтение:
Ссылка
