Med den fördjupade forskningen om organoider ansluter sig ett ökande antal individer. Den här artikeln sammanfattar några vanliga kunskapspunkter om organoider [1-5], i hopp om att vara till hjälp för alla.
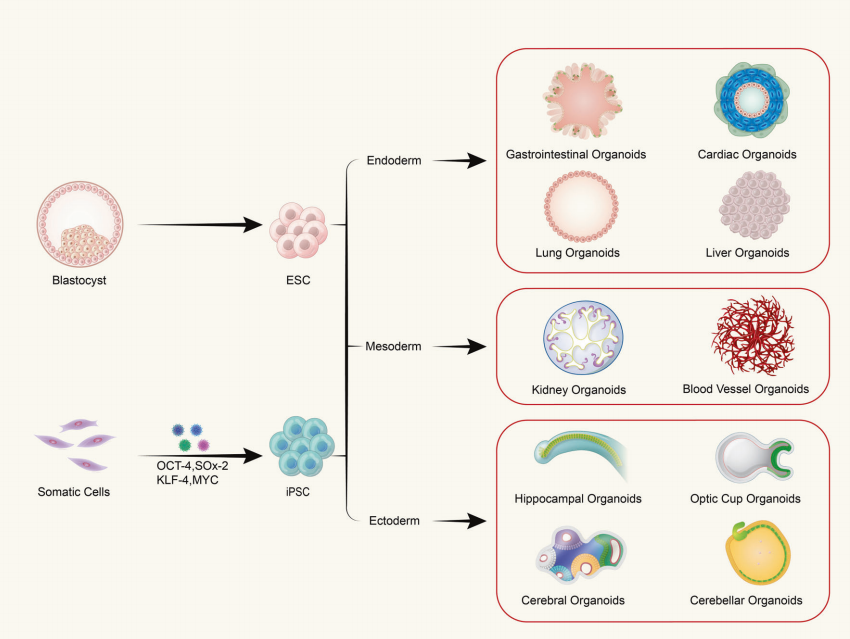
F: Är organoider sammansatta av en enda typ av cell eller flercelliga vävnader?
Organoider bildas från in vitro tredimensionell (3D) odling av vuxna stamceller eller pluripotenta stamceller, vilket resulterar i vävnadsliknande strukturer med en viss rumslig organisation. Organoider är inte strukturer som består av enstaka celler; snarare bildas de genom att inducera delning och differentiering av initierande celler med stamcellsegenskaper, som sedan självbildas till vävnader med en viss rumslig struktur, morfologi och funktionalitet som liknar motsvarande organ in vivo.
F: Vilka är källorna för att odla organoider?
(1) Organoider som härrör från pluripotenta stamceller inkluderar vuxna stamceller (ASC), pluripotenta stamceller (PSC) och inducerade pluripotenta stamceller (iPSC). (2) Organoider som härrör från vävnadsextraherade celler finns vanligtvis i tumörvävnader.
F: Kan fryst vävnad användas för 3D-odling i frånvaro av färsk vävnad?
Ja, men det finns högre krav på storleken på frusen vävnad, och livsdugligheten för primär frusen vävnad och celler kommer att minska avsevärt, vilket leder till en kraftigt minskad framgångsfrekvens i efterföljande odling.
F: Hur fryses och återupplivas organoider?
Den optimala tiden att frysa organoider är vid passagerna 2-5, då organoidernas aktivitet och differentieringspotential är som bäst. Återupplivning av organoider kan följa de metoder som används för cellåterupplivning.
F: Är det nödvändigt att kontrollera storleken på odlade organoider, och är det fördelaktigt om de är för stora?
Ja, det är nödvändigt att kontrollera storleken, helst inom 500μm, eftersom organoider saknar inre kärl- och gas-vätskecirkulationssystem. När storleken på organoider är stor, kämpar celler nära centrum för att utbyta syre och näringsämnen med den yttre miljön. Därför, ju större struktur, desto större antal döda celler.
F: Förutom att använda matrisgel, vad mer kan användas för att odla organoider?
Förutom matrisgel inkluderar alternativ för odling av organoider (1) decellulariserad extracellulär matris och andra härledda proteiner, (2) syntetiska hydrogeler och (3) konstruerade rekombinanta proteingeler.
F: Hur kan riktad differentiering av organoider uppnås?
Den tidiga utvecklingen av stamcellsinducerad differentiering i organoider regleras gemensamt av flera signalvägar. In vitro-odling kräver tillägg av tillväxtfaktorer för att simulera aktiviteten hos dessa signalvägar, vilket leder cellerna att differentiera i specifika riktningar. Till exempel kan induktion med Y27632 och Activin A differentiera embryonala stamceller (ESCs) eller inducerade pluripotenta stamceller (iPSCs) till embryoidkroppar (EBs). Därefter regleras signalvägar av faktorer som Wnt3a, FGF-4 och Noggin för att inducera stamcellsdifferentiering i specifika riktningar.
F: Hur kan kontaminering undvikas när kliniska prover tas?
(1) Säkerställ aseptisk provtagning så mycket som möjligt. (2) Före extraktion, doppa i PBS som innehåller antibiotika i flera minuter: för tumörer som är belägna i områden med potentiell kontakt med den yttre miljön, såsom mage, tarmar och urinblåsa, rekommenderas att nedsänka i PBS som innehåller 3%-5% antibiotika i 5-10 minuter; för andra vanliga tumörer, doppa i PBS innehållande 1%-2% antibiotika i cirka 5 minuter. (3) Alla reagenser som används under cellextraktion bör innehålla 1 % antibiotika och en lämplig koncentration av primära antibiotika.
F: Vilka försiktighetsåtgärder bör vidtas för insamling, konservering och transport av tumörvävnad?
Samla tumörvävnader med hög halt av tumörceller så mycket som möjligt och minimera exponeringstiden för vävnadsprover för luft för att minska sannolikheten för kontaminering. Placera insamlade tumörvävnadsprover i sterila rör som innehåller speciell provkonserveringslösning så snart som möjligt och transportera dem snabbt till testenheten vid låg temperatur (cirka 4°C) (sträva efter att leverera inom 2~4 timmar efter provtagning).
F: Finns det någon skillnad mellan organoider som odlats från lesioner och de som odlats från intilliggande vävnader?
Vilka är kraven för provtagningsställena för tumörvävnad? Ja, det är skillnad. Tumörer själva uppvisar heterogenitet, så det är vanligt att observera skillnader mellan organoider som härrör från olika källor. Morfologiskt tenderar organoider som härrör från primära lesioner att ha en mer invasiv struktur jämfört med de från intilliggande vävnader, som i allmänhet verkar mer oregelbundna. För att minimera fel i modellering eller läkemedelsscreening bör flera prover tas från områden med god aktivitet.
F: Vilka typer av läkemedel kan användas för läkemedelskänslighetstestning av tumörorganoider?
Huvudtyperna av antitumörläkemedel i klinisk praxis kan klassificeras i tre kategorier: cytotoxiska läkemedel (såsom paklitaxel, cisplatin/karboplatin, 5-FU, etc.), riktade läkemedel (läkemedel riktade mot EGFR, HER2, VEGFR, etc.), och immunterapiläkemedel representerade av immunkontrollpunktshämmare, PD-1-antikroppar, etc.1).
F: Hur stor är framgången för odling av SUB?
Framgångsgraden för PDO-odling varierar något beroende på källan. De flesta PDO har en framgångsfrekvens på mellan 63 % och 70 %, eller till och med högre, upp till 90 %, vilket till stor del är korrelerat med själva vävnadens aktivitet. Dessutom kan kliniska behandlingar påverka framgångsfrekvensen. Framgångsfrekvensen kan förbättras genom att minska tiden för vävnad ex vivo och operationssteg.
F: Kan frusen vävnad användas för organoidodling?
I allmänhet rekommenderas inte kryokonservering av vävnader på grund av betydande förlust av viabilitet. Men om vävnader förvaras vid -80°C är det optimala fönstret för organoidodling inom 6 veckor efter konservering. Om vävnader lagras i flytande kväve kan konserveringstiden vara längre men helst inte överstiga sex månader.
F: När man extraherar primära celler är det vanligtvis fibroblaster inblandade. Hur ska de hanteras?
(1) På grund av den dåliga vidhäftningen av fibroblaster kan de avlägsnas genom upprepad vidhäftning.(2) Reagens för avlägsnande av fibroblaster kan användas, men om de påverkar organoidodling behöver experimentell validering.
F: Hur mycket ursprunglig tumörvävnad behövs för att odla tumörorganoider? Är biopsiprovet tillräckligt?
Generellt bör kirurgiska vävnader vara större än storleken på 2-3 sojabönor; om de erhålls via nålbiopsi krävs minst 2-3 prover, medan endoskopiska biopsier kräver att minst sex eller fler tumörvävnader kläms fast.
F: Om provet av tumörvävnad är för litet och antalet odlade organoider är otillräckligt för efterföljande testning, vad ska man göra?
Eftersom organoider som härrör från tumörkällor kan uppvisa fenotypiska skillnader efter passage, rekommenderas i allmänhet inte passage. Det rekommenderas i litteraturen att begränsa passagen av organoider till 2-3 generationer, med maximalt 5 generationer. Om cellantalet är för litet och inte kan uppfylla testkraven efter 5 generationer, överväg att ändra testmetoden, som att använda en mindre platta med 384 brunnar eller prova mikrofluidchip för testning.
F: Kommer det att finnas normala celler i tumörvävnad? Hur tar man bort dessa normala celler?
Det kan finnas ett litet antal normala celler. Först och främst, försök att undvika provtagning av normal vävnad under insamlingen. För det andra, efter extrahering av primära celler, kan magnetisk pärlsortering eller flödescytometri användas för ytterligare organoidodling. När ett mycket litet antal normala celler är närvarande påverkar det inte nämnvärt efterföljande organoidmodellering och odling, så avlägsnande kanske inte är nödvändigt.
F: När man extraherar primära celler från tumörvävnader, varför ser cellerna röda ut?
Vävnader är rika på blodtillförsel in vivo, så det finns många röda blodkroppar. I de flesta fall kräver detta ingen bearbetning och påverkar inte organoid odling. Om det finns för många röda blodkroppar kan de på lämpligt sätt behandlas med lyseringsbuffert före odling.
F: Under organoidodling hittas svarta partiklar. Hur tar man bort dem?
Svarta partiklar är troligen föroreningar eller cellskräp. De kan tas bort på två sätt:
Smält organoiderna och tvätta dem upprepade gånger med medium för att späda ut orenheterna.
Använd en steril kirurgisk kniv för att skära organoiderna på mitten, använd sedan en 1ml spruta fylld med medium för att försiktigt spola bort orenheter från organoiderna.
F: Finns det en gräns för antalet passager för organoidodling, och hur många passager kan genomföras?
Antalet passager beror i allmänhet på källcellernas egenskaper. De flesta organoider kan passera in vitro i upp till 10 gånger (>6 månader). Valet av odlingsbetingelser kan också ha viss inverkan, med konditionerat medium generellt överlägset syntetiskt faktormedium.
F: Kan tumörcellinjer (som HepG2-cellinjen) odlas till PDO?
PDO är komplexa självmonterade strukturer. 3D-odlingssystem som bildas av enstaka cellinjer kan inte kallas PDO; de kallas helt enkelt sfäriska 3D-tillstånd.
F: Vilka är kriterierna för passage av organoider?
Beroende på organoidernas utvecklingsstatus varierar tiden, vanligtvis mellan 5-10 dagar, med en diameter på ca 100-200μm. Vissa långsamt utvecklande organoider kan ta flera veckor innan de når ett passande tillstånd.
F: Hur räknar man antalet livsdugliga organoider?
Under experimentet, ta ut den förberedda Calcein-AM-lagringslösningen och tillsätt Calcein-AM-lösningen till mediet till en slutlig koncentration av 0,2μmol/L. Inkubera vid 37°C i 60 minuter. Efter att tiden har gått, skölj långsamt bort det Calcein-AM-innehållande mediet med PBS och tillsätt färskt medium. Använd ett fluorescensmikroskop med en excitationsvåglängd på 490 nm och en emissionsvåglängd på 515 nm för att observera och fotografera organoiderna. Levande organoider kommer att se gröna ut och ha tydliga kanter. Räkna organoiderna med en diameter >20μm.
F: Hur beräknar man livsdugligheten för organoider?
Viabiliteten för organoider beräknas enligt formeln: X=(Nive/Ntotal)×100%, där: X representerar viabiliteten för organoider; Nlive representerar antalet levande organoider; Ntotal representerar det totala antalet organoider.
F: Vilka är metoderna för att identifiera organoider?
Den mest grundläggande metoden är att observera organoidernas morfologi genom ett mikroskop och utföra H&E-färgning. Ytterligare metoder inkluderar Western Blot, qRT-PCR, immunfluorescens, flödescytometri för att detektera om organoiderna uttrycker motsvarande biomarkörer. Genetisk sekvensering kan identifiera den genetiska matchningen mellan de odlade organoiderna och källvävnaden. För vissa organoider kan funktionella tester utföras för att se om de har specifika funktioner. Till exempel har studier visat att magorganoider kan utsöndra magsyra, och hjärtorganoider kan slå autonomt.
F: Kan normala celler också växa till organoider? Hur tar man bort normala organoider under odling av tumörorganoider?
Normala celler kan också växa till organoider. Metoder för att avlägsna normala organoider inkluderar: (1) Manuellt val baserat på HE-färgningsresultat under ett mikroskop; (2) Rening av PDO:er genom att justera sammansättningen av odlingsmediet (såsom tillväxtfaktorer/hämmare av små molekyler); (3) Dispergering av PDO i enstaka celler för flödescytometri eller magnetisk pärlsortering.
F: Under läkemedelskänslighetsexperiment, bör PDO smältas från matrisgelen?
Nej, PDO behöver en tredimensionell struktur för att simulera in vivo-förhållanden. Om det inte finns något stöd från matrisgelen kommer noggrannheten i läkemedelskänslighetsexperiment att påverkas. I allmänhet kan lösliga läkemedel penetrera matrisgelen för att verka på organoider, men när man utför immuncytokemiska experiment är det nödvändigt att avlägsna matrisgelen.
F: Kan SUB-experiment helt ersätta djurmodeller (PDX)?
PDO kan delvis ersätta PDX, men kan inte helt ersätta dem.
F: Vilka kan orsakerna vara till onormal tillväxt av PDO under odling, kännetecknad av förkortade tillväxtcykler och snabb spridning jämfört med tidigare förhållanden?
Externa faktorer: (1) Denna abnormitet kan orsakas av omfattande tillväxt av vissa kontaminerande celler, såsom fibroblaster. I sådana fall rekommenderas det att utföra snittfärgning och observation för att bekräfta närvaron av dessa kontaminerade celler och sedan fortsätta med att ta bort dem. (2) Förändringar i odlingsförhållandena, inklusive tillägg av vissa faktorer eller små molekyler, kan ytterligare aktivera proliferationsvägarna för PDO.
Interna faktorer: Möjliga genetiska mutationer. För att verifiera detta rekommenderas sekvensering, och resultaten bör jämföras med de för de primära PDO:erna för att avgöra om det finns några genetiska mutationer.
F: Hur kan PDO:s känslighet för läkemedel testas?
PDO kan testas för läkemedelskänslighet med metoder som CCK8-analys, ATP-cellviabilitetsanalys och färgning av levande/döda. Att bedöma ATP-aktiviteten hos tumörorganoider är den vanligaste metoden. ATP är den viktigaste energimolekylen i celler och kan användas för att mäta cellulära metaboliska nivåer, vilket återspeglar antalet livskraftiga celler. Baserat på effekten av läkemedelsadministrering på cellulärt ATP-innehåll, kan IC50-värdet (halvmaximal hämmande koncentration av det testade läkemedlet) för varje läkemedelsbehandling beräknas med hjälp av analysmjukvara för att välja de mest effektiva läkemedlen för tumörhämning.
F: Är koncentrationsintervallen för läkemedelskänslighetsexperiment av PDO samma som för primära tumörceller?
Nej, de är inte likadana. Vanligtvis måste läkemedelskoncentrationen för PDO vara högre än för primära celler. Preliminära experiment kan utföras för att analysera de optimala koncentrationerna för formella läkemedelskänslighetsexperiment.
F: Vid vilket tillväxtstadium bör organoider användas för drogtester?
Det rekommenderas i allmänhet att använda organoider inom 5 passager för drogtester. I detta skede uppvisar organoider den bästa stabiliteten och aktiviteten.
F: Vilka är kriterierna för att bestämma framgången för organoid etablering?
(1) Tidig preliminär bedömning: Organoid morfologi förändras från ett cellulärt tillstånd till former som vakuolär, knoppande, kompakt eller lös. (2) Identifiering av specifika biomarköruttryck, som bör likna fördelningen i vävnadsskivor. Ytterligare sekvensanalys kan utföras för mer detaljerade jämförelser.
F: Hur skiljer sig organoidodling från vanlig cellodling?
(1) Olika cellodlingsmetoder: Organoider kräver stöd av substrat eller rumsliga strukturer för att behålla sin tredimensionella struktur, medan vanlig cellodling inte kräver detta. (2) Organoid kultur kräver att man uppnår ex vivo differentiering och självmontering, vilket kräver användning av kombinationer av olika cytokiner för induktion, vilket resulterar i relativt komplexa odlingsmediumkomponenter. Vanlig cellodling involverar vanligtvis bara en enda typ av cell, så odlingsmediets komponenter är relativt enkla.(3) Olika cellkällor: Organoider härrör från multipotenta epitelceller, medan vanlig cellkultur är lämplig för att odla olika typer av utvalda celler.
F: Hur kan jag avgöra om 3D-sfärerna jag odlade är organoider och om de överensstämmer med målvävnaden?
Metoder för att identifiera organoider inkluderar H&E-färgning, immunhistokemi (IHC), encellssekvensering och andra. Det är nödvändigt att göra flerdimensionella bedömningar från morfologiska, histopatologiska och molekylärgenetiska perspektiv för att avgöra om de är förenliga med målorganet eller vävnaden. För tumörorganoider kan detektion av specifika biomarkörer användas för bekräftelse.
F: Om morfologin hos organoiderna som observeras under odlingen skiljer sig från vad som rapporteras i litteraturen, vad kan det bero på?
För det första kan individuella skillnader och heterogenitet i provkällor och subtyper existera. För det andra kan skillnader i kvaliteten på utvalda cytokiner och vissa småmolekylära inhibitorer som används för induktion leda till variationer i differentieringsmorfologin för olika organoider. Det föreslås att bekräfta överensstämmelsen mellan organoid morfologi och källvävnad genom metoder som HE-färgning, IHC och genetisk sekvensering, snarare än att enbart förlita sig på litteraturbeskrivningar.
F: När man genomför läkemedelskänslighetsexperiment med organoider, är det nödvändigt att kontrollera mängden DMSO som används som lösningsmedel för läkemedel?
Ja, vanligtvis kräver läkemedelskänslighetsexperiment att volymprocenten av DMSO är mindre än 0,5 %.
F: Hur kan organoider återvinnas från matrisgelen?
Följande metoder rekommenderas: (1) Kommersiellt tillgängliga organoidåtervinningslösningar (CAT#41421ES) kan användas för att varsamt och effektivt erhålla cellsuspensioner utan att skada celler eller cellytproteiner. (2) Matrisgelen kan tinas vid låg temperatur för att mjuka upp den och frigöra organoiderna.
F: Många organoider fäster vid centrifugrörets väggar under återhämtning. Hur kan återvinningsgraden förbättras?
Vid centrifugering efter uppsamling, använd en horisontell rotorcentrifug och öka centrifugeringshastigheten på lämpligt sätt. I allmänhet är en centrifugalkraft på cirka 300 g och en hastighet av cirka 1000-1200 rpm lämpliga.
Besläktade cytokiner information
| Pprodukt Name | KATT | Storlek |
| Human Wnt-3a | 92276ES10 | 10μg |
| 92278ES20 | 20μg | |
| 92701ES10 | 10μg | |
| Mänsklig Noggin | 92528ES10 | 10μg |
| 91330ES10 | 10μg | |
| 91306ES10 | 10μg | |
| 91502ES10 | 10μg | |
| 91701ES08 | 10μg | |
| 92602ES60 | 100μg | |
| 91204ES10 | 10μg | |
| 90601ES10 | 10μg | |
| 91113ES10 | 10μg | |
| 92279ES10 | 10μg | |
| 92055ES10 | 10μg | |
| 92053ES10 | 10μg | |
| 92129ES08 | 5μg | |
| 91304ES10 | 10μg | |
| 91702ES10 | 10μg | |
| 92252ES60 | 100μg | |
| 90103ES10 | 10μg | |
| 90104ES10 | 10μg | |
| 90197ES10 | 10μg | |
| 90144ES08 | 10μg | |
| 90196ES10 | 10μg | |
| 90194ES10 | 10μg | |
| 90111ES10 | 10μg | |
| 90120ES10 | 10μg | |
| 90198ES10 | 10μg | |
| 91605ES10 | 10μg | |
| 92251ES10 | 10μg | |
| 92566ES08 | 5μg | |
| 92102ES10 | 10μg | |
| 91103ES10 | 10μg | |
| 92711ES10 | 10μg | |
| 92122ES60 | 100μg | |
| 92201ES60 | 100μg | |
| 92275ES20 | 20μg | |
| Human BMP-2 | 92051ES10 | 10μg |
Relaterad läsning:
Hänvisning
