ความก้าวหน้าอย่างรวดเร็วของเทคโนโลยีชีวภาพส่งผลกระทบอย่างมากต่อการต่อสู้กับโรคติดเชื้อ เช่น COVID-19 ผ่านการสร้างวัคซีน mRNA ที่ผลิตโดยใช้เทคโนโลยีการสังเคราะห์ RNA ในหลอดทดลอง บริษัทจำนวนมาก เช่น Moderna ในสหรัฐอเมริกา CureVac ในเยอรมนี และ BioNTech ในเยอรมนี ไม่เพียงแต่พัฒนาวัคซีน mRNA ที่ใช้ในการรักษาเท่านั้น แต่ยังพัฒนาการรักษาโรคต่างๆ เช่น เนื้องอก โรคติดเชื้อ และโรคเรื้อรังอีกด้วย
การวิจัยและการกำหนดสูตรวัคซีน mRNA จำเป็นต้องใช้สารตั้งต้นที่หลากหลายเพื่อให้มั่นใจว่าการพัฒนาจะประสบความสำเร็จ ในฐานะผู้บุกเบิกในอุตสาหกรรมเอนไซม์ระดับโมเลกุล
เพื่อรับประกันทั้งคุณภาพสินค้าและความสามารถในการผลิต
1.ข้อดีของ GMP
2.
3.
4. สถานการณ์การใช้งานของ
5. วัตถุดิบสำหรับการเตรียมวัคซีน mRNA จัดทำโดย
6. ข้อมูลการสั่งซื้อ
1.ข้อดีของ GMP
“เกรด GMP” เป็นคำเรียกแบรนด์ที่
ตารางที่ 1. ข้อดีของ GMP
| การควบคุมคุณภาพ | ระดับการวิจัย | เกรด GMP |
| ฟรีสัตว์ | อาจใช้วัสดุที่ได้จากสัตว์ได้ | สามารถให้ใบรับรองปลอดสัตว์ได้หากจำเป็น |
| ลักษณะเฉพาะของธนาคารเซลล์ | เข้มงวดน้อยลง | เข้มงวด (สอดคล้องกับข้อกำหนด GMP) |
| ข้อมูลการตรวจสอบย้อนกลับสำหรับวัตถุดิบและผลิตภัณฑ์สำเร็จรูป | เข้มงวดน้อยลง | เข้มงวด (สอดคล้องกับข้อกำหนด GMP) |
| การควบคุมระดับเอนโดทอกซิน | - | เข้มงวด |
| การควบคุมการฆ่าเชื้อ | - | เข้มงวด |
| บันทึกแบตช์สำหรับการผลิตและการทดสอบ | เข้มงวดน้อยลง | เข้มงวด (สามารถให้บันทึกชุดได้หากจำเป็น) |
| รายงานการตรวจสอบกระบวนการ | - | สามารถจัดทำรายงานได้หากจำเป็น |
| ระบบควบคุมการเปลี่ยนแปลง | การประเมินตนเอง | เข้มงวด (สอดคล้องกับข้อกำหนด GMP) |
| ระบบการจัดการคุณภาพ | การประเมินตนเอง | การรับรองมาตรฐาน ISO 13485 |
| หมายเลข DMF | - | ใช่ (การรายงาน) |
2. Yeasen สามารถจัดหาผลิตภัณฑ์ระดับ GMP ได้
การใช้ประโยชน์จากความเชี่ยวชาญอันกว้างขวางและความเป็นเลิศทางเทคนิคในการพัฒนาเอนไซม์และการผลิตในระดับอุตสาหกรรม
3. Yeasen ได้รับหมายเลข DMF สำหรับผลิตภัณฑ์ต่างๆ มากมาย
เอกสารข้อมูลยาหลัก (DMF) คือเอกสารลับที่ส่งไปยังสำนักงานคณะกรรมการอาหารและยาแห่งสหรัฐอเมริกา (FDA) โดยสมัครใจ เอกสารดังกล่าวมีข้อมูลโดยละเอียดเกี่ยวกับสิ่งอำนวยความสะดวก กระบวนการ หรือสิ่งของที่ใช้ในกระบวนการผลิต การแปรรูป การบรรจุ และการจัดเก็บผลิตภัณฑ์ยาสำหรับมนุษย์
สำนักงานคณะกรรมการอาหารและยา (FDA) ตรวจสอบเนื้อหาทางเทคนิคของ DMF เมื่อผู้ผลิตส่วนประกอบยาที่มีฤทธิ์ (API) อ้างอิงถึงส่วนประกอบดังกล่าวเพื่อสนับสนุนการยื่นขออนุมัติยาใหม่เพื่อการสืบสวน (IND) การยื่นขออนุมัติยาใหม่ (NDA) การยื่นขออนุมัติยาใหม่แบบย่อ (ANDA) หรือคำขออนุมัติการส่งออก DMF มีบทบาทสำคัญในการยื่นขออนุมัติเหล่านี้เมื่อผู้ผลิตยื่น DMF สำหรับวัสดุเฉพาะ กระบวนการอนุมัติของ FDA สามารถรวดเร็วขึ้นได้อย่างมาก
4. สถานการณ์การใช้งานของ Yeasen สินค้า
4.1 การสร้างเทมเพลต
การสร้างเส้นพลาสมิดให้เป็นเส้นตรงเป็นขั้นตอนที่ขาดไม่ได้ในระหว่างการสร้างเทมเพลตเมื่อเวกเตอร์พลาสมิดถูกใช้เป็นเทมเพลตการถอดรหัส ในขณะที่การถอดรหัสดำเนินไปจนถึงจุดสิ้นสุดของเทมเพลต DNA การสร้างเส้นพลาสมิดให้เป็นเส้นตรงจะช่วยให้มั่นใจได้ว่าจะสร้างทรานสคริปต์ RNA ที่มีความยาวและลำดับที่กำหนด
4.2 ในหลอดทดลอง การถอดความ (IVT)
การถอดรหัสในหลอดทดลองได้รับผลกระทบจากปัจจัยต่างๆ เอนไซม์ บัฟเฟอร์ และสารตั้งต้นที่ได้รับการดัดแปลง ล้วนส่งผลอย่างมากต่อประสิทธิภาพการถอดรหัส
บนพื้นฐานของแพลตฟอร์ม ZymeEditor

การปรับปรุงบัฟเฟอร์และปรับประเภทเกลือของสารตั้งต้นนิวคลีโอไทด์ทำให้เราสามารถปรับปรุงประสิทธิภาพการถอดรหัสและลดการผลิต dsRNA ได้อย่างมาก

รูปที่ 2 Tris NTP สามารถเพิ่มประสิทธิภาพของ lVT ได้อย่างมากและลดการผลิต dsRNA
4.3 การปิดฝา mRNA
เนื่องจากโครงสร้างแคป 5' ช่วยลดภูมิคุ้มกันและจำเป็นต่อการแปล mRNA อย่างมีประสิทธิภาพ จึงจำเป็นต้องเพิ่มโครงสร้างแคปที่ปลาย 5' ของ mRNA ที่สร้างขึ้นโดยการถอดรหัส
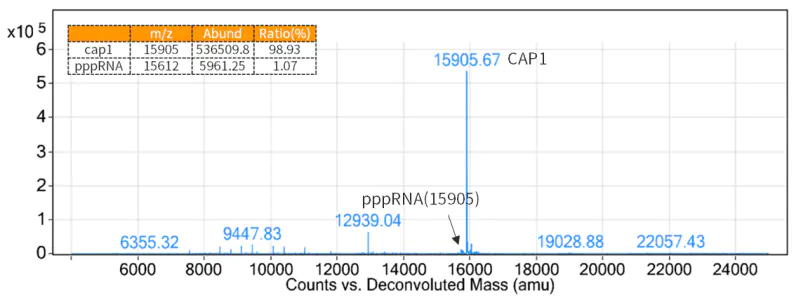
รูปที่ 3 ผลการตรวจจับอัตราแคป (การตรวจจับ LC-MS)
4.4 การทำให้บริสุทธิ์ของ mRNA
การทำให้บริสุทธิ์เป็นขั้นตอนที่ขาดไม่ได้ในการบรรลุ mRNA ที่มีความบริสุทธิ์สูง
5. วัตถุดิบสำหรับการเตรียมวัคซีน mRNA จัดทำโดย Yeasen
ในปัจจุบันนี้
ตารางที่ 2.วัตถุดิบสำหรับการเตรียมวัคซีน mRNA จัดทำโดย
| การเตรียมเทมเพลต | การถอดรหัสในหลอดทดลอง | ||
| 2× Hieff Canace Advance มาสเตอร์มิกซ์ PCR ความเร็วสูงแบบรวดเร็ว | 10164ES | 10623ES | |
| 10122ES | 10625ES | ||
| 10922ES | 10672ES | ||
| 10300ES | 10621ES | ||
|
| 10611ES | ||
| 10661ES | 10133ES | ||
| RNAse R (20U/uL) | 14615ES | 10650ES | |
| เอ็กซ์บีเอ ฉัน | 10662ES | 10651ES | |
| การปิดฝา |
| การชำระล้าง |
|
| 10614ES | 12602ES | ||
| 10612ES | ชั้นวางแยกแม่เหล็ก | 80460ES | |
| 10619ES | 36717ES | ||
| 10681ES |
| ||
6. ข้อมูลการสั่งซื้อ
ต่อไปนี้เป็นผลิตภัณฑ์ตัวแทนที่นำเสนอโดย
ตารางที่ 3 ข้อมูลการสั่งซื้อ
ในส่วนของการอ่าน:
สารเคมีเกรด GMP สำหรับการสังเคราะห์ mRNA ในหลอดทดลอง
DNase I และการประยุกต์ใช้ในชีวการแพทย์
อ้างอิง:
[1] Chaudhary, N., Weissman, D., & Whitehead, KA (2021). วัคซีน mRNA สำหรับโรคติดเชื้อ: หลักการ การส่งมอบ และการแปลทางคลินิก รีวิวธรรมชาติ การค้นพบยา 20(11), 817–838.
[2] Vogel, AB et al. วัคซีน RNA ที่ขยายตัวเองให้การป้องกันไข้หวัดใหญ่ได้เทียบเท่ากับวัคซีน mRNA แต่
ในปริมาณที่ต่ำกว่ามาก การบำบัดด้วยโมเลกุล: วารสารของ American Society of Gene Therapy 26, 446-455
[3] Fuchs, AL, Neu, A. & Sprangers, R. วิธีทั่วไปสำหรับการผลิต 5' ในปริมาณมากอย่างรวดเร็วและคุ้มต้นทุน
RNA ที่ปิดฝา RNA (New York, NY) 22, 1454-1466, doi:10.1261/rna.056614.116 (2016)
[4] ชมิด, เอ.ข้อควรพิจารณาในการผลิตวัคซีน mRNA สำหรับการทดลองทางคลินิก วิธีการในชีววิทยาโมเลกุล (คลิฟตัน นิวเจอร์ซีย์) 1499, 237-251
[5] Banerji, A. et al. วัคซีน mRNA เพื่อป้องกันโรค COVID-19 และรายงานอาการแพ้: หลักฐานปัจจุบันและแนวทางที่แนะนำ วารสารโรคภูมิแพ้และภูมิคุ้มกันทางคลินิก ในทางปฏิบัติ 9, 1423-1437
[6] Richner, JM et al. วัคซีน mRNA ดัดแปลงป้องกันการติดเชื้อไวรัสซิกา Cell 168, 1114-1125.e1110,
[7] Corbett, KS et al. การออกแบบวัคซีน mRNA ของ SARS-CoV-2 ทำได้โดยการเตรียมการของเชื้อก่อโรคต้นแบบ Nature 586,567-571,
[8] Corbett, KS et al. mRNA-1273 ปกป้องการติดเชื้อเบต้า SARS-CoV-2 ในไพรเมตที่ไม่ใช่มนุษย์ Nature immunology 22, 1306-1315,
[9] Keech, C. et al. การทดลองระยะที่ 1-2 ของวัคซีนอนุภาคนาโนโปรตีนสไปก์รีคอมบิแนนต์ SARS-CoV-2 วารสารการแพทย์นิวอิงแลนด์ 383, 2320-2332,
[10] Kramps, T. & Elbers, K. Introduction to RNA Vaccines. Methods in molecular biology (Clifton, NJ) 1499, 1-11,
[11] Linares-Fernández, S., Lacroix, C., Exposito, JY & Verrier, B. การปรับแต่งวัคซีน mRNA เพื่อสร้างสมดุลให้กับการตอบสนองภูมิคุ้มกันโดยกำเนิด/ปรับตัว แนวโน้มในการแพทย์ระดับโมเลกุล 26, 311-323
