Phải làm gì khi kết quả qPCR bất thường?
Các thí nghiệm qPCR có thể dễ dàng và đôi khi khó khăn. Sau khi thiết kế mồi hoàn tất, các mẫu qPCR được thêm từng bước như PCR và thí nghiệm có thể được hoàn thành trên máy. Có một số vấn đề phổ biến trong các thí nghiệm qPCR theo phương pháp nhuộm và với các nguyên nhân và giải pháp có thể, chúng tôi hy vọng bạn có thể sử dụng chúng để giải quyết các rắc rối trong các thí nghiệm qPCR.
1. qPCR là gì?
2. Đường cong khuếch đại qPCR bất thường
3. Đường cong nóng chảy qPCR bất thường
4. Thông tin đặt hàng
5. Sản phẩm liên quan
6. Về việc đọc
1. qPCR là gì?
Kể từ khi kỹ thuật phản ứng chuỗi polymerase (PCR) được phát minh, PCR có lẽ là kỹ thuật được sử dụng rộng rãi nhất trong sinh học phân tử do tính đơn giản, rẻ tiền, độ tin cậy, nhanh chóng và độ nhạy cao. qPCR là một công nghệ được phát triển bởi công nghệ PCR. Trong quá trình khuếch đại DNA, phương pháp phát hiện tổng lượng sản phẩm sau mỗi chu kỳ PCR bằng thuốc nhuộm huỳnh quang không chỉ có tốc độ và độ nhạy của PCR mà còn có độ đặc hiệu cao hơn và theo dõi thời gian thực, định lượng lặp lại và chính xác, cùng nhiều ưu điểm khác. qPCR là công nghệ sử dụng thiết bị khuếch đại PCR định lượng thời gian thực, cụ thể là thiết bị qPCR, để theo dõi các sản phẩm khuếch đại axit nucleic theo thời gian thực trong quá trình PCR. qPCR thực hiện phân tích định lượng khuôn mẫu ban đầu thông qua phân tích giá trị Ct và đường cong chuẩn. Năm 1992, Higuchi người Nhật Bản lần đầu tiên đề xuất "công nghệ PCR định lượng huỳnh quang thời gian thực". Năm 1996, Công ty Sinh học Hoa Kỳ đã cho ra mắt thiết bị PCR định lượng huỳnh quang đầu tiên trên thế giới, bao gồm hệ thống chu trình nhiệt khuếch đại PCR, hệ thống quang học phát hiện huỳnh quang và phần mềm máy tính và ứng dụng. Nó có thể theo dõi các sản phẩm khuếch đại axit nucleic theo thời gian thực thông qua thuốc nhuộm huỳnh quang hoặc đầu dò huỳnh quang. , thông qua mối quan hệ hàm toán học, kết hợp với phần mềm để phân tích kết quả, tính toán lượng mẫu ban đầu của mẫu cần thử nghiệm được thực hiện. Do đó, công nghệ PCR định lượng huỳnh quang thời gian thực đã được sử dụng rộng rãi. Các phương pháp đánh dấu huỳnh quang cho qPCR được chia thành phương pháp khảm thuốc nhuộm huỳnh quang dựa trên phương pháp thuốc nhuộm SYBR Green I, phương pháp đầu dò huỳnh quang dựa trên phương pháp đầu dò Taqman (Cycling Probe, Molecular Bracon, v.v.), phương pháp mồi thuốc nhuộm dập tắt.
Các thí nghiệm qPCR có thể dễ dàng và đôi khi khó khăn. Sau khi thiết kế mồi hoàn tất, các mẫu qPCR được thêm từng bước giống như PCR và thí nghiệm có thể được hoàn thành trên máy. Tuy nhiên, nhiều chi tiết nhỏ cần chú ý, chẳng hạn như không có chất lỏng treo trên thành ống, không có bong bóng trong ống và cần giảm thiểu tiếp xúc trực tiếp giữa thành ống, nắp ống, v.v., để giảm lỗi thí nghiệm hoặc kết quả thí nghiệm lạ. Xiaoyi đã tổng hợp một số vấn đề thường gặp trong các thí nghiệm qPCR theo phương pháp nhuộm và đưa ra các nguyên nhân và giải pháp có thể, chúng tôi hy vọng bạn có thể sử dụng để giải quyết các rắc rối trong các thí nghiệm qPCR.
2. Đường cong khuếch đại qPCR bất thường
2.1 Bất thường trong pha cơ sở của biểu đồ logarit của đường cong khuếch đại
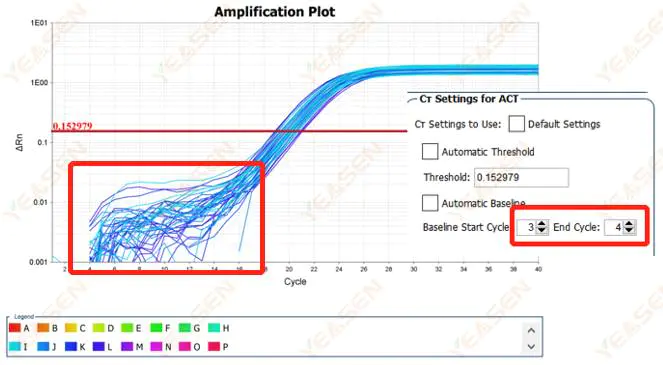
Hình 1. Biểu đồ khuếch đại
Nguyên nhân có thể:
Thiết lập đường cơ sở không đúng.
Giải pháp:
Nên tăng giá trị điểm cuối của đường cơ sở.Sơ đồ điều chỉnh mẫu như sau.

Hình 2. Biểu đồ khuếch đại
2.2 Đường cong khuếch đại logarit phân đoạn đường cong
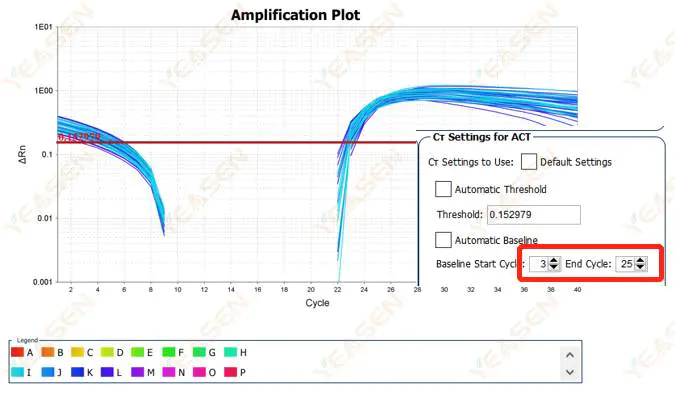
Hình 3. Biểu đồ khuếch đại
Nguyên nhân có thể:
Đường cơ sở được đặt quá cao.
Giải pháp:
Nên giảm giá trị điểm cuối của đường cơ sở. Sơ đồ ví dụ điều chỉnh như sau.
2.3 Biểu đồ tuyến tính đường cong khuếch đại không trơn tru
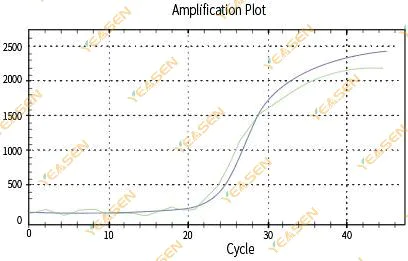
Hình 4. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Ống phản ứng PCR không được đậy kín nên dung dịch phản ứng bị rò rỉ.
2) Dung dịch phản ứng PCR có tường treo.
3) Thiết bị không được hiệu chuẩn (bao gồm hiệu chuẩn tự động hoặc hiệu chuẩn ROX).
4) Hệ thống có nhiều chất ức chế, dẫn đến huỳnh quang không ổn định.
5) Sử dụng thiết bị quá nhiều sẽ dẫn đến việc thu thập huỳnh quang không ổn định.
Giải pháp:
1) Nhấn chặt nắp ống.
2) Trộn đều thuốc thử và cẩn thận đổ vào dụng cụ định lượng sau khi ly tâm hoàn toàn.
3) Hiệu chỉnh thiết bị.
4) Cải thiện độ tinh khiết của RNA và lựa chọn thuốc thử phiên mã ngược thích hợp.
2.4 Đồ thị tuyến tính đường cong khuếch đại ngoằn ngoèo tại một cao nguyên
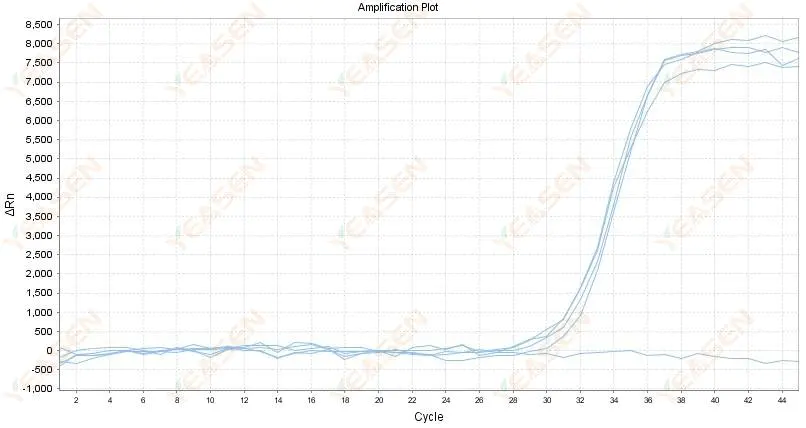
Hình 5. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Độ tinh khiết của RNA kém và có nhiều tạp chất.
2) Nhạc cụ được sử dụng quá lâu.
Giải pháp:
1) Chiết xuất lại RNA chất lượng cao.
2) Pha loãng mẫu RNA để giảm nồng độ tạp chất.
3) Hiệu chỉnh dụng cụ.
2.5 Biểu đồ tuyến tính của đường cong khuếch đại không đạt đến điểm cao nguyên
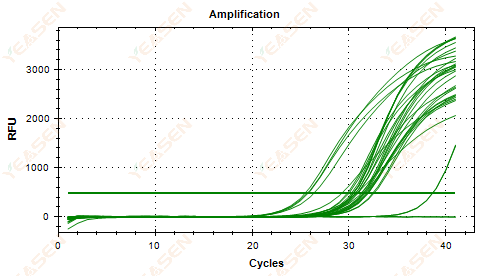
Hình 6. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Nồng độ mẫu thấp (giá trị Ct khoảng 35).
2) Quá ít chu kỳ khuếch đại.
3) Hiệu suất khuếch đại thuốc thử thấp (Ct nhỏ, nhưng cũng không thể đạt đến mức ổn định).
Giải pháp:
1) Tăng nồng độ của mẫu.
2) Tăng số chu kỳ.
3) Tăng Mg2+ sự tập trung.
2.6 Đường cong khuếch đại tuyến tính đồ thị cao nguyên võng xuống
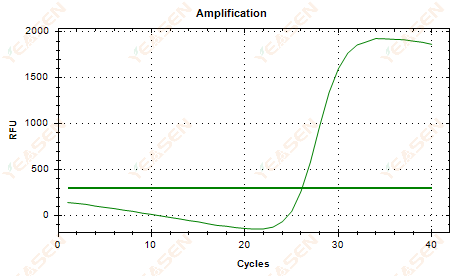
Hình 7. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Sự hiện diện của sự suy thoái (suy thoái sản phẩm khuếch đại, suy thoái SYBR).
2) Nắp ống không được đậy kín và thuốc thử bị bay hơi.
3) Nồng độ cDNA quá cao (nếu giá trị Ct quá nhỏ, ngưỡng huỳnh quang bị kéo cao và tình trạng chảy xệ trở nên nghiêm trọng hơn).
4) Có bọt khí trong ống, sau đó chúng biến mất.
Giải pháp:
1) Cải thiện độ tinh khiết của hệ thống.
2) Giảm lượng cDNA (khuôn mẫu pha loãng).
3) Giảm giá trị điểm cuối của đường cơ sở.
2.7 Giá trị lớn của Ct trong đường cong khuếch đại
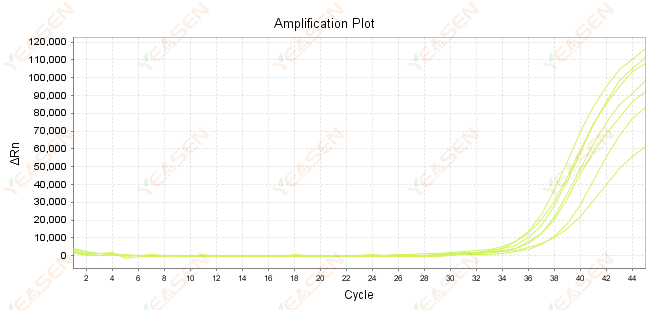
Hình 8. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Số lượng mẫu ít.
2) Hiệu suất khuếch đại thấp.
3) Đoạn PCR quá dài.
4) Sự có mặt của chất ức chế trong hệ thống phản ứng.
Giải pháp:
1) Giảm thời gian pha loãng hoặc tăng lượng mẫu sao cho giá trị Ct nằm trong khoảng từ 15 đến 30 càng nhiều càng tốt.
2) Tối ưu hóa các điều kiện phản ứng, thử quy trình khuếch đại ba bước hoặc thiết kế lại các đoạn mồi.
3) Chiều dài sản phẩm PCR được thiết kế trong khoảng 100 -150 bp, không khuyến nghị vượt quá 300 bp.
4) Tái tạo các mẫu có độ tinh khiết cao hơn.
2.8 Độ lặp lại kém của đường cong khuếch đại
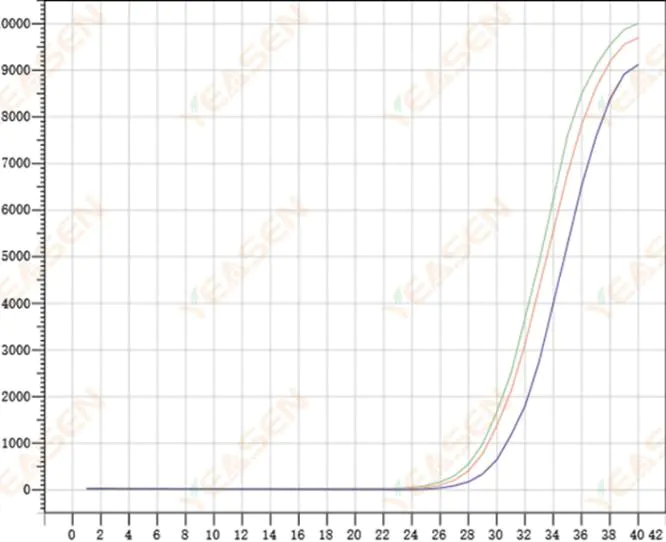
Hình 9. Biểu đồ khuếch đại
Nguyên nhân có thể:
1) Lỗi đột biến lớn.
2) Thuốc thử và hệ thống không được trộn đều.
3) Số lượng bản sao cDNA thấp.
4) Không sử dụng hiệu chuẩn Rox.
Giải pháp:
1) Hiệu chuẩn pipet.
2) Trộn đều hệ thống phản ứng.
3) Nồng độ mẫu thấp, khả năng lặp lại kém, 4-6 lỗ hợp chất và độ lệch 1-2 giá trị lớn hơn có thể được loại bỏ một cách thích hợp.
4) Tốt nhất là sử dụng hiệu chuẩn Rox. Nếu thuốc thử được sử dụng không chứa Rox, thuốc nhuộm tham chiếu cần được chọn là Không.
2.9 Đường cong khuếch đại ngẫu nhiên
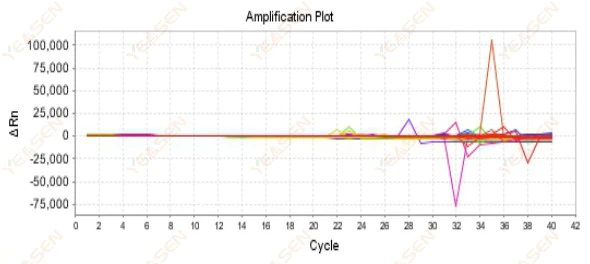
Hình 10. Biểu đồ khuếch đại
Nguyên nhân có thể:
Sự không phù hợp giữa nồng độ Rox và mô hình.
Giải pháp:
Thay đổi cài đặt thuốc nhuộm tham chiếu trên thiết bị từ ROX thành NONE và xem đường cong khuếch đại có trở lại bình thường không.
2.10 Đỉnh NTC
2.10.1 Ct>35, giá trị Tm đường cong nóng chảy <80℃
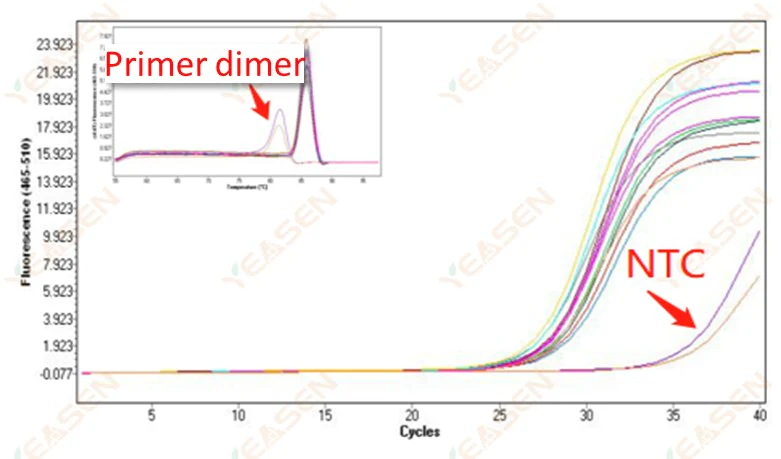
Hình 11. Biểu đồ khuếch đại
Nguyên nhân có thể:
Kết quả trùng hợp mồi.
Giải pháp:
Các đoạn mồi được tối ưu hóa.
2.10.Giá trị 2 Ct <35, đường cong nóng chảy NTC và đỉnh đường cong nóng chảy gen chồng lấn hình dạng
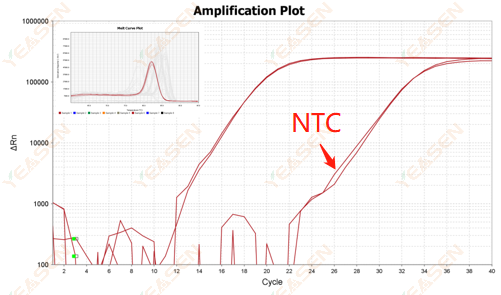
Hình 12. Biểu đồ khuếch đại
Nguyên nhân có thể:
Sự nhiễm bẩn của hệ thống phản ứng.
Giải pháp:
Kiểm tra từng nguồn gây ô nhiễm.
3. Đường cong nóng chảy qPCR bất thường
3.1 Đường cong nóng chảy đỉnh đơn nhưng không sắc nét
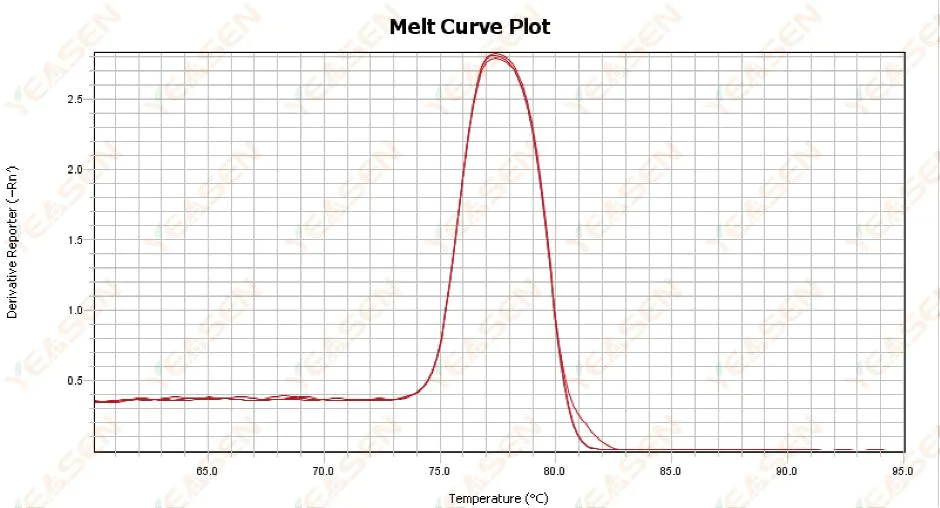
Hình 13. Biểu đồ đường cong nóng chảy
Nguyên nhân có thể:
1) Nó liên quan đến thành phần thuốc thử và kiểu máy.
2) Sự hiện diện của sự khuếch đại không đặc hiệu của các đoạn có kích thước tương tự.
Giải pháp:
1) Khoảng nhiệt độ từ khi bắt đầu đạt đỉnh đến khi kết thúc đạt đỉnh không cao hơn 7°C. Kết quả được coi là có thể sử dụng được, tức là một đỉnh duy nhất.
2) Điện di agarose nồng độ cao (ví dụ agarose 3%) được thực hiện để hỗ trợ xác định.
3.2 Đường cong nóng chảy có hai đỉnh và đỉnh thấp hơn Tm trước 80°C
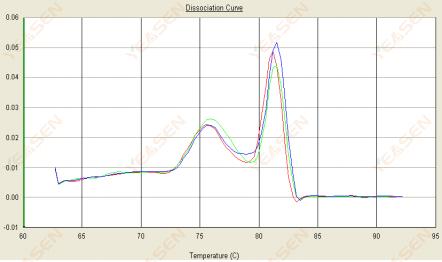
Hình 14. Đường cong phân ly
Nguyên nhân có thể:
Sự hiện diện của các chất mồi dimer.
Giải pháp:
Tăng nhiệt độ ủ, giảm nồng độ mồi hoặc thiết kế lại mồi.
3.3 Đường cong nóng chảy có hai đỉnh và đỉnh thấp hơn Tm là sau 80°C
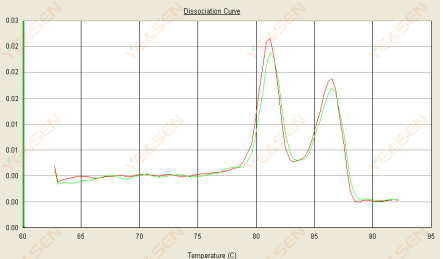
Hình 15. Đường cong phân ly
Nguyên nhân có thể:
1) Độ đặc hiệu của mồi kém dẫn đến việc khuếch đại các sản phẩm không đặc hiệu.
2) Nhiễm bẩn gDNA.
Giải pháp:
1) Kiểm tra độ đặc hiệu của mồi nổ, thiết kế lại nếu kém.
2) Xác nhận bằng kiểm soát âm tính của NRC, nếu có, cần phải chuẩn bị lại mẫu.
3.4 Đỉnh đường cong nóng chảy lộn xộn
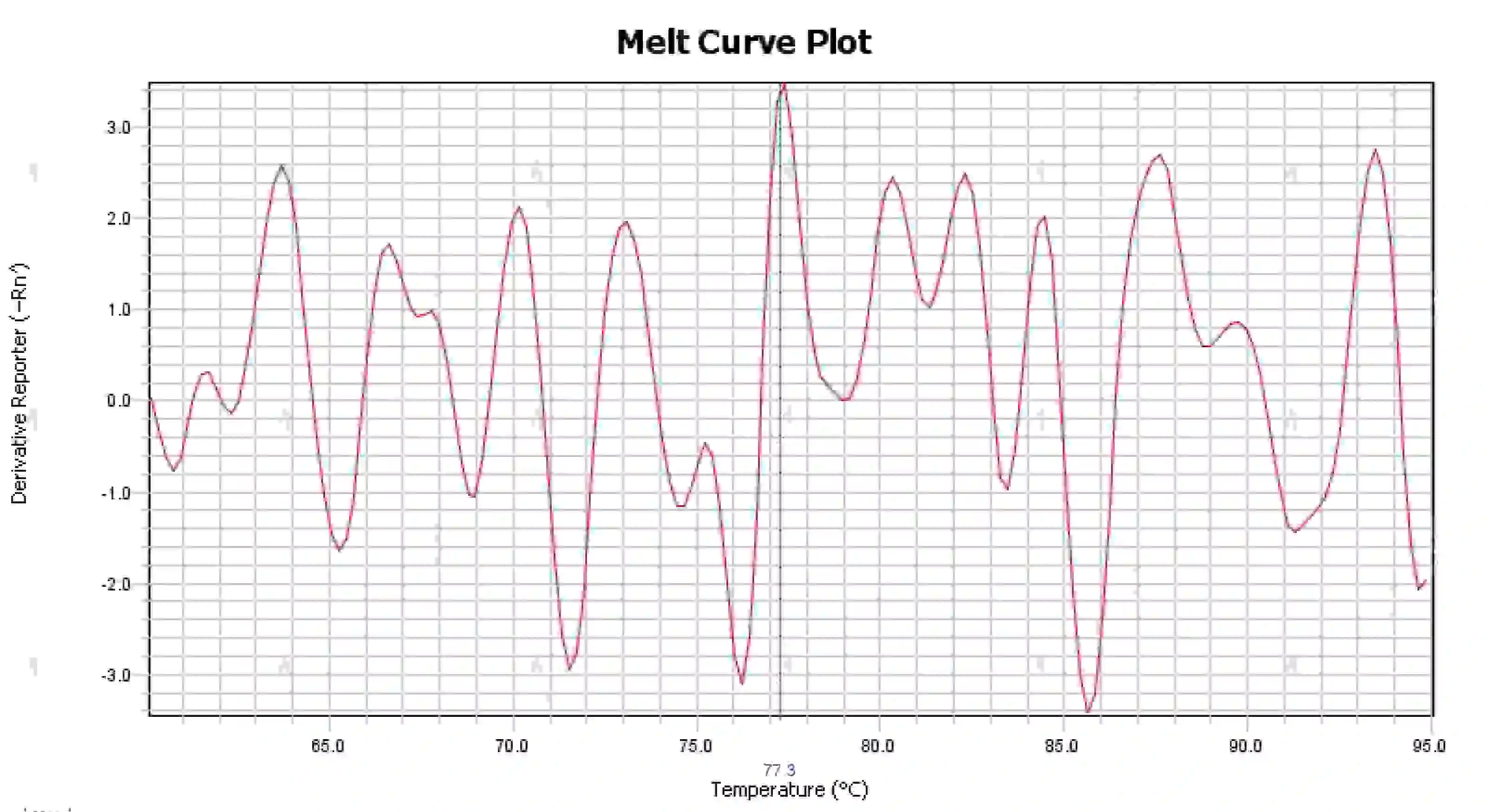
Hình 16. Biểu đồ đường cong nóng chảy
Nguyên nhân có thể:
1) Sự nhiễm bẩn của hệ thống phản ứng.
2) Việc tiếp xúc thuốc thử với ánh sáng mạnh hoặc nhiệt độ cao sẽ làm thuốc thử bị hỏng.
3) Thiết bị đã không được hiệu chuẩn trong một thời gian dài.
4) Sự không phù hợp giữa vật tư tiêu hao và dụng cụ.
Giải pháp:
1) Kết hợp kết quả NTC và NRC để xác nhận sự nhiễm bẩn, khuyến cáo nên loại trừ từng loại nhiễm bẩn từ nước, mồi, enzyme và môi trường.
2) Nên thực hiện các thí nghiệm so sánh với thuốc thử mới.
3) Nên bảo trì hiệu chuẩn thiết bị thường xuyên.
4) Xác nhận các yêu cầu về vật tư tiêu hao của thiết bị tương ứng.
3.5 Các đỉnh giả ở đầu đường cong nóng chảy
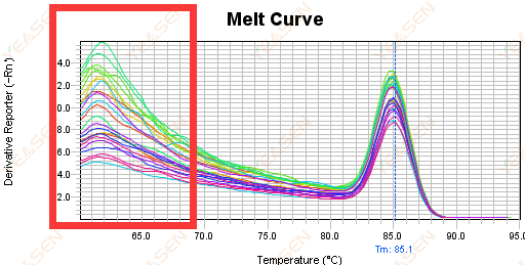
Hình 17. Biểu đồ đường cong nóng chảy
Nguyên nhân có thể:
Nồng độ Rox không khớp với mô hình.
Giải pháp:
Nên hủy hiệu chỉnh Rox để xem đường cong nóng chảy có bình thường không.
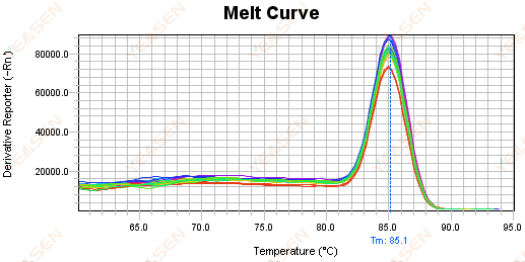
Hình 18. Biểu đồ đường cong nóng chảy
4. Thông tin đặt hàng
Bảng 1. Thông tin đặt hàng
| Tên sản phẩm | Mã sản phẩm | Đặc điểm kỹ thuật |
| Hieff Unicon™ Universal Blue qPCR Master Mix (Dựa trên thuốc nhuộm) | 11184ES03 | 1 ml |
| 11184ES08 | 5×1 ml | |
| 11184ES50 | 50×1mL | |
| 11184ES60 | 100×1 mL |
5. Sản phẩm liên quan
Các sản phẩm được cung cấp bởi
Bảng 2. Sản phẩm liên quan
| Định vị sản phẩm | Tên sản phẩm | Mã sản phẩm |
| Loại bỏ gDNA một bước và phiên mã ngược | Hifair™V một bước RT-gDNA tiêu hóa SuperMix cho qPCR (Cuộc điều tra) | 11142ES |
| Master Mix có độ nhạy cao (có bước loại bỏ gDNA) | Hifair™ III 1st Strand cDNA Synthesis SuperMix cho qPCR (gDNA digester plus) | 11141ES |
| Bộ dụng cụ có độ nhạy cao (có bước loại bỏ gDNA) | Bộ tổng hợp cDNA sợi 1 Hifair™ III (máy tiêu hóa gDNA cộng thêm) (Cuộc điều tra) | 11139ES |
| Hỗn hợp định lượng thông thường (phương pháp thăm dò) | Hieff™ qPCR TaqMan Probe Master Mix (Cuộc điều tra) | 11205ES |
6. Về việc đọc
DNase I và ứng dụng của chúng trong Y sinh học
Hướng dẫn lựa chọn phiên mã ngược
