Với việc nghiên cứu sâu hơn về các cơ quan, ngày càng có nhiều cá nhân tham gia. Bài viết này tóm tắt một số điểm kiến thức chung về các cơ quan [1-5], hy vọng sẽ hữu ích cho mọi người.
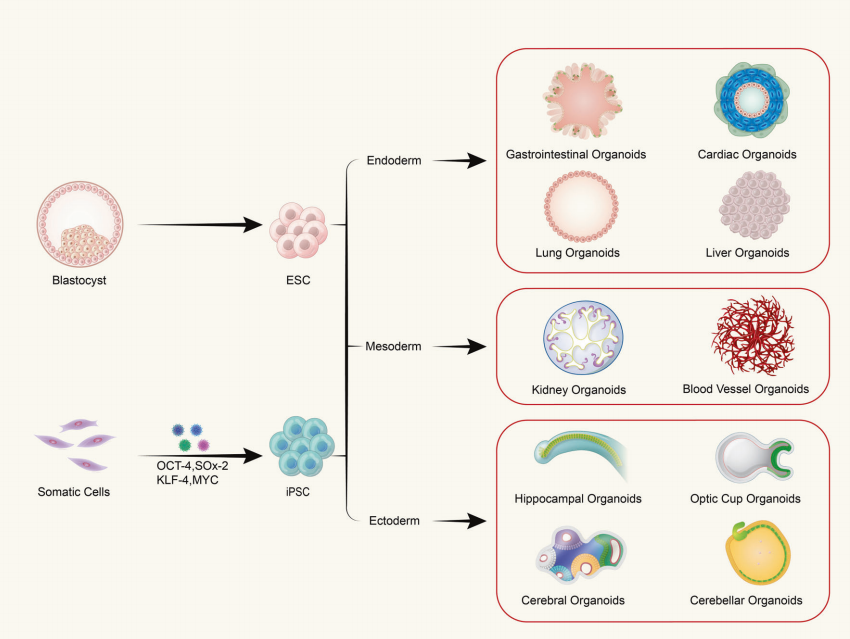
H: Các cơ quan được cấu tạo từ một loại tế bào hay mô đa bào?
Organoid được hình thành từ quá trình nuôi cấy tế bào gốc trưởng thành hoặc tế bào gốc đa năng trong ống nghiệm ba chiều (3D), tạo ra các cấu trúc giống mô với một tổ chức không gian nhất định. Organoid không phải là các cấu trúc bao gồm các tế bào đơn lẻ; thay vào đó, chúng được hình thành bằng cách gây ra sự phân chia và biệt hóa của các tế bào khởi đầu có đặc tính của tế bào gốc, sau đó tự lắp ráp thành các mô có cấu trúc không gian, hình thái và chức năng nhất định tương tự như các cơ quan tương ứng trong cơ thể sống.
H: Nguồn gốc nuôi cấy cơ quan là gì?
(1) Các organoid có nguồn gốc từ tế bào gốc đa năng bao gồm tế bào gốc trưởng thành (ASC), tế bào gốc đa năng (PSC) và tế bào gốc đa năng cảm ứng (iPSC). (2) Các organoid có nguồn gốc từ tế bào chiết xuất từ mô thường được tìm thấy trong mô khối u.
H: Có thể sử dụng mô đông lạnh để nuôi cấy 3D khi không có mô tươi không?
Có, nhưng yêu cầu về kích thước của mô đông lạnh cao hơn và khả năng sống của mô và tế bào đông lạnh ban đầu sẽ giảm đáng kể, dẫn đến tỷ lệ thành công trong quá trình nuôi cấy tiếp theo giảm đáng kể.
H: Các cơ quan được đông lạnh và hồi sinh như thế nào?
Thời điểm tối ưu để đông lạnh các cơ quan là ở các đoạn 2-5, khi hoạt động và tiềm năng biệt hóa của các cơ quan ở mức tốt nhất. Việc hồi sinh các cơ quan có thể tuân theo các phương pháp được sử dụng để hồi sinh tế bào.
H: Có cần thiết phải kiểm soát kích thước của các cơ quan nuôi cấy không và có lợi ích gì nếu chúng quá lớn không?
Có, cần phải kiểm soát kích thước, tốt nhất là trong phạm vi 500μm, vì các cơ quan không có hệ thống tuần hoàn mạch máu và khí-lỏng bên trong. Khi kích thước của các cơ quan lớn, các tế bào gần trung tâm sẽ gặp khó khăn trong việc trao đổi oxy và chất dinh dưỡng với môi trường bên ngoài. Do đó, cấu trúc càng lớn thì số lượng tế bào chết càng nhiều.
H: Ngoài việc sử dụng gel ma trận, còn có thể sử dụng gì để nuôi cấy cơ quan?
Ngoài gel ma trận, các phương án thay thế để nuôi cấy các cơ quan bao gồm (1) ma trận ngoại bào đã khử tế bào và các protein có nguồn gốc khác, (2) hydrogel tổng hợp và (3) gel protein tái tổ hợp được thiết kế.
H: Làm thế nào để có thể phân hóa có định hướng các cơ quan?
Sự phát triển sớm của sự biệt hóa do tế bào gốc gây ra ở các cơ quan được điều chỉnh chung bởi nhiều con đường truyền tín hiệu. Nuôi cấy trong ống nghiệm đòi hỏi phải bổ sung các yếu tố tăng trưởng để mô phỏng hoạt động của các con đường truyền tín hiệu này, hướng dẫn các tế bào biệt hóa theo các hướng cụ thể. Ví dụ, cảm ứng với Y27632 và Activin A có thể biệt hóa các tế bào gốc phôi (ESC) hoặc các tế bào gốc đa năng cảm ứng (iPSC) thành các thể phôi (EB). Sau đó, các con đường truyền tín hiệu được điều chỉnh bởi các yếu tố như Wnt3a, FGF-4 và Noggin để gây ra sự biệt hóa tế bào gốc theo các hướng cụ thể.
H: Làm thế nào để tránh nhiễm bẩn khi lấy mẫu lâm sàng?
(1) Đảm bảo lấy mẫu vô trùng càng nhiều càng tốt. (2) Trước khi chiết xuất, nhúng trong PBS có chứa kháng sinh trong vài phút: đối với khối u nằm ở những vùng có khả năng tiếp xúc với môi trường bên ngoài, chẳng hạn như dạ dày, ruột và bàng quang, nên nhúng trong PBS có chứa 3%-5% kháng sinh trong 5-10 phút; đối với các khối u thông thường khác, nhúng trong PBS có chứa 1%-2% kháng sinh trong khoảng 5 phút. (3) Tất cả các thuốc thử được sử dụng trong quá trình chiết xuất tế bào phải chứa 1% kháng sinh và nồng độ kháng sinh chính thích hợp.
H: Cần thực hiện những biện pháp phòng ngừa nào khi thu thập, bảo quản và vận chuyển mô khối u?
Thu thập càng nhiều mô khối u có hàm lượng tế bào khối u cao càng tốt và giảm thiểu thời gian tiếp xúc của mẫu mô với không khí để giảm khả năng nhiễm bẩn. Đặt các mẫu mô khối u đã thu thập vào các ống vô trùng chứa dung dịch bảo quản mẫu đặc biệt càng sớm càng tốt và vận chuyển nhanh đến đơn vị thử nghiệm ở nhiệt độ thấp (khoảng 4°C) (cố gắng giao trong vòng 2~4 giờ sau khi lấy mẫu).
H: Có sự khác biệt nào giữa các cơ quan được nuôi cấy từ tổn thương và các cơ quan được nuôi cấy từ các mô lân cận không?
Yêu cầu đối với các vị trí lấy mẫu mô khối u là gì? Có, có sự khác biệt. Bản thân khối u biểu hiện tính không đồng nhất, do đó, thường thấy sự khác biệt giữa các cơ quan có nguồn gốc từ các nguồn khác nhau. Về mặt hình thái, các cơ quan có nguồn gốc từ các tổn thương nguyên phát có xu hướng có cấu trúc xâm lấn hơn so với các cơ quan từ các mô lân cận, nhìn chung có vẻ không đều hơn. Để giảm thiểu lỗi trong mô hình hóa hoặc sàng lọc thuốc, nên lấy nhiều mẫu từ các khu vực có hoạt động tốt.
H: Những loại thuốc nào có thể được sử dụng để thử nghiệm độ nhạy thuốc của các cơ quan khối u?
Các loại thuốc chống khối u chính trong thực hành lâm sàng có thể được phân loại thành ba loại: thuốc gây độc tế bào (như paclitaxel, cisplatin/carboplatin, 5-FU, v.v.), thuốc nhắm mục tiêu (thuốc nhắm mục tiêu EGFR, HER2, VEGFR, v.v.) và thuốc miễn dịch trị liệu đại diện bởi chất ức chế điểm kiểm soát miễn dịch (kháng thể PD-1, kháng thể PD-L1, v.v.).
H: Tỷ lệ thành công của việc trồng PDO là bao nhiêu?
Tỷ lệ thành công của nuôi cấy PDO thay đổi đôi chút tùy thuộc vào nguồn. Hầu hết các PDO có tỷ lệ thành công từ 63% đến 70%, hoặc thậm chí cao hơn, lên đến 90%, phần lớn có tương quan với hoạt động của chính mô. Ngoài ra, các phương pháp điều trị lâm sàng có thể ảnh hưởng đến tỷ lệ thành công. Tỷ lệ thành công có thể được cải thiện bằng cách giảm thời gian của mô ex vivo và các bước hoạt động.
H: Có thể sử dụng mô đông lạnh để nuôi cấy cơ quan không?
Nói chung, bảo quản mô đông lạnh không được khuyến khích do mất khả năng sống đáng kể. Tuy nhiên, nếu mô được bảo quản ở nhiệt độ -80°C, thời gian tối ưu để nuôi cấy cơ quan là trong vòng 6 tuần sau khi bảo quản. Nếu mô được bảo quản trong nitơ lỏng, thời gian bảo quản có thể dài hơn nhưng tốt nhất là không quá sáu tháng.
H: Khi chiết xuất tế bào nguyên phát, thường có lẫn nguyên bào sợi. Nên xử lý chúng như thế nào?
(1) Do khả năng bám dính của nguyên bào sợi kém nên chúng có thể bị loại bỏ bằng cách bám dính nhiều lần.(2) Thuốc thử loại bỏ nguyên bào sợi có thể được sử dụng, nhưng liệu chúng có ảnh hưởng đến việc nuôi cấy cơ quan hay không cần phải xác nhận bằng thực nghiệm.
H: Cần bao nhiêu mô khối u ban đầu để nuôi cấy các cơ quan khối u? Mẫu sinh thiết có đủ không?
Nhìn chung, mô phẫu thuật phải lớn hơn kích thước của 2-3 hạt đậu nành; nếu lấy bằng sinh thiết kim, cần ít nhất 2-3 mẫu, trong khi sinh thiết nội soi cần kẹp ít nhất sáu mô khối u trở lên.
H: Nếu mẫu mô khối u quá nhỏ và số lượng cơ quan nuôi cấy không đủ để tiến hành thử nghiệm tiếp theo thì phải làm gì?
Vì các cơ quan dạng bào quan có nguồn gốc từ khối u có thể biểu hiện sự khác biệt về kiểu hình sau khi truyền, nên việc truyền thường không được khuyến khích. Tài liệu khuyến cáo nên giới hạn việc truyền các cơ quan dạng bào quan ở mức 2-3 thế hệ, tối đa là 5 thế hệ. Nếu số lượng tế bào quá nhỏ và không đáp ứng được yêu cầu thử nghiệm sau 5 thế hệ, hãy cân nhắc thay đổi phương pháp thử nghiệm, chẳng hạn như sử dụng đĩa 384 giếng nhỏ hơn hoặc thử chip vi lưu để thử nghiệm.
Q: Trong mô khối u có tế bào bình thường không? Làm sao để loại bỏ những tế bào bình thường này?
Có thể có một số lượng nhỏ tế bào bình thường. Trước tiên, hãy cố gắng tránh lấy mẫu các mô bình thường trong quá trình thu thập. Thứ hai, sau khi chiết xuất các tế bào chính, có thể sử dụng phương pháp phân loại hạt từ tính hoặc phương pháp đo lưu lượng tế bào để nuôi cấy cơ quan tiếp theo. Khi có một số lượng rất nhỏ tế bào bình thường, điều này không ảnh hưởng đáng kể đến việc tạo mô hình và nuôi cấy cơ quan tiếp theo, do đó có thể không cần phải loại bỏ.
H: Khi chiết xuất tế bào chính từ mô khối u, tại sao các tế bào lại có màu đỏ?
Mô giàu nguồn cung cấp máu trong cơ thể sống, do đó có nhiều tế bào hồng cầu. Trong hầu hết các trường hợp, điều này không cần xử lý và không ảnh hưởng đến việc nuôi cấy cơ quan. Nếu có quá nhiều tế bào hồng cầu, chúng có thể được xử lý thích hợp bằng đệm ly giải trước khi nuôi cấy.
H: Trong quá trình nuôi cấy organoid, người ta phát hiện ra các hạt màu đen. Làm thế nào để loại bỏ chúng?
Các hạt màu đen rất có thể là tạp chất hoặc mảnh vụn tế bào. Chúng có thể được loại bỏ theo hai cách:
Tiêu hóa các cơ quan và rửa chúng nhiều lần bằng môi trường để pha loãng tạp chất.
Sử dụng dao phẫu thuật vô trùng để cắt đôi các cơ quan, sau đó sử dụng ống tiêm 1ml chứa đầy môi trường để nhẹ nhàng rửa sạch tạp chất khỏi các cơ quan.
H: Có giới hạn số lần chuyển gen để nuôi cấy cơ quan không và có thể thực hiện bao nhiêu lần chuyển gen?
Số lần truyền thường phụ thuộc vào đặc tính của tế bào nguồn. Hầu hết các cơ quan có thể được truyền trong ống nghiệm tới 10 lần (>6 tháng). Việc lựa chọn điều kiện nuôi cấy cũng có thể có một số ảnh hưởng, với môi trường nuôi cấy thường tốt hơn môi trường nhân tố tổng hợp.
H: Dòng tế bào khối u (như dòng tế bào HepG2) có thể được nuôi cấy vào PDO không?
PDO là những cấu trúc tự lắp ráp phức tạp. Hệ thống nuôi cấy 3D được hình thành bởi các dòng tế bào đơn lẻ không thể được gọi là PDO; chúng chỉ được gọi đơn giản là trạng thái hình cầu 3D.
H: Tiêu chí để cấy ghép các cơ quan là gì?
Tùy thuộc vào trạng thái phát triển của các cơ quan, thời gian thay đổi, thường là từ 5-10 ngày, với đường kính khoảng 100-200μm. Một số cơ quan phát triển chậm có thể mất vài tuần để đạt đến trạng thái chuyển tiếp thích hợp.
H: Làm thế nào để đếm số lượng cơ quan sống?
Trong quá trình thí nghiệm, lấy dung dịch bảo quản Calcein-AM đã chuẩn bị trước ra và thêm dung dịch Calcein-AM vào môi trường để đạt nồng độ cuối cùng là 0,2μmol/L. Ủ ở 37°C trong 60 phút. Sau khi hết thời gian, từ từ rửa sạch môi trường chứa Calcein-AM bằng PBS và thêm môi trường mới. Sử dụng kính hiển vi huỳnh quang có bước sóng kích thích là 490 nm và bước sóng phát xạ là 515 nm để quan sát và chụp ảnh các cơ quan. Các cơ quan sống sẽ có màu xanh lục và có các cạnh rõ ràng. Đếm các cơ quan có đường kính >20μm.
H: Làm thế nào để tính toán khả năng sống của cơ quan?
Khả năng sống của các cơ quan được tính theo công thức: X=(Nlive/Ntotal)×100%, trong đó: X biểu thị khả năng sống của các cơ quan; Nlive biểu thị số lượng các cơ quan còn sống; Ntotal biểu thị tổng số các cơ quan.
H: Có những phương pháp nào để nhận dạng các cơ quan?
Phương pháp cơ bản nhất là quan sát hình thái của các cơ quan dạng sợi qua kính hiển vi và nhuộm H&E. Các phương pháp khác bao gồm Western Blot, qRT-PCR, miễn dịch huỳnh quang, đo lưu lượng tế bào để phát hiện xem các cơ quan dạng sợi có biểu hiện các dấu ấn sinh học tương ứng hay không. Giải trình tự gen có thể xác định sự phù hợp về mặt di truyền giữa các cơ quan dạng sợi được nuôi cấy và mô nguồn. Đối với một số cơ quan dạng sợi, có thể tiến hành các xét nghiệm chức năng để xem chúng có sở hữu các chức năng cụ thể hay không. Ví dụ, các nghiên cứu đã chỉ ra rằng các cơ quan dạng sợi dạ dày có thể tiết ra axit dạ dày và các cơ quan dạng sợi tim có thể đập tự chủ.
H: Các tế bào bình thường cũng có thể phát triển thành các cơ quan không? Làm thế nào để loại bỏ các cơ quan bình thường trong quá trình nuôi cấy cơ quan khối u?
Các tế bào bình thường cũng có thể phát triển thành các cơ quan. Các phương pháp để loại bỏ các cơ quan bình thường bao gồm: (1) Lựa chọn thủ công dựa trên kết quả nhuộm HE dưới kính hiển vi; (2) Làm sạch PDO bằng cách điều chỉnh thành phần của môi trường nuôi cấy (chẳng hạn như các yếu tố tăng trưởng/chất ức chế phân tử nhỏ); (3) Phân tán PDO thành các tế bào đơn lẻ để phân tích tế bào dòng chảy hoặc phân loại hạt từ tính.
H: Trong các thí nghiệm về độ nhạy thuốc, PDO có cần được tiêu hóa từ gel ma trận không?
Không, PDO cần cấu trúc ba chiều để mô phỏng các điều kiện trong cơ thể sống. Nếu không có sự hỗ trợ từ gel ma trận, độ chính xác của các thí nghiệm về độ nhạy thuốc sẽ bị ảnh hưởng. Nhìn chung, thuốc hòa tan có thể thấm qua gel ma trận để tác động lên các cơ quan, nhưng khi tiến hành các thí nghiệm miễn dịch hóa học, cần phải loại bỏ gel ma trận.
H: Các thí nghiệm PDO có thể thay thế hoàn toàn mô hình động vật (PDX) không?
PDO có thể thay thế một phần PDX nhưng không thể thay thế hoàn toàn.
H: Nguyên nhân nào có thể gây ra sự phát triển bất thường của PDO trong quá trình nuôi cấy, đặc trưng bởi chu kỳ tăng trưởng ngắn hơn và sinh sôi nhanh hơn so với các điều kiện trước đây?
Các yếu tố bên ngoài: (1) Sự bất thường này có thể do sự phát triển rộng rãi của một số tế bào nhiễm bẩn, chẳng hạn như nguyên bào sợi. Trong những trường hợp như vậy, nên tiến hành nhuộm cắt và quan sát để xác nhận sự hiện diện của các tế bào nhiễm bẩn này và sau đó tiến hành loại bỏ chúng. (2) Những thay đổi trong điều kiện nuôi cấy, bao gồm việc bổ sung một số yếu tố hoặc phân tử nhỏ, có thể kích hoạt thêm các con đường tăng sinh của PDO.
Các yếu tố bên trong: Đột biến gen có thể xảy ra. Để xác minh điều này, nên tiến hành giải trình tự và so sánh kết quả với kết quả của PDO chính để xác định xem có bất kỳ đột biến gen nào không.
H: Làm thế nào để kiểm tra độ nhạy cảm của PDO với thuốc?
PDO có thể được thử nghiệm về độ nhạy thuốc bằng các phương pháp như xét nghiệm CCK8, xét nghiệm khả năng sống của tế bào ATP và nhuộm sống/chết. Đánh giá hoạt động ATP của các cơ quan khối u là phương pháp phổ biến nhất. ATP là phân tử năng lượng quan trọng nhất trong tế bào và có thể được sử dụng để đo mức độ chuyển hóa tế bào, phản ánh số lượng tế bào sống. Dựa trên tác động của việc dùng thuốc lên hàm lượng ATP của tế bào, giá trị IC50 (nồng độ ức chế nửa tối đa của thuốc được thử nghiệm) cho từng phác đồ thuốc có thể được tính toán bằng phần mềm phân tích để lựa chọn thuốc hiệu quả nhất để ức chế khối u.
H: Phạm vi nồng độ cho các thí nghiệm về độ nhạy thuốc của PDO có giống với phạm vi nồng độ của tế bào khối u nguyên phát không?
Không, chúng không giống nhau. Thông thường, nồng độ thuốc cho PDO cần cao hơn nồng độ cho tế bào chính. Có thể tiến hành các thí nghiệm sơ bộ để phân tích nồng độ tối ưu cho các thí nghiệm độ nhạy thuốc chính thức.
H: Nên sử dụng organoid ở giai đoạn phát triển nào để thử nghiệm thuốc?
Người ta thường khuyến cáo nên sử dụng các organoid trong vòng 5 lần thử thuốc. Ở giai đoạn này, các organoid thể hiện tính ổn định và hoạt động tốt nhất.
H: Tiêu chí nào để xác định sự thành công của việc thành lập cơ quan?
(1) Đánh giá sơ bộ ban đầu: Hình thái cơ quan thay đổi từ trạng thái tế bào sang các dạng như không bào, nảy chồi, đặc hoặc lỏng lẻo. (2) Xác định biểu hiện các dấu hiệu sinh học cụ thể, biểu hiện này phải tương tự như sự phân bố trong các lát mô. Có thể thực hiện phân tích trình tự tiếp theo để so sánh chi tiết hơn.
H: Nuôi cấy organoid khác với nuôi cấy tế bào thông thường như thế nào?
(1) Các phương pháp nuôi cấy tế bào khác nhau: Các cơ quan cần sự hỗ trợ của các chất nền hoặc cấu trúc không gian để duy trì cấu trúc ba chiều của chúng, trong khi nuôi cấy tế bào thông thường không yêu cầu điều này. (2) Nuôi cấy cơ quan cần đạt được sự biệt hóa và tự lắp ráp ngoài cơ thể, do đó cần sử dụng các kết hợp của nhiều cytokine khác nhau để cảm ứng, tạo ra các thành phần môi trường nuôi cấy tương đối phức tạp. Nuôi cấy tế bào thông thường thường chỉ liên quan đến một loại tế bào duy nhất, do đó các thành phần môi trường nuôi cấy tương đối đơn giản.(3) Các nguồn tế bào khác nhau: Các cơ quan có nguồn gốc từ các tế bào biểu mô đa năng, trong khi nuôi cấy tế bào thông thường thích hợp để nuôi cấy nhiều loại tế bào được chọn lọc.
H: Làm sao tôi có thể xác định được các quả cầu 3D mà tôi nuôi cấy có phải là cơ quan hay không và liệu chúng có phù hợp với mô đích hay không?
Các phương pháp để xác định các cơ quan dạng bao gồm nhuộm H&E, miễn dịch mô hóa học (IHC), giải trình tự tế bào đơn và các phương pháp khác. Cần phải đưa ra các đánh giá đa chiều từ góc độ hình thái, bệnh học mô học và di truyền phân tử để xác định xem chúng có phù hợp với cơ quan hoặc mô đích hay không. Đối với các cơ quan dạng khối u, có thể sử dụng việc phát hiện các dấu ấn sinh học cụ thể để xác nhận.
H: Nếu hình thái của các cơ quan quan sát được trong quá trình nuôi cấy khác với những gì được báo cáo trong tài liệu thì lý do có thể là gì?
Đầu tiên, có thể tồn tại sự khác biệt và tính không đồng nhất giữa các nguồn mẫu và phân nhóm mẫu. Thứ hai, sự khác biệt về chất lượng của các cytokine được chọn và một số chất ức chế phân tử nhỏ được sử dụng để cảm ứng có thể dẫn đến sự khác biệt về hình thái biệt hóa của các cơ quan khác nhau. Người ta đề xuất xác nhận tính nhất quán giữa hình thái cơ quan và mô nguồn thông qua các phương pháp như nhuộm HE, IHC và giải trình tự gen, thay vì chỉ dựa vào mô tả trong tài liệu.
H: Khi tiến hành thí nghiệm về độ nhạy thuốc với các cơ quan, có cần phải kiểm soát lượng DMSO được sử dụng làm dung môi cho thuốc không?
Có, thông thường các thí nghiệm về độ nhạy thuốc yêu cầu tỷ lệ phần trăm thể tích của DMSO phải nhỏ hơn 0,5%.
H: Làm thế nào để thu hồi các cơ quan từ gel ma trận?
Các phương pháp sau đây được khuyến nghị: (1) Các dung dịch phục hồi organoid có sẵn trên thị trường (CAT#41421ES) có thể được sử dụng để thu được các huyền phù tế bào một cách nhẹ nhàng và hiệu quả mà không làm hỏng tế bào hoặc protein bề mặt tế bào. (2) Gel ma trận có thể được rã đông ở nhiệt độ thấp để làm mềm và giải phóng các organoid.
H: Nhiều cơ quan bám vào thành ống ly tâm trong quá trình phục hồi. Làm thế nào để cải thiện tốc độ phục hồi?
Khi ly tâm sau khi thu thập, sử dụng máy ly tâm rotor ngang và tăng tốc độ ly tâm một cách thích hợp. Nói chung, lực ly tâm khoảng 300g và tốc độ khoảng 1000-1200 vòng/phút là phù hợp.
| Psản phẩm Ntôi | CON MÈO | Kích cỡ |
| Con người Wnt-3a | 92276ES10 | 10μg |
| 92278ES20 | 20μg | |
| 92701ES10 | 10μg | |
| Đầu Người | 92528ES10 | 10μg |
| 91330ES10 | 10μg | |
| 91306ES10 | 10μg | |
| 91502ES10 | 10μg | |
| 91701ES08 | 10μg | |
| 92602ES60 | 100μg | |
| 91204ES10 | 10μg | |
| 90601ES10 | 10μg | |
| 91113ES10 | 10μg | |
| 92279ES10 | 10μg | |
| 92055ES10 | 10μg | |
| 92053ES10 | 10μg | |
| 92129ES08 | 5μg | |
| 91304ES10 | 10μg | |
| 91702ES10 | 10μg | |
| 92252ES60 | 100μg | |
| 90103ES10 | 10μg | |
| 90104ES10 | 10μg | |
| 90197ES10 | 10μg | |
| 90144ES08 | 10μg | |
| 90196ES10 | 10μg | |
| 90194ES10 | 10μg | |
| 90111ES10 | 10μg | |
| 90120ES10 | 10μg | |
| 90198ES10 | 10μg | |
| 91605ES10 | 10μg | |
| 92251ES10 | 10μg | |
| 92566ES08 | 5μg | |
| 92102ES10 | 10μg | |
| 91103ES10 | 10μg | |
| 92711ES10 | 10μg | |
| 92122ES60 | 100μg | |
| 92201ES60 | 100μg | |
| 92275ES20 | 20μg | |
| BMP-2 của con người | 92051ES10 | 10μg |
Bài đọc liên quan:
Thẩm quyền giải quyết
