مع تعمق الأبحاث حول العضويات، ينضم عدد متزايد من الأفراد إلى هذا المجال. تلخص هذه المقالة بعض نقاط المعرفة الشائعة حول العضويات [1-5]، على أمل أن تكون مفيدة للجميع.
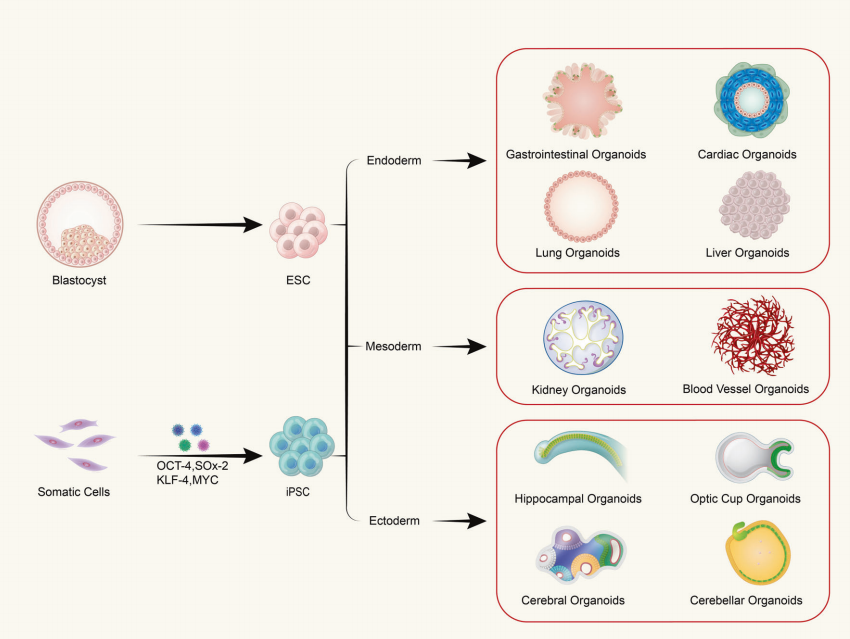
س: هل تتكون العضويات من نوع واحد من الخلايا أم من أنسجة متعددة الخلايا؟
تتشكل العضويات من زراعة ثلاثية الأبعاد للخلايا الجذعية البالغة أو الخلايا الجذعية متعددة القدرات في المختبر، مما يؤدي إلى هياكل تشبه الأنسجة ذات تنظيم مكاني معين. العضويات ليست هياكل مكونة من خلايا مفردة؛ بل إنها تتشكل عن طريق تحفيز انقسام وتمايز الخلايا المبتدئة ذات خصائص الخلايا الجذعية، والتي تتجمع بعد ذلك ذاتيًا في أنسجة ذات بنية مكانية معينة وشكل ووظيفة مماثلة للأعضاء المقابلة في الجسم الحي.
س: ما هي مصادر زراعة العضويات؟
(1) تشمل العضويات المشتقة من الخلايا الجذعية متعددة القدرات الخلايا الجذعية البالغة (ASC)، والخلايا الجذعية متعددة القدرات (PSC)، والخلايا الجذعية متعددة القدرات المستحثة (iPSC). (2) توجد العضويات المشتقة من الخلايا المستخرجة من الأنسجة بشكل شائع في أنسجة الورم.
س: هل يمكن استخدام الأنسجة المجمدة للزراعة ثلاثية الأبعاد في حالة عدم وجود أنسجة طازجة؟
نعم، ولكن هناك متطلبات أعلى لحجم الأنسجة المجمدة، وسوف تنخفض قابلية الأنسجة والخلايا المجمدة الأولية للحياة بشكل كبير، مما يؤدي إلى انخفاض كبير في معدل النجاح في الزراعة اللاحقة.
س: كيف يتم تجميد الأعضاء وإنعاشها؟
الوقت الأمثل لتجميد الأعضاء هو في الممرات 2-5، عندما تكون قدرة الأعضاء على النشاط والتمايز في أفضل حالاتها. يمكن إنعاش الأعضاء باتباع الطرق المستخدمة في إنعاش الخلايا.
س: هل من الضروري التحكم بحجم الأعضاء المزروعة، وهل من المفيد أن تكون كبيرة الحجم؟
نعم، من الضروري التحكم في الحجم، ويفضل أن يكون في حدود 500 ميكرومتر، حيث تفتقر العضويات إلى أنظمة الأوعية الدموية الداخلية ودورة الغاز والسائل. عندما يكون حجم العضويات كبيرًا، تكافح الخلايا القريبة من المركز لتبادل الأكسجين والعناصر الغذائية مع البيئة الخارجية. لذلك، كلما كان الهيكل أكبر، زاد عدد الخلايا الميتة.
س: بالإضافة إلى استخدام هلام المصفوفة، ما هي المواد الأخرى التي يمكن استخدامها في زراعة العضويات؟
بالإضافة إلى هلام المصفوفة، تشمل البدائل لزراعة العضويات (1) المصفوفة خارج الخلية منزوعة الخلايا والبروتينات المشتقة الأخرى، (2) الهلاميات المائية الاصطناعية، و(3) الهلام البروتيني المعاد التركيب الهندسي.
س: كيف يمكن تحقيق التمايز الموجه للأعضاء؟
يتم تنظيم التطور المبكر للتمايز الناتج عن الخلايا الجذعية في العضويات بشكل مشترك من خلال مسارات إشارات متعددة. تتطلب الزراعة في المختبر إضافة عوامل نمو لمحاكاة نشاط مسارات الإشارات هذه، وتوجيه الخلايا للتمايز في اتجاهات محددة. على سبيل المثال، يمكن للتحريض باستخدام Y27632 وActivin A التمييز بين الخلايا الجذعية الجنينية (ESCs) أو الخلايا الجذعية متعددة القدرات المستحثة (iPSCs) إلى أجسام جنينية (EBs). بعد ذلك، يتم تنظيم مسارات الإشارات بواسطة عوامل مثل Wnt3a وFGF-4 وNoggin لتحريض تمايز الخلايا الجذعية في اتجاهات محددة.
س: كيف يمكن تجنب التلوث عند الحصول على العينات السريرية؟
(1) تأكد من أخذ العينات معقمة قدر الإمكان. (2) قبل الاستخراج، اغمر في PBS يحتوي على المضادات الحيوية لعدة دقائق: بالنسبة للأورام الموجودة في مناطق ذات اتصال محتمل بالبيئة الخارجية، مثل المعدة والأمعاء والمثانة، يوصى بالغمر في PBS يحتوي على 3٪ -5٪ من المضادات الحيوية لمدة 5-10 دقائق؛ بالنسبة للأورام الشائعة الأخرى، اغمر في PBS يحتوي على 1٪ -2٪ من المضادات الحيوية لمدة 5 دقائق تقريبًا. (3) يجب أن تحتوي جميع الكواشف المستخدمة أثناء استخراج الخلايا على 1٪ من المضادات الحيوية وتركيز مناسب من المضادات الحيوية الأولية.
س: ما هي الاحتياطات التي يجب اتخاذها عند جمع أنسجة الورم وحفظها ونقلها؟
اجمع أنسجة الورم التي تحتوي على نسبة عالية من خلايا الورم قدر الإمكان، وقلل من وقت تعرض عينات الأنسجة للهواء لتقليل احتمال التلوث. ضع عينات أنسجة الورم المجمعة في أنابيب معقمة تحتوي على محلول خاص لحفظ العينات في أسرع وقت ممكن وانقلها بسرعة إلى وحدة الاختبار في درجة حرارة منخفضة (حوالي 4 درجات مئوية) (احرص على التسليم في غضون 2 إلى 4 ساعات بعد أخذ العينة).
س: هل هناك فرق بين الأعضاء المزروعة من الآفات وتلك المزروعة من الأنسجة المجاورة؟
ما هي متطلبات مواقع أخذ العينات من أنسجة الورم؟ نعم، هناك فرق. فالأورام نفسها تظهر عدم التجانس، لذا فمن الشائع ملاحظة الاختلافات بين الأعضاء المشتقة من مصادر مختلفة. من الناحية الشكلية، تميل الأعضاء المشتقة من الآفات الأولية إلى أن يكون لها بنية أكثر توغلاً مقارنة بتلك المأخوذة من الأنسجة المجاورة، وتبدو بشكل عام أكثر عدم انتظامًا. لتقليل الأخطاء في النمذجة أو فحص الأدوية، يجب أخذ عينات متعددة من مناطق ذات نشاط جيد.
س: ما هي أنواع الأدوية التي يمكن استخدامها لاختبار حساسية الأدوية لأعضاء الورم؟
يمكن تصنيف الأنواع الرئيسية للأدوية المضادة للأورام في الممارسة السريرية إلى ثلاث فئات: الأدوية السامة للخلايا (مثل باكليتاكسيل، سيسبلاتين/كاربوبلاتين، 5-FU، إلخ)، والأدوية المستهدفة (الأدوية التي تستهدف EGFR، HER2، VEGFR، إلخ)، وأدوية العلاج المناعي المتمثلة في مثبطات نقاط التفتيش المناعية (أجسام مضادة PD-1، أجسام مضادة PD-L1، إلخ).
س: ما هي نسبة نجاح زراعة PDO؟
يختلف معدل نجاح زراعة الأنسجة الدهنية غير المشبعة قليلاً حسب المصدر. تتمتع معظم الأنسجة الدهنية غير المشبعة بمعدل نجاح يتراوح بين 63% و70%، أو حتى أعلى من ذلك، حتى 90%، وهو ما يرتبط إلى حد كبير بنشاط الأنسجة نفسها. بالإضافة إلى ذلك، قد تؤثر العلاجات السريرية على معدل النجاح. يمكن تحسين معدلات النجاح عن طريق تقليل وقت زراعة الأنسجة خارج الجسم والخطوات الجراحية.
س: هل يمكن استخدام الأنسجة المجمدة في زراعة الأعضاء؟
بشكل عام، لا يُنصح بتجميد الأنسجة بسبب فقدان كبير للقدرة على البقاء. ومع ذلك، إذا تم تخزين الأنسجة عند درجة حرارة -80 درجة مئوية، فإن النافذة المثلى لزراعة الأعضاء تكون في غضون 6 أسابيع بعد الحفظ. إذا تم تخزين الأنسجة في النيتروجين السائل، يمكن أن تكون مدة الحفظ أطول ولكن من الأفضل ألا تتجاوز ستة أشهر.
س: عند استخراج الخلايا الأولية، عادة ما تكون هناك خلايا ليفية مختلطة. كيف يجب التعامل معها؟
(1) بسبب ضعف التصاق الخلايا الليفية، يمكن إزالتها عن طريق الالتصاق المتكرر.(2) يمكن استخدام كواشف إزالة الخلايا الليفية، ولكن ما إذا كانت تؤثر على زراعة الأعضاء يحتاج إلى التحقق التجريبي.
س: ما هي كمية أنسجة الورم الأصلية اللازمة لزراعة الأعضاء الورمية؟ هل عينة الخزعة كافية؟
بشكل عام، يجب أن تكون الأنسجة الجراحية أكبر من حجم 2-3 حبات من فول الصويا؛ إذا تم الحصول عليها عن طريق خزعة الإبرة، تكون هناك حاجة إلى 2-3 عينات على الأقل، في حين تتطلب الخزعات التنظيرية تثبيت ستة أنسجة ورمية على الأقل أو أكثر.
س: إذا كانت عينة أنسجة الورم صغيرة جدًا، وكان عدد الأعضاء المزروعة غير كافٍ للاختبارات اللاحقة، فماذا يجب فعله؟
نظرًا لأن الأعضاء المشتقة من مصادر الورم قد تظهر اختلافات ظاهرية بعد المرور، فإن المرور لا ينصح به عمومًا. يوصى في الأدبيات بالحد من مرور الأعضاء إلى 2-3 أجيال، بحد أقصى 5 أجيال. إذا كان عدد الخلايا صغيرًا جدًا ولا يمكنه تلبية متطلبات الاختبار بعد 5 أجيال، ففكر في تغيير طريقة الاختبار، مثل استخدام صفيحة أصغر حجمًا مكونة من 384 بئرًا أو تجربة رقائق ميكروفلويدية للاختبار.
س: هل يوجد خلايا طبيعية في أنسجة الورم؟ كيف يمكن إزالة هذه الخلايا الطبيعية؟
قد يكون هناك عدد صغير من الخلايا الطبيعية. أولاً، حاول تجنب أخذ عينات من الأنسجة الطبيعية أثناء الجمع. ثانيًا، بعد استخراج الخلايا الأولية، يمكن استخدام فرز الخرز المغناطيسي أو قياس التدفق الخلوي لمزيد من زراعة الأعضاء. عندما يكون هناك عدد صغير جدًا من الخلايا الطبيعية، فإن هذا لا يؤثر بشكل كبير على نمذجة الأعضاء وزراعتها لاحقًا، لذلك قد لا تكون الإزالة ضرورية.
س: عند استخراج الخلايا الأولية من أنسجة الورم، لماذا تظهر الخلايا باللون الأحمر؟
الأنسجة غنية بإمدادات الدم في الجسم الحي، لذلك يوجد بها العديد من خلايا الدم الحمراء. في معظم الحالات، لا يتطلب هذا معالجة ولا يؤثر على زراعة الأعضاء. إذا كان هناك الكثير من خلايا الدم الحمراء، فيمكن معالجتها بشكل مناسب باستخدام محلول التحلل قبل الزراعة.
س: أثناء زراعة الأعضاء، تم العثور على جزيئات سوداء، كيف يمكن إزالتها؟
من المرجح أن تكون الجسيمات السوداء عبارة عن شوائب أو حطام من الخلايا. ويمكن إزالتها بطريقتين:
قم بهضم العضويات ثم قم بغسلها بشكل متكرر بالوسط لتخفيف الشوائب.
استخدم سكينًا جراحيًا معقمًا لقطع العضويات إلى نصفين، ثم استخدم حقنة 1 مل مملوءة بالوسط لطرد الشوائب من العضويات بلطف.
س: هل هناك حد لعدد الممرات لزراعة الأعضاء، وكم عدد الممرات التي يمكن إجراؤها؟
يعتمد عدد مرات المرور بشكل عام على خصائص الخلايا المصدرية. يمكن مرور معظم الأعضاء في المختبر لمدة تصل إلى 10 مرات (>6 أشهر). قد يكون لاختيار ظروف الثقافة أيضًا بعض التأثير، حيث يكون الوسط المكيف أفضل بشكل عام من وسط العامل الاصطناعي.
س: هل يمكن زراعة خطوط الخلايا السرطانية (مثل خط خلايا HepG2) في PDOs؟
إن PDOs عبارة عن هياكل معقدة مجمعة ذاتيًا. لا يمكن تسمية أنظمة الثقافة ثلاثية الأبعاد التي تتكون من خطوط خلوية مفردة بـ PDOs؛ بل يشار إليها ببساطة باسم الحالات الكروية ثلاثية الأبعاد.
س: ما هي معايير مرور العضويات؟
تختلف المدة تبعًا للحالة التنموية للعضيات، وعادة ما تكون بين 5 إلى 10 أيام، ويبلغ قطرها حوالي 100 إلى 200 ميكرومتر. وقد تستغرق بعض العضيات التي تتطور ببطء عدة أسابيع للوصول إلى حالة مرور مناسبة.
س: كيف يتم حساب عدد العضويات القابلة للحياة؟
أثناء التجربة، أخرج محلول تخزين Calcein-AM المُجهز مسبقًا وأضف محلول Calcein-AM إلى الوسط حتى يصل إلى تركيز نهائي يبلغ 0.2 ميكرومول/لتر. احتضنه عند 37 درجة مئوية لمدة 60 دقيقة. بعد انقضاء الوقت، اغسل الوسط المحتوي على Calcein-AM ببطء باستخدام PBS وأضف وسطًا جديدًا. استخدم مجهرًا فلوريًا بطول موجة إثارة يبلغ 490 نانومتر وطول موجة انبعاث يبلغ 515 نانومتر لمراقبة وتصوير العضويات. ستظهر العضويات الحية باللون الأخضر ولها حواف واضحة. احسب العضويات التي يبلغ قطرها >20 ميكرومتر.
س: كيف يتم حساب قابلية العضويات للبقاء؟
يتم حساب قابلية العضويات للبقاء على قيد الحياة وفقًا للصيغة: X = (Nlive / Ntotal) × 100٪، حيث: يمثل X قابلية العضويات للبقاء على قيد الحياة؛ يمثل Nlive عدد العضويات الحية؛ يمثل Ntotal العدد الإجمالي للعضويات.
س: ما هي طرق التعرف على العضويات؟
الطريقة الأكثر أساسية هي مراقبة مورفولوجيا الأعضاء من خلال المجهر وإجراء صبغ الهيماتوكريت والإيزوسين. تشمل الطرق الأخرى Western Blot وqRT-PCR والمناعة الفلورية وقياس التدفق الخلوي للكشف عما إذا كانت الأعضاء تعبر عن المؤشرات الحيوية المقابلة. يمكن للتسلسل الجيني تحديد التطابق الجيني بين الأعضاء المزروعة والأنسجة المصدر. بالنسبة لبعض الأعضاء، يمكن إجراء اختبارات وظيفية لمعرفة ما إذا كانت تمتلك وظائف محددة. على سبيل المثال، أظهرت الدراسات أن الأعضاء المعدية يمكن أن تفرز حمض المعدة، ويمكن للأعضاء القلبية أن تنبض بشكل مستقل.
س: هل يمكن للخلايا الطبيعية أيضًا أن تنمو إلى عضويات؟ كيف يمكن إزالة العضويات الطبيعية أثناء زراعة العضويات الورمية؟
يمكن للخلايا الطبيعية أيضًا أن تنمو إلى عضويات. تشمل طرق إزالة العضويات الطبيعية ما يلي: (1) الاختيار اليدوي بناءً على نتائج تلطيخ HE تحت المجهر؛ (2) تنقية PDOs عن طريق تعديل تركيبة وسط الثقافة (مثل عوامل النمو/مثبطات الجزيئات الصغيرة)؛ (3) توزيع PDOs في خلايا مفردة لقياس التدفق الخلوي أو فرز الخرز المغناطيسي.
س: أثناء تجارب حساسية الدواء، هل يجب هضم PDOs من هلام المصفوفة؟
لا، تحتاج PDOs إلى بنية ثلاثية الأبعاد لمحاكاة الظروف الحية. إذا لم يكن هناك دعم من هلام المصفوفة، فسوف تتأثر دقة تجارب حساسية الدواء. بشكل عام، يمكن للأدوية القابلة للذوبان اختراق هلام المصفوفة للعمل على الأعضاء، ولكن عند إجراء تجارب كيميائية خلوية مناعية، من الضروري إزالة هلام المصفوفة.
س: هل يمكن لتجارب PDO أن تحل محل النماذج الحيوانية (PDX) بشكل كامل؟
يمكن لـ PDOs استبدال PDX جزئيًا، ولكن لا يمكنها استبدالها بالكامل.
س: ما هي الأسباب المحتملة للنمو غير الطبيعي لـ PDOs أثناء الزراعة، والذي يتميز بدورات نمو قصيرة وانتشار سريع مقارنة بالظروف السابقة؟
العوامل الخارجية: (1) قد يكون سبب هذه الشذوذ هو النمو المكثف لبعض الخلايا الملوثة، مثل الخلايا الليفية. في مثل هذه الحالات، يوصى بإجراء صبغ مقطعي وملاحظة للتأكد من وجود هذه الخلايا الملوثة ثم المضي قدمًا في إزالتها. (2) يمكن للتغيرات في ظروف الثقافة، بما في ذلك إضافة عوامل معينة أو جزيئات صغيرة، أن تعمل على تنشيط مسارات تكاثر PDOs بشكل أكبر.
العوامل الداخلية: الطفرات الجينية المحتملة. للتحقق من ذلك، يوصى بالتسلسل، ويجب مقارنة النتائج بنتائج PDOs الأولية لتحديد ما إذا كانت هناك أي طفرات جينية.
س: كيف يمكن اختبار حساسية PDOs للأدوية؟
يمكن اختبار PDOs لحساسية الدواء باستخدام طرق مثل اختبار CCK8 واختبار قابلية خلايا ATP للحياة والتلوين الحي/الميت. يعد تقييم نشاط ATP في الأعضاء الورمية الطريقة الأكثر شيوعًا. ATP هو جزيء الطاقة الأكثر أهمية في الخلايا ويمكن استخدامه لقياس مستويات التمثيل الغذائي الخلوية، مما يعكس عدد الخلايا القابلة للحياة. بناءً على تأثير إعطاء الدواء على محتوى ATP الخلوي، يمكن حساب قيمة IC50 (نصف التركيز المثبط الأقصى للدواء المختبر) لكل نظام دوائي باستخدام برنامج التحليل لاختيار الأدوية الأكثر فعالية لتثبيط الورم.
س: هل نطاقات التركيز لتجارب حساسية الدواء لـ PDOs هي نفسها تلك الخاصة بخلايا الورم الأولية؟
لا، ليسا متماثلين. عادةً، يجب أن يكون تركيز الدواء لـ PDOs أعلى من تركيزه للخلايا الأولية. يمكن إجراء تجارب أولية لتحليل التركيزات المثلى لتجارب حساسية الدواء الرسمية.
س: في أي مرحلة من النمو يجب استخدام العضويات لاختبار الأدوية؟
يُنصح عمومًا باستخدام الأعضاء في غضون 5 مراحل لاختبار المخدرات. في هذه المرحلة، تظهر الأعضاء أفضل قدر من الاستقرار والنشاط.
س: ما هي معايير تحديد نجاح إنشاء العضو؟
(1) التقييم الأولي المبكر: يتغير شكل العضو من الحالة الخلوية إلى أشكال مثل الفجوات أو التبرعم أو التماسك أو الرخاوة. (2) تحديد التعبير عن المؤشرات الحيوية المحددة، والتي يجب أن تكون مشابهة للتوزيع في شرائح الأنسجة. يمكن إجراء تحليل تسلسل إضافي لإجراء مقارنات أكثر تفصيلاً.
س: كيف تختلف زراعة الأعضاء عن زراعة الخلايا العادية؟
(1) طرق مختلفة لزراعة الخلايا: تتطلب العضويات دعمًا من ركائز أو هياكل مكانية للحفاظ على بنيتها ثلاثية الأبعاد، في حين لا تتطلب زراعة الخلايا العادية ذلك. (2) تتطلب زراعة العضويات تحقيق التمايز والتجميع الذاتي خارج الجسم الحي، وبالتالي تتطلب استخدام مجموعات من السيتوكينات المختلفة للتحريض، مما يؤدي إلى مكونات وسط زراعة معقدة نسبيًا. عادةً ما تتضمن زراعة الخلايا العادية نوعًا واحدًا فقط من الخلايا، وبالتالي فإن مكونات وسط الزراعة بسيطة نسبيًا.(3) مصادر الخلايا المختلفة: يتم الحصول على العضويات من الخلايا الظهارية متعددة القدرات، في حين أن زراعة الخلايا العادية مناسبة لزراعة أنواع مختلفة من الخلايا المختارة.
س: كيف يمكنني تحديد ما إذا كانت الكرات ثلاثية الأبعاد التي قمت بزراعتها عبارة عن عضويات وما إذا كانت متوافقة مع الأنسجة المستهدفة؟
تشمل طرق تحديد الأعضاء الصبغة H&E، والمناعة الكيميائية النسيجية (IHC)، وتسلسل الخلية الفردية، وغيرها. من الضروري إصدار أحكام متعددة الأبعاد من منظور مورفولوجي ونسيجي وجزيئي لتحديد ما إذا كانت متوافقة مع العضو أو النسيج المستهدف. بالنسبة للأعضاء الورمية، يمكن استخدام الكشف عن المؤشرات الحيوية المحددة للتأكيد.
س: إذا كان شكل الأعضاء التي تم ملاحظتها أثناء الزراعة يختلف عما هو مذكور في الأدبيات، فما هو السبب الذي قد يكون؟
أولاً، قد توجد فروق فردية وتباين في مصادر العينات والأنواع الفرعية. ثانيًا، قد تؤدي الاختلافات في جودة السيتوكينات المختارة وبعض مثبطات الجزيئات الصغيرة المستخدمة في التحريض إلى اختلافات في مورفولوجيا التمايز بين الأعضاء المختلفة. يُقترح تأكيد الاتساق بين مورفولوجيا الأعضاء والأنسجة المصدرية من خلال طرق مثل تلطيخ HE وIHC والتسلسل الجيني، بدلاً من الاعتماد فقط على أوصاف الأدبيات.
س: عند إجراء تجارب حساسية الأدوية باستخدام العضويات، هل من الضروري التحكم في كمية ثنائي ميثيل سلفوكسيد المستخدمة كمذيب للأدوية؟
نعم، تتطلب تجارب حساسية الدواء عادةً أن تكون النسبة المئوية لحجم DMSO أقل من 0.5%.
س: كيف يمكن استعادة العضويات من هلام المصفوفة؟
يوصى بالطرق التالية: (1) يمكن استخدام حلول استرداد العضويات المتوفرة تجاريًا (CAT#41421ES) للحصول على معلقات خلوية بلطف وفعالية دون إتلاف الخلايا أو بروتينات سطح الخلية. (2) يمكن إذابة هلام المصفوفة عند درجة حرارة منخفضة لتليينه وإطلاق العضويات.
س: تلتصق العديد من الأعضاء بجدران أنبوب الطرد المركزي أثناء عملية الاسترداد. كيف يمكن تحسين معدل الاسترداد؟
عند الطرد المركزي بعد التجميع، استخدم جهاز طرد مركزي دوار أفقي وقم بزيادة سرعة الطرد المركزي بشكل مناسب. بشكل عام، تكون قوة الطرد المركزي التي تبلغ حوالي 300 جرام وسرعة حوالي 1000-1200 دورة في الدقيقة مناسبة.
| صالمنتج نأمي | قطة | مقاس |
| الإنسان Wnt-3a | 92276ES10 | 10ميكرومترج |
| 92278ES20 | 20ميكرومترج | |
| 92701ES10 | 10ميكرومترج | |
| رأس بشري | 92528ES10 | 10ميكرومترج |
| 91330ES10 | 10ميكرومترج | |
| 91306ES10 | 10ميكرومترج | |
| 91502ES10 | 10ميكرومترج | |
| 91701ES08 | 10ميكرومترج | |
| 92602ES60 | 100ميكرومترج | |
| 91204ES10 | 10ميكرومترج | |
| 90601ES10 | 10ميكرومترج | |
| 91113ES10 | 10ميكرومترج | |
| 92279ES10 | 10ميكرومترج | |
| 92055ES10 | 10ميكرومترج | |
| 92053ES10 | 10ميكرومترج | |
| 92129ES08 | 5ميكرومترج | |
| 91304ES10 | 10ميكرومترج | |
| 91702ES10 | 10ميكرومترج | |
| 92252ES60 | 100ميكرومترج | |
| 90103ES10 | 10ميكرومترج | |
| 90104ES10 | 10ميكرومترج | |
| 90197ES10 | 10ميكرومترج | |
| 90144ES08 | 10ميكرومترج | |
| 90196ES10 | 10ميكرومترج | |
| 90194ES10 | 10ميكرومترج | |
| 90111ES10 | 10ميكرومترج | |
| 90120ES10 | 10ميكرومترج | |
| 90198ES10 | 10ميكرومترج | |
| 91605ES10 | 10ميكرومترج | |
| 92251ES10 | 10ميكرومترج | |
| 92566ES08 | 5ميكرومترج | |
| 92102ES10 | 10ميكرومترج | |
| 91103ES10 | 10ميكرومترج | |
| 92711ES10 | 10ميكرومترج | |
| 92122ES60 | 100ميكرومترج | |
| 92201ES60 | 100ميكرومترج | |
| 92275ES20 | 20ميكرومترج | |
| BMP-2 البشري | 92051ES10 | 10ميكرومترج |
قراءة ذات صلة:
مرجع
