Vejledning til valg af produkt til in vitro celletransfektionsreagens
Celletransfektionsreagenser er blevet rutinereagenser til at studere og kontrollere genfunktion i eukaryote celler. Transfektionsreagenser er meget udbredt i genfunktionsforskning, genekspressionsregulering og mutationsanalyse, såvel som genterapi, celleterapi, proteinproduktion og vaccineproduktion. Så hvad er transfektion? Og hvordan vælger man en slags transfektionsreagens baseret på dine eksperimenter?
Hvilke typer transfektion er der?
Funktionerne ved transfektionsreagenser fra Yeasen
Hvordan vælger man en slags transfektionsreagens baseret på dine eksperimenter?
Ansøgningssag
Reference for transfektionsbetingelser
Ofte stillede spørgsmål
Hilsen læsning
Hvilke typer transfektion er der?
Alt efter om nukleinsyren er integreret i værtscellens kromosom efter transfektion, opdeles den i "transient" (transient transfektion) og "stabil" (stabil transfektion). Transfektionseffektiviteten, cytotoksiciteten, virkningerne på normal fysiologi og genekspressionsniveauer af forskellige transfektionsmetoder er forskellige. Principperne, anvendelserne og egenskaberne sammenlignes i følgende tabel:
Tabel 1 Sammenligning af forskellige transfektionsmetoder
| Teknologi | Principper | Fordele | Ulemper |
| Kemisk transfektionsmetode | |||
| Kationiske liposomer | Positivt ladede liposomer danner komplekser med negativt ladede fosfatgrupper af nukleinsyrer og endocyteres af celler. |
|
|
| Calciumphosphat Samudfældning | Calciumphosphat-DNA-komplekser adsorberes til cellemembraner og endocyteres af celler |
|
|
| Dextran | Komplekset dannet ved interaktionen mellem det positivt ladede DEAE-dextran og det negativt ladede fosfatrygrad i nukleinsyren endocyteres af cellen. |
|
|
| Andre kationiske polymerer | Den positivt ladede polymer danner et positivt ladet kompleks med den negativt ladede fosfatgruppe i nukleinsyren, interagerer derefter med den negativt ladede proteoglycan på celleoverfladen og kommer ind i cellen gennem endocytose. |
|
|
| Biotransfektionsmetode | |||
| Viral transfektion | Instinkt inficerer celler og leverer genetisk materiale |
|
|
| Fysisk transfektionsmetode | |||
| Elektrisk overførsel | Den høje pulsspænding forstyrrer cellemembranpotentialet, og DNA'et indføres gennem porerne dannet i membranen. |
|
|
| Biotransmissionspartikellevering (partikelbombardement) | DNA'et udfældes med mikroskopiske tungmetalpartikler, og derefter projiceres de coatede partikler ind i cellerne med en ballistisk anordning, og DNA'et frigives gradvist og udtrykkes i cellerne. |
|
|
| Mikroinjektion | Mikromanipulation bruges til at injicere DNA direkte ind i målcellens kerne. |
|
|
Funktionerne ved transfektionsreagenser fra Yeasen
For DNA-transfektionsreagenser og RNA-transfektionsreagenser har Yeasen Biotechnology et stærkt R&D- og produktionsteam, optimerer løbende formler, forbedrer produktionsprocesser og har lanceret en række produkter baseret på kationiske liposomer og kationiske polymerer. Videnskabelige forskningsinstitutioner og virksomheder leverer et komplet udvalg af produkter, og produktlinjen dækker alle områder, der er involveret i transfektionsreagenser.
| Hieff Trans™ suspensionscellefri liposomal transfektionsreagens | |
| 40802ES | 40805ES |
| 40806ES | 40816ES |
- Høj effektivitet: velegnet til forbigående transfektion eller stabil transfektion af cellelinjer.
- Lav toksicitet: Transficerede celler forbliver levedygtige.
- Bred tilpasningsevne: omfattende dækning af almindelige celler og primære celler, der er svære at transficere.
- Let at betjene: velegnet til medium i nærvær af serum, uden at ændre mediet før og efter transfektion.
- Omkostningseffektiv: økonomisk og praktisk, høj transfektionseffektivitet, lav pris.
Hvordan vælger man en slags transfektionsreagens baseret på dine eksperimenter?
Udvælgelsen af transfektionsreagenser skal vælges i overensstemmelse med de forskellige eksperimentelle formål og eksperimentelle indhold, såsom de transficerede stoffer, specifikke celler, betjeningskomfort og andre faktorer.
| Produkt | Hieff Trans™ suspensionscellefri liposomal transfektionsreagens | |||
| Celletype | konventionel celle | konventionel celle | konventionel celle | konventionel celle |
| / | / | vanskelige at transficere celler | vanskelige at transficere celler | |
| Nukleinsyre type | DNA | DNA | / | DNA |
| siRNA | siRNA | siRNA | / | |
| / | / | miRNA | / | |
| / | / | efterligne miRNA | / | |
| / | / | antimiRNA | / | |
| DNA/siRNA co-transfektion | DNA/siRNA co-transfektion | / | / | |
| virus emballage | virus emballage | / | virus emballage |
Ansøgningssag
Hieff Trans™ Liposomal Transfektionsreagens
Hieff Trans™ leveres i steril flydende form. Generelt, til 24-brønds pladetransfektion, ca. 1,5 μL hver gang, 1 mL Hieff Trans™ kan udføre omkring 660 transfektioner; til 6-brønds plade, ca. 6 μL hver gang, 1 mL Hieff Trans™ kan lave omkring 660 transfektioner. 160 transfektioner;
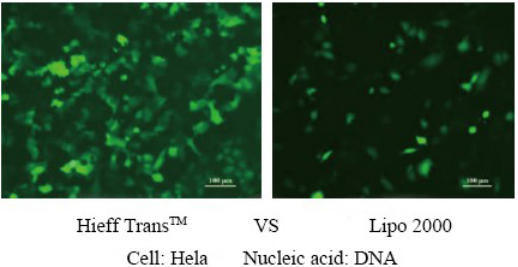
For flere detaljer, se venligst Tillid til transfektion med Hieff Trans™ Lipofectamine Reagent
Polyethylenimin Lineær (PEI) MW40000 (hurtig lysis)
PEI 40000 er en højt ladet kationisk polymer med en molekylvægt på 40.000, der binder negativt ladede nukleinsyremolekyler meget let, danner et kompleks og tillader komplekset at trænge ind i celler. PEI 40000 er et transient transfektionsreagens med lav cytotoksicitet, høj transfektionseffektivitet og høj genekspressionseffektivitet i celler såsom HEK293 og CHO. Lineære PEI-transfektionsreagenser er blevet valideret for en lang række cellelinjer, herunder HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, Sf9, HepG2 og Hela-celler. Transfektionseffektiviteten er så høj som 80% ~ 90%.
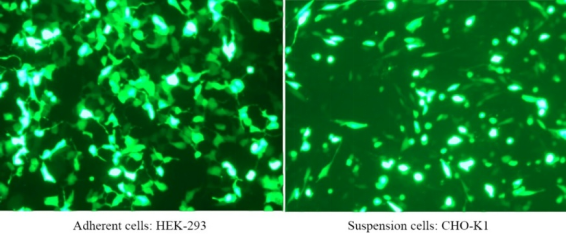
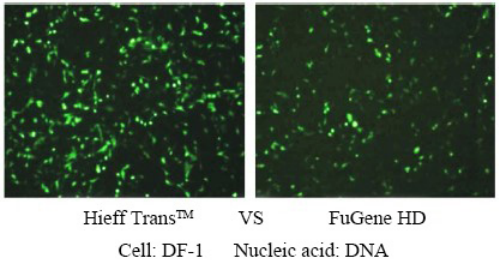
For flere detaljer, se venligst Ny favorit til transfektion —— Linear PEI MW 40000, et mere effektivt transfektionsreagens
Hieff Trans™ in vitro siRNA/miRNA-transfektionsreagens
Dette produkt kan opnå over 90 % ekspressionseffektivitet på 1 nM siRNA i en bred vifte af cellelinjer, hvilket undgår effekter uden for målet. Velegnet til transfektion af en række celler, herunder Hela, MCF-7, HepG2, CHO og andre adhærente celler; og vanskelige at transficere suspensionscellelinjer, såsom K562- eller THP-1-celler, kan opnå 80 % lyddæmpningseffektivitet; Inklusive nogle primære celler, primære humane fibroblaster og primære humane hepatocytter osv., kan lyddæmpningseffektiviteten på 80 % opnås.
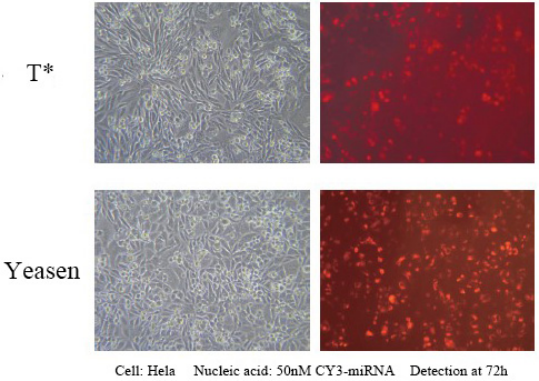
Reference for transfektionsbetingelser
Udover vejledningen til hvert produkt, opererer kunderne efter deres specifikke eksperimentelle indhold, og der vil være forskellige forskelle i brugsmængden. I henhold til in vitro celletransfektionsbetingelserne rapporteret af kunder efter brug af produktet, er de blevet sorteret fra til din reference.
| Produktnavn/varenummer | |||||
| Celle | Kulturkar | Cellepletteringsdensiteter | DNA | Hieff trans | Transfektionseffektivitet |
| A549 | 6 godt | 90 % | 0,7 μg | 1,15 μL | +++ |
| BV 2 | 24 godt | 95 % | 0,2 μg | 0,2 μL | ++ |
| C2C12 | 24 godt | 80 % - 90 % | 1 μg | 5 μL | ++ |
| DF 1 | 24 godt | 80 % - 90 % | 0,5 μg | 0,5 μL | +++ |
| H520 | 6 godt | 80 % | 1.2 μg | 6 μL | ++ |
| HaCaT | 96 godt | 70 % | 100 ng | 1 μL | ++ |
| HCT116 | 6 godt | 90 % | 4 μg | 10 μL | ++ |
| 293 kr | 6 godt | 95 % | 2 μg | 10 μL | 80 - 90 % |
| HEK 293FT | 24 godt | 85 % | 1 μg | 4 μL | 90 % |
| HEK 293T | 12 godt | 1×105 | 1 μg | 2 μL | +++ |
| HEK 293T (suspension) | 30 ml | 80 % | 30 μg | 60 μL | ++ |
| Hela | 12 godt | 90 % | 0,2 μg | 0,6 μL | 90 % |
| Hela | 12 godt | 80 % | 1 μg | 3 μL | +++ |
| HepG2 | 12 godt | 80 % | 1 μg | 3 μL | ++ |
| HUVEC | 24 godt | 80 % | 1 μg | 2 μL | ++ |
| MCF10A | 10 cm fad | 60 % | 5 μg | 15 μL | ++ |
| N2A | 24 godt | 70 % - 80 % | 300 ng | 900 μL | + |
| NCI H1975 | 6 godt | 80 % | 4 μg | 10 μL | +++ |
| NIH 3T3 | 6 godt | 90 % | 4 μg | 10 μL | +++ |
| Rå 264.7 | 35 mm fad | 80 % | 1 μg | 2 μL | 90 % |
| Vero | 6 godt | 80 % | 3 μg | 9 μL | +++ |
| Celle | Kulturkar | Cellepletteringstætheder | siRNA | Hieff trans | Transfektionseffektivitet |
| HK2 | 6 godt | 65 % | 100 pmol | 6 μL | +++ |
Ofte stillede spørgsmål
1 Hieff Trans™ Liposomal Transfektionsreagens
1.1 Spørgsmål: Kan serum være til stede ved fremstilling af nukleinsyretransfektionsreagenskomplekser?
A: Tilstedeværelsen af serum vil påvirke dannelsen af liposomer. Det anbefales at bruge et serumfrit medium (generelt MEM-medium) ved fremstilling af nukleinsyretransfektionsreagenskomplekser.
1.2 Sp: Hvad skal jeg være opmærksom på, når jeg bruger Hieff Trans™ Liposomal Nucleic Acid Transfection Reagent?
EN:
1) Når cellerne transficeres, er celletætheden fortrinsvis 80%-95%, og den specifikke udpladningsdensitet bestemmes i overensstemmelse med cellernes situation;
2) Brug af DNA med høj renhed hjælper med at opnå højere transfektionseffektivitet;
3) DNA og transfektionsreagenser skal fortyndes med det serumfrie medium ved fremstilling af transfektionskomplekser;
4) Antibiotika kan ikke tilsættes til mediet under transfektion;
5) Reagenser skal opbevares ved 2-8°C, og man skal være forsigtig med at undgå gentagne gange at åbne låget i lang tid;
6) DNA-koncentrationen og antallet af kationiske liposomreagenser bør optimeres til den første brug for at opnå den maksimale transfektionseffektivitet. Forholdet mellem DNA og transfektionsreagens anbefales generelt at være 1:2-1:3.
1.3 Spørgsmål: Behøver det at blive afsluttet efter transfektion?
A: Ikke nødvendigt. Liposomkomplekser er stabile i 6 timer. Hvis cellemediet ikke ændres før transfektion, er det for at sikre de nødvendige næringsstoffer til normal cellevækst nødvendigt at skifte til et nyt medium efter 4-6 timer. Men hvis mediet er blevet skiftet før transfektion, er det ikke nødvendigt at ændre mediet efter liposomtransfektion.
1.4 Q: Kan co-transfektion af DNA og siRNA udføres? Hvordan er effekten?
A: Ja, når DNA og siRNA co-transficeres, vil siRNA-transfektionseffektiviteten være lidt dårligere.
1.5 Sp.: Kan transfektionsreagenset bruges til transfektion af lentiviral emballage?
A: Lentiviral emballering er mulig.
1.6 Sp.: Kan suspensionsceller transficeres med Hieff Trans™ liposomalt nukleinsyretransfektionsreagens?
A: Hieff Trans™ liposomnukleinsyretransfektionsreagens kan bruges til suspensionscelletransfektion, se protokol for detaljer. Derudover introducerede vi også et transfektionsreagens specifikt til suspensionsceller (kat.nr.40805, Hieff Trans™ suspensionscellefri liposomal transfektionsreagens)
2 Hieff Trans™ in vitro siRNA/miRNA-transfektionsreagens
2.1 Sp.: Skal transfektionsreagenset udskiftes efter transfektion?
A: Dette problem kan opdeles i to tilfælde: 1. Hvis der ikke er nogen mediumændring før transfektion, skal mediet udskiftes ca. 6 timer efter transfektion for at sikre de nødvendige næringsstoffer til cellevækst; 2. Hvis der er en medium ændring før transfektion, kan opereres i henhold til den normale drift af dyrkede celler? ? Efter væskeskifteoperationen?
2.2 Sp.: Kan transfektionsreagenser fryses?
A: Det kan ikke fryses, fordi transfektionsreagenset er et PEI kationisk transfektionsreagens. Frysning ved lave temperaturer vil ødelægge aktiviteten af PEI-transfektionsreagenset. Derfor er det bedst at opbevare det ved 2-8 °C for at opretholde den bedste transfektion. effektivitet.
Produktinformation
| Produktnavn | SKU | Specifikationer |
| Hieff Trans™ Liposomal Transfektionsreagens | 40802ES02 | 0,5 ml |
| 40802ES03 | 1,0 ml | |
| 40802ES08 | 5×1 ml | |
| Hieff Trans™ suspensionscellefri liposomal transfektionsreagens (Forespørgsel) | 40805ES02 | 0,5 ml |
| 40805ES03 | 1,0 ml | |
| 40805ES08 | 5×1 ml | |
| Hieff Trans™ in vitro siRNA/miRNA-transfektionsreagens (Spørge) | 40806ES02 | 0,5 ml |
| 40806ES03 | 1,0 ml | |
| Polyethylenimin Lineær (PEI) MW40000(hurtig lysis) | 40816ES02 | 100 mg |
| 40816ES03 | 1 g | |
| 40816ES08 | 5×1 g |
Nogle af artiklerne udgivet ved hjælp af vores produkter
[1] Liu R, Yang J, et al. Optogenetisk kontrol af RNA-funktion og metabolisme ved hjælp af konstruerede lys-omskiftelige RNA-bindende proteiner. Nat Biotechnol. 3. januar 2022. (IF:55)
[2] Luo J, Yang Q, et al. TFPI er en colonkrypt-receptor for TcdB fra hypervirulent clade 2 C. difficile. Celle. 17. marts 2022 (IF:41.582)
[3] Zhou J, Chen P, et al. Cas12a-varianter designet til lavere genom-dækkende effekt uden for mål gennem streng PAM-genkendelse. Mol Ther. 5. januar 2022 (IF:11.454)
[4] Chen S, Cao X, et al. circVAMP3 driver CAPRIN1-faseseparation og hæmmer hepatocellulært karcinom ved at undertrykke c-Myc-oversættelse. Adv Sci (Weinh). 2022 24. januar (IF:16.808)
[5] Gu C, Wang Y, et al. AHSA1 er et lovende terapeutisk mål for cellulær proliferation og proteasomhæmmerresistens ved myelomatose. J Exp Clin Cancer Res. 6. januar 2022 (IF:11.161)
[6] Zhang Y, Yu X, et al. Splejsningsfaktor arginin/serin-rig 8 fremmer multipel myelom malignitet og knoglelæsion gennem alternativ splejsning af CACYBP og exosom-baseret cellulær kommunikation. Clin Transl Med. 2022 feb.(IF:11.492)
[7] Qin J, Cai Y, et al. Molekylær mekanisme for agonisme og omvendt agonisme i ghrelinreceptor. Nat Commun. 13. januar 2022.(IF:14.9)
[8] Tang X, Deng Z, et al.Et nyt protein kodet af circHNRNPU fremmer progression af myelomatose ved at regulere knoglemarvens mikromiljø og alternativ splejsning. J Exp Clin Cancer Res. 8. marts 2022 (IF:11.161)
[9] Xie F, Su P, et al. Engineering ekstracellulære vesikler beriget med palmitoyleret ACE2 som COVID-19-terapi. Adv Mater. 19. oktober 2021. (IF:30.849)
[10] Liang Y, Lu Q, et al. Reaktivering af tumorsuppressor i brystkræft ved forstærker-switch gennem NamiRNA-netværk. Nucleic Acids Res. 7. september 2021 (IF:16,9)
[11] Fan Y, Wang J, et al. CircNR3C2 fremmer HRD1-medieret tumor-undertrykkende effekt via sponging miR-513a-3p i triple-negativ brystkræft. Mol Cancer. 2. februar 2021 (IF:27.403)
[12] Dai L, Dai Y, et al. Strukturel indsigt i BRCA1-BARD1 kompleks rekruttering til beskadiget kromatin. Mol Cell. 1. juli 2021.(IF:17.97)
[13] Zhang K, Wang A, et al. UBQLN2-HSP70-aksen reducerer poly-Gly-Ala-aggregater og afhjælper adfærdsdefekter i C9ORF72-dyremodellen. Neuron. 16. juni 2021.(IF:17.17)
[14] Li T, Chen X, et al. En syntetisk BRET-baseret optogenetisk enhed til pulserende transgenekspression, der muliggør glukosehomeostase i mus. Nat Commun. 2021 27. januar (IF:14.92)
[15] Yan F, Huang C, et al. Threonin ADP-ribosylering af ubiquitin af en bakteriel effektorfamilie blokerer værtsubiquitinering. Mol Cell. 21. maj 2020.(IF:17.97)
[16] Sun X, Peng X, et al. ADNP fremmer neural differentiering ved at modulere Wnt/β-catenin signalering. Nat Commun. 12. juni 2020.(IF:14.911)
[17] Yang X, Wang H, et al. Omledning af ERBB3- og ERK-signalering bibringer resistens mod FGFR1-hæmning i mave-tarmkræft med en ERBB3-E928G-mutation. Proteincelle. 2020 dec.(IF:14.872)
[18] Zou Y, Wang A, et al. Analyse af redoxlandskaber og dynamik i levende celler og in vivo ved hjælp af genetisk kodede fluorescerende sensorer. Nat Protoc. Okt. 2018 (IF:13.490)
[19] Hao H, Hu S, et al. Tab af endotelial CXCR7 forringer vaskulær homeostase og hjerteombygning efter myokardieinfarkt: Implikationer for kardiovaskulær lægemiddelopdagelse. Cirkulation. 28. marts 2017 (IF:29.69)
