Avec l'approfondissement des recherches sur les organoïdes, un nombre croissant de personnes y participent. Cet article résume certains points de connaissances communes sur les organoïdes [1-5], dans l'espoir d'être utile à tous.
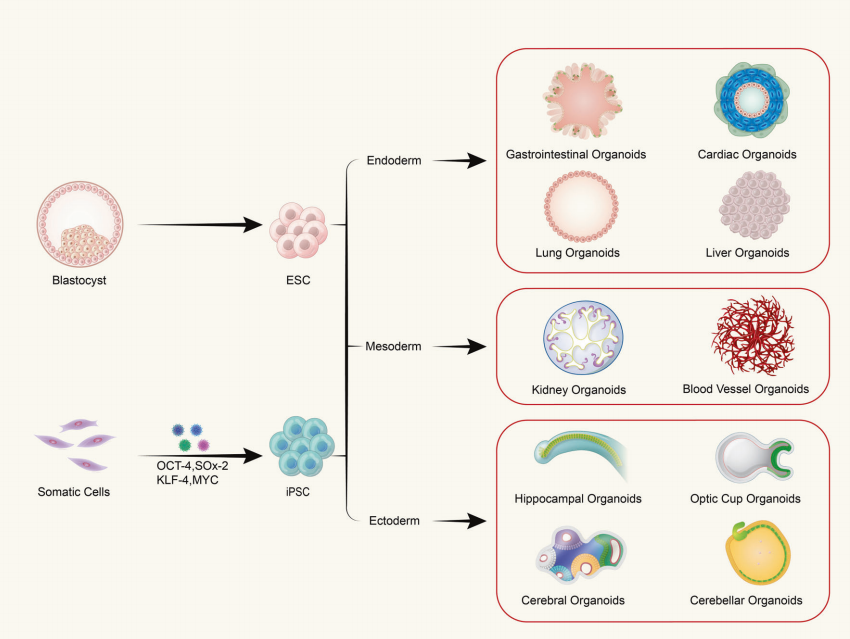
Q : Les organoïdes sont-ils composés d’un seul type de cellule ou de tissus multicellulaires ?
Les organoïdes sont formés à partir de la culture tridimensionnelle (3D) in vitro de cellules souches adultes ou de cellules souches pluripotentes, ce qui donne lieu à des structures ressemblant à des tissus avec une certaine organisation spatiale. Les organoïdes ne sont pas des structures composées de cellules individuelles ; ils sont plutôt formés en induisant la division et la différenciation de cellules initiatrices ayant des propriétés de cellules souches, qui s'auto-assemblent ensuite en tissus avec une certaine structure spatiale, une morphologie et une fonctionnalité similaires aux organes correspondants in vivo.
Q : Quelles sont les sources de culture des organoïdes ?
(1) Les organoïdes dérivés de cellules souches pluripotentes comprennent les cellules souches adultes (ASC), les cellules souches pluripotentes (PSC) et les cellules souches pluripotentes induites (iPSC). (2) Les organoïdes dérivés de cellules extraites de tissus se trouvent couramment dans les tissus tumoraux.
Q : Les tissus congelés peuvent-ils être utilisés pour la culture 3D en l’absence de tissus frais ?
Oui, mais les exigences en matière de taille des tissus congelés sont plus élevées et la viabilité des tissus et cellules congelés primaires diminuera considérablement, ce qui entraînera une réduction considérable du taux de réussite des cultures ultérieures.
Q : Comment les organoïdes sont-ils congelés et réanimés ?
Le moment optimal pour congeler les organoïdes se situe aux passages 2 à 5, lorsque l'activité et le potentiel de différenciation des organoïdes sont à leur maximum. La réanimation des organoïdes peut suivre les méthodes utilisées pour la réanimation cellulaire.
Q : Est-il nécessaire de contrôler la taille des organoïdes cultivés et est-il bénéfique s’ils sont trop gros ?
Oui, il est nécessaire de contrôler la taille, de préférence dans les 500 μm, car les organoïdes n'ont pas de systèmes vasculaires internes et de circulation gaz-liquide. Lorsque la taille des organoïdes est grande, les cellules proches du centre ont du mal à échanger de l'oxygène et des nutriments avec l'environnement extérieur. Par conséquent, plus la structure est grande, plus le nombre de cellules mortes est élevé.
Q : Outre l’utilisation du gel matriciel, que peut-on utiliser d’autre pour la culture des organoïdes ?
Outre le gel matriciel, les alternatives pour la culture d'organoïdes comprennent (1) la matrice extracellulaire décellularisée et d'autres protéines dérivées, (2) les hydrogels synthétiques et (3) les gels de protéines recombinantes conçus.
Q : Comment peut-on réaliser une différenciation dirigée des organoïdes ?
Le développement précoce de la différenciation induite par les cellules souches dans les organoïdes est régulé conjointement par de multiples voies de signalisation. La culture in vitro nécessite l'ajout de facteurs de croissance pour simuler l'activité de ces voies de signalisation, guidant les cellules à se différencier dans des directions spécifiques. Par exemple, l'induction avec Y27632 et Activin A peut différencier les cellules souches embryonnaires (ESC) ou les cellules souches pluripotentes induites (iPSC) en corps embryonnaires (EB). Par la suite, les voies de signalisation sont régulées par des facteurs tels que Wnt3a, FGF-4 et Noggin pour induire la différenciation des cellules souches dans des directions spécifiques.
Q : Comment éviter la contamination lors de l’obtention d’échantillons cliniques ?
(1) Assurer un échantillonnage aseptique autant que possible. (2) Avant l'extraction, immerger dans du PBS contenant des antibiotiques pendant plusieurs minutes : pour les tumeurs situées dans des zones de contact potentiel avec l'environnement extérieur, comme l'estomac, les intestins et la vessie, il est recommandé d'immerger dans du PBS contenant 3 à 5 % d'antibiotiques pendant 5 à 10 minutes ; pour les autres tumeurs courantes, immerger dans du PBS contenant 1 à 2 % d'antibiotiques pendant environ 5 minutes. (3) Tous les réactifs utilisés pendant l'extraction cellulaire doivent contenir 1 % d'antibiotiques et une concentration appropriée d'antibiotiques primaires.
Q : Quelles précautions faut-il prendre pour la collecte, la conservation et le transport des tissus tumoraux ?
Prélevez autant que possible les tissus tumoraux à forte teneur en cellules tumorales et minimisez le temps d'exposition des échantillons de tissus à l'air pour réduire la probabilité de contamination. Placez les échantillons de tissus tumoraux prélevés dans des tubes stériles contenant une solution spéciale de conservation des échantillons dès que possible et transportez-les rapidement vers l'unité de test à basse température (environ 4 °C) (essayez de livrer dans les 2 à 4 heures suivant le prélèvement).
Q : Existe-t-il une différence entre les organoïdes cultivés à partir de lésions et ceux cultivés à partir de tissus adjacents ?
Quelles sont les exigences relatives aux sites d'échantillonnage des tissus tumoraux ? Oui, il y a une différence. Les tumeurs elles-mêmes présentent une hétérogénéité, il est donc courant d'observer des différences entre les organoïdes dérivés de différentes sources. Morphologiquement, les organoïdes dérivés de lésions primaires ont tendance à avoir une structure plus invasive que ceux des tissus adjacents, apparaissant généralement plus irréguliers. Pour minimiser les erreurs de modélisation ou de dépistage de médicaments, plusieurs échantillons doivent être prélevés dans des zones présentant une bonne activité.
Q : Quels types de médicaments peuvent être utilisés pour les tests de sensibilité aux médicaments des organoïdes tumoraux ?
Les principaux types de médicaments antitumoraux utilisés en pratique clinique peuvent être classés en trois catégories : les médicaments cytotoxiques (tels que le paclitaxel, le cisplatine/carboplatine, le 5-FU, etc.), les médicaments ciblés (médicaments ciblant l'EGFR, l'HER2, le VEGFR, etc.) et les médicaments d'immunothérapie représentés par les inhibiteurs du point de contrôle immunitaire (anticorps PD-1, anticorps PD-L1, etc.).
Q : Quel est le taux de réussite de la culture de l’AOP ?
Le taux de réussite de la culture du PDO varie légèrement selon la source. La plupart des PDO ont un taux de réussite compris entre 63 % et 70 %, voire plus, jusqu'à 90 %, ce qui est largement corrélé à l'activité du tissu lui-même. De plus, les traitements cliniques peuvent affecter le taux de réussite. Les taux de réussite peuvent être améliorés en réduisant le temps de culture ex vivo du tissu et les étapes opérationnelles.
Q : Les tissus congelés peuvent-ils être utilisés pour la culture d’organoïdes ?
En règle générale, la cryoconservation des tissus n'est pas recommandée en raison d'une perte significative de viabilité. Cependant, si les tissus sont stockés à -80 °C, la fenêtre optimale pour la culture des organoïdes se situe dans les 6 semaines suivant la conservation. Si les tissus sont stockés dans de l'azote liquide, la durée de conservation peut être plus longue mais ne doit de préférence pas dépasser six mois.
Q : Lors de l'extraction de cellules primaires, des fibroblastes sont généralement mélangés. Comment faut-il les traiter ?
(1) En raison de la faible adhérence des fibroblastes, ils peuvent être éliminés par adhésion répétée.(2) Des réactifs d'élimination des fibroblastes peuvent être utilisés, mais il faut vérifier expérimentalement s'ils affectent la culture des organoïdes.
Q : Quelle quantité de tissu tumoral d'origine est nécessaire pour la culture d'organoïdes tumoraux ? L'échantillon de biopsie est-il suffisant ?
En général, les tissus chirurgicaux doivent être plus gros que 2 à 3 graines de soja ; s'ils sont obtenus par biopsie à l'aiguille, au moins 2 à 3 échantillons sont nécessaires, tandis que les biopsies endoscopiques nécessitent le clampage d'au moins six tissus tumoraux ou plus.
Q : Si l’échantillon de tissu tumoral est trop petit et que le nombre d’organoïdes cultivés est insuffisant pour les tests ultérieurs, que faut-il faire ?
Étant donné que les organoïdes dérivés de sources tumorales peuvent présenter des différences phénotypiques après le passage, le passage n'est généralement pas recommandé. Il est recommandé dans la littérature de limiter le passage des organoïdes à 2 ou 3 générations, avec un maximum de 5 générations. Si le nombre de cellules est trop faible et ne peut pas répondre aux exigences de test après 5 générations, envisagez de changer de méthode de test, par exemple en utilisant une plaque de 384 puits plus petite ou en essayant des puces microfluidiques pour les tests.
Q : Y aura-t-il des cellules normales dans les tissus tumoraux ? Comment éliminer ces cellules normales ?
Il peut y avoir un petit nombre de cellules normales. Tout d'abord, essayez d'éviter d'échantillonner des tissus normaux lors de la collecte. Deuxièmement, après avoir extrait les cellules primaires, le tri par billes magnétiques ou la cytométrie de flux peuvent être utilisés pour une culture ultérieure des organoïdes. Lorsqu'un très petit nombre de cellules normales est présent, cela n'affecte pas de manière significative la modélisation et la culture ultérieures des organoïdes, de sorte que l'élimination peut ne pas être nécessaire.
Q : Lors de l’extraction de cellules primaires à partir de tissus tumoraux, pourquoi les cellules apparaissent-elles rouges ?
Les tissus sont riches en sang in vivo, il y a donc beaucoup de globules rouges. Dans la plupart des cas, cela ne nécessite pas de traitement et n'affecte pas la culture des organoïdes. S'il y a trop de globules rouges, ils peuvent être traités de manière appropriée avec un tampon de lyse avant la culture.
Q : Lors de la culture d'organoïdes, des particules noires sont détectées. Comment les éliminer ?
Les particules noires sont très probablement des impuretés ou des débris cellulaires. Elles peuvent être éliminées de deux manières :
Digérer les organoïdes et les laver à plusieurs reprises avec du milieu pour diluer les impuretés.
Utilisez un bistouri stérile pour couper les organoïdes en deux, puis utilisez une seringue de 1 ml remplie de milieu pour éliminer délicatement les impuretés des organoïdes.
Q : Existe-t-il une limite au nombre de passages pour la culture d'organoïdes, et combien de passages peuvent être effectués ?
Le nombre de passages dépend généralement des propriétés des cellules sources. La plupart des organoïdes peuvent être passés in vitro jusqu'à 10 fois (> 6 mois). Le choix des conditions de culture peut également avoir une certaine influence, le milieu conditionné étant généralement supérieur au milieu synthétique.
Q : Les lignées cellulaires tumorales (telles que la lignée cellulaire HepG2) peuvent-elles être cultivées dans des PDO ?
Les PDO sont des structures auto-assemblées complexes. Les systèmes de culture 3D formés de lignées cellulaires uniques ne peuvent pas être appelés PDO ; ils sont simplement appelés états sphériques 3D.
Q : Quels sont les critères de passage des organoïdes ?
Selon le stade de développement des organoïdes, le temps de pontage varie généralement entre 5 et 10 jours, avec un diamètre d'environ 100 à 200 µm. Certains organoïdes à développement lent peuvent prendre plusieurs semaines pour atteindre un stade de pontage approprié.
Q : Comment compter le nombre d’organoïdes viables ?
Pendant l'expérience, retirez la solution de conservation de calcéine-AM préparée et ajoutez la solution de calcéine-AM au milieu jusqu'à une concentration finale de 0,2 μmol/L. Incubez à 37 °C pendant 60 minutes. Une fois le temps écoulé, rincez lentement le milieu contenant la calcéine-AM avec du PBS et ajoutez du milieu frais. Utilisez un microscope à fluorescence avec une longueur d'onde d'excitation de 490 nm et une longueur d'onde d'émission de 515 nm pour observer et photographier les organoïdes. Les organoïdes vivants apparaîtront verts et auront des bords clairs. Comptez les organoïdes d'un diamètre > 20 μm.
Q : Comment calculer la viabilité des organoïdes ?
La viabilité des organoïdes est calculée selon la formule : X=(Nlive/Ntotal)×100%, où : X représente la viabilité des organoïdes ; Nlive représente le nombre d'organoïdes vivants ; Ntotal représente le nombre total d'organoïdes.
Q : Quelles sont les méthodes d’identification des organoïdes ?
La méthode la plus simple consiste à observer la morphologie des organoïdes au microscope et à effectuer une coloration H&E. D'autres méthodes incluent le Western Blot, la qRT-PCR, l'immunofluorescence et la cytométrie de flux pour détecter si les organoïdes expriment les biomarqueurs correspondants. Le séquençage génétique peut identifier la correspondance génétique entre les organoïdes cultivés et le tissu source. Pour certains organoïdes, des tests fonctionnels peuvent être effectués pour voir s'ils possèdent des fonctions spécifiques. Par exemple, des études ont montré que les organoïdes gastriques peuvent sécréter de l'acide gastrique et que les organoïdes cardiaques peuvent battre de manière autonome.
Q : Les cellules normales peuvent-elles également se transformer en organoïdes ? Comment éliminer les organoïdes normaux lors de la culture d'organoïdes tumoraux ?
Les cellules normales peuvent également se transformer en organoïdes. Les méthodes permettant d'éliminer les organoïdes normaux comprennent : (1) la sélection manuelle basée sur les résultats de la coloration HE au microscope ; (2) la purification des PDO en ajustant la composition du milieu de culture (comme les facteurs de croissance/inhibiteurs de petites molécules) ; (3) la dispersion des PDO dans des cellules individuelles pour la cytométrie de flux ou le tri par billes magnétiques.
Q : Lors des expériences de sensibilité aux médicaments, les PDO doivent-ils être digérés à partir du gel matriciel ?
Non, les PDO ont besoin d'une structure tridimensionnelle pour simuler les conditions in vivo. S'il n'y a pas de support du gel matriciel, la précision des expériences de sensibilité aux médicaments sera affectée. En général, les médicaments solubles peuvent pénétrer le gel matriciel pour agir sur les organoïdes, mais lors de la réalisation d'expériences immunohistochimiques, il est nécessaire de retirer le gel matriciel.
Q : Les expériences PDO peuvent-elles remplacer complètement les modèles animaux (PDX) ?
Les PDO peuvent remplacer partiellement les PDX, mais ne peuvent pas les remplacer complètement.
Q : Quelles pourraient être les raisons de la croissance anormale des PDO pendant la culture, caractérisée par des cycles de croissance raccourcis et une prolifération rapide par rapport aux conditions précédentes ?
Facteurs externes : (1) Cette anomalie peut être causée par la croissance importante de certaines cellules contaminantes, telles que les fibroblastes. Dans de tels cas, il est recommandé de réaliser une coloration et une observation des coupes pour confirmer la présence de ces cellules contaminées, puis de procéder à leur élimination. (2) Des changements dans les conditions de culture, notamment l'ajout de certains facteurs ou de petites molécules, peuvent activer davantage les voies de prolifération des PDO.
Facteurs internes : Mutations génétiques possibles. Pour vérifier cela, il est recommandé de procéder à un séquençage et de comparer les résultats avec ceux des PDO primaires pour déterminer s'il existe des mutations génétiques.
Q : Comment peut-on tester la sensibilité des PDO aux médicaments ?
Les PDO peuvent être testés pour la sensibilité aux médicaments à l'aide de méthodes telles que le test CCK8, le test de viabilité cellulaire ATP et la coloration vivante/morte. L'évaluation de l'activité ATP des organoïdes tumoraux est la méthode la plus courante. L'ATP est la molécule énergétique la plus importante dans les cellules et peut être utilisée pour mesurer les niveaux métaboliques cellulaires, reflétant le nombre de cellules viables. En fonction de l'effet de l'administration du médicament sur la teneur en ATP cellulaire, la valeur IC50 (concentration inhibitrice à moitié maximale du médicament testé) pour chaque schéma thérapeutique peut être calculée à l'aide d'un logiciel d'analyse pour sélectionner les médicaments les plus efficaces pour l'inhibition tumorale.
Q : Les plages de concentration pour les expériences de sensibilité aux médicaments des PDO sont-elles les mêmes que celles des cellules tumorales primaires ?
Non, ce ne sont pas les mêmes. En règle générale, la concentration de médicament pour les PDO doit être supérieure à celle des cellules primaires. Des expériences préliminaires peuvent être menées pour analyser les concentrations optimales pour les expériences formelles de sensibilité aux médicaments.
Q : À quel stade de croissance les organoïdes doivent-ils être utilisés pour les tests de médicaments ?
Il est généralement recommandé d'utiliser des organoïdes dans les 5 passages pour les tests de médicaments. À ce stade, les organoïdes présentent la meilleure stabilité et la meilleure activité.
Q : Quels sont les critères permettant de déterminer le succès de l’établissement d’organoïdes ?
(1) Évaluation préliminaire précoce : la morphologie des organoïdes passe d'un état cellulaire à des formes telles que vacuolaire, bourgeonnante, compacte ou lâche. (2) Identification de l'expression de biomarqueurs spécifiques, qui devraient être similaires à la distribution dans les tranches de tissu. Une analyse de séquençage plus poussée peut être effectuée pour des comparaisons plus détaillées.
Q : En quoi la culture d’organoïdes diffère-t-elle de la culture cellulaire classique ?
(1) Différentes méthodes de culture cellulaire : les organoïdes nécessitent le support de substrats ou de structures spatiales pour maintenir leur structure tridimensionnelle, alors que la culture cellulaire classique n'en a pas besoin. (2) La culture des organoïdes nécessite une différenciation et un auto-assemblage ex vivo, ce qui nécessite l'utilisation de combinaisons de diverses cytokines pour l'induction, ce qui donne lieu à des composants de milieu de culture relativement complexes. La culture cellulaire classique n'implique généralement qu'un seul type de cellule, de sorte que les composants du milieu de culture sont relativement simples.(3) Différentes sources de cellules : les organoïdes sont dérivés de cellules épithéliales multipotentes, tandis que la culture cellulaire ordinaire convient à la culture de divers types de cellules sélectionnées.
Q : Comment puis-je déterminer si les sphères 3D que j’ai cultivées sont des organoïdes et si elles sont cohérentes avec le tissu cible ?
Les méthodes d'identification des organoïdes comprennent la coloration H&E, l'immunohistochimie (IHC), le séquençage de cellules individuelles et d'autres. Il est nécessaire de faire des jugements multidimensionnels à partir de perspectives morphologiques, histopathologiques et génétiques moléculaires pour déterminer s'ils sont cohérents avec l'organe ou le tissu cible. Pour les organoïdes tumoraux, la détection de biomarqueurs spécifiques peut être utilisée pour confirmation.
Q : Si la morphologie des organoïdes observés pendant la culture diffère de ce qui est rapporté dans la littérature, quelle pourrait en être la raison ?
Premièrement, des différences individuelles et une hétérogénéité dans les sources et les sous-types d'échantillons peuvent exister. Deuxièmement, des différences dans la qualité des cytokines sélectionnées et de certains inhibiteurs à petites molécules utilisés pour l'induction peuvent entraîner des variations dans la morphologie de différenciation des différents organoïdes. Il est suggéré de confirmer la cohérence entre la morphologie des organoïdes et le tissu source par des méthodes telles que la coloration HE, l'IHC et le séquençage génétique, plutôt que de se fier uniquement aux descriptions de la littérature.
Q : Lors de la réalisation d’expériences de sensibilité aux médicaments avec des organoïdes, est-il nécessaire de contrôler la quantité de DMSO utilisée comme solvant pour les médicaments ?
Oui, les expériences de sensibilité aux médicaments nécessitent généralement que le pourcentage volumique de DMSO soit inférieur à 0,5 %.
Q : Comment les organoïdes peuvent-ils être récupérés à partir du gel matriciel ?
Les méthodes suivantes sont recommandées : (1) Les solutions de récupération d'organoïdes disponibles dans le commerce (CAT#41421ES) peuvent être utilisées pour obtenir des suspensions cellulaires en douceur et efficacement sans endommager les cellules ou les protéines de surface cellulaire. (2) Le gel de matrice peut être décongelé à basse température pour le ramollir et libérer les organoïdes.
Q : De nombreux organoïdes adhèrent aux parois du tube à centrifuger pendant la récupération. Comment le taux de récupération peut-il être amélioré ?
Lors de la centrifugation après la collecte, utiliser une centrifugeuse à rotor horizontal et augmenter la vitesse de centrifugation en conséquence. En général, une force centrifuge d'environ 300 g et une vitesse d'environ 1 000 à 1 200 tr/min sont appropriées.
Cytokines apparentées information
| Pproduit Nmoi | CHAT | Taille |
| Wnt-3a humain | 92276ES10 | 10μg |
| 92278ES20 | 20μg | |
| 92701ES10 | 10μg | |
| Noggin humain | 92528ES10 | 10μg |
| 91330ES10 | 10μg | |
| 91306ES10 | 10μg | |
| 91502ES10 | 10μg | |
| 91701ES08 | 10μg | |
| 92602ES60 | 100μg | |
| 91204ES10 | 10μg | |
| 90601ES10 | 10μg | |
| 91113ES10 | 10μg | |
| 92279ES10 | 10μg | |
| 92055ES10 | 10μg | |
| 92053ES10 | 10μg | |
| 92129ES08 | 5μg | |
| 91304ES10 | 10μg | |
| 91702ES10 | 10μg | |
| 92252ES60 | 100μg | |
| 90103ES10 | 10μg | |
| 90104ES10 | 10μg | |
| 90197ES10 | 10μg | |
| 90144ES08 | 10μg | |
| 90196ES10 | 10μg | |
| 90194ES10 | 10μg | |
| 90111ES10 | 10μg | |
| 90120ES10 | 10μg | |
| 90198ES10 | 10μg | |
| 91605ES10 | 10μg | |
| 92251ES10 | 10μg | |
| 92566ES08 | 5μg | |
| 92102ES10 | 10μg | |
| 91103ES10 | 10μg | |
| 92711ES10 | 10μg | |
| 92122ES60 | 100μg | |
| 92201ES60 | 100μg | |
| 92275ES20 | 20μg | |
| BMP-2 humaine | 92051ES10 | 10μg |
Lectures connexes :
Référence
