Con l'approfondimento della ricerca sugli organoidi, un numero crescente di individui si sta unendo. Questo articolo riassume alcuni punti di conoscenza comuni sugli organoidi [1-5], sperando di essere utile a tutti.
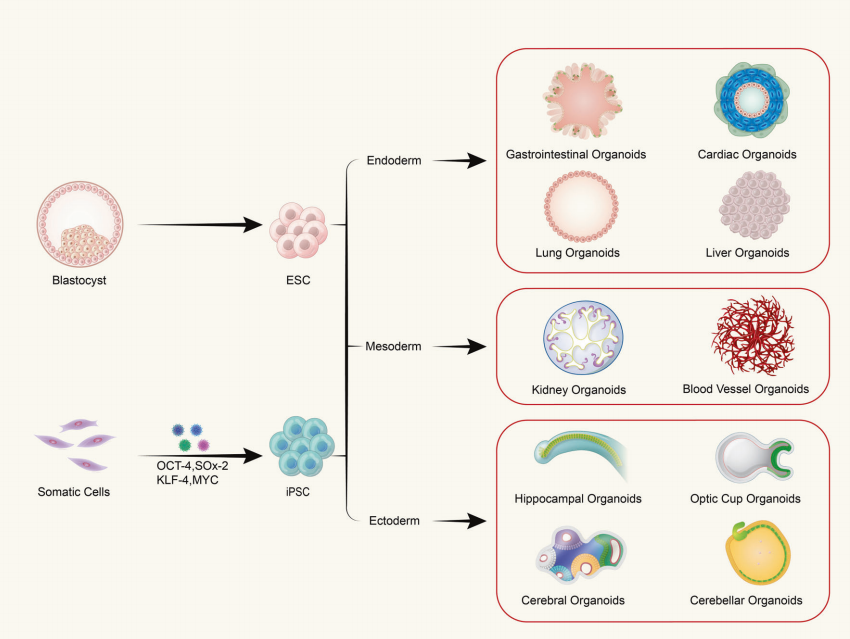
D: Gli organoidi sono composti da un singolo tipo di cellula o da tessuti multicellulari?
Gli organoidi si formano dalla coltura tridimensionale (3D) in vitro di cellule staminali adulte o cellule staminali pluripotenti, dando origine a strutture simili a tessuti con una certa organizzazione spaziale. Gli organoidi non sono strutture composte da singole cellule; piuttosto, si formano inducendo la divisione e la differenziazione di cellule iniziatrici con proprietà di cellule staminali, che poi si autoassemblano in tessuti con una certa struttura spaziale, morfologia e funzionalità simili agli organi corrispondenti in vivo.
D: Quali sono le fonti per la coltura degli organoidi?
(1) Gli organoidi derivati da cellule staminali pluripotenti includono cellule staminali adulte (ASC), cellule staminali pluripotenti (PSC) e cellule staminali pluripotenti indotte (iPSC). (2) Gli organoidi derivati da cellule estratte dai tessuti si trovano comunemente nei tessuti tumorali.
D: Il tessuto congelato può essere utilizzato per la coltivazione 3D in assenza di tessuto fresco?
Sì, ma ci sono requisiti più elevati per quanto riguarda le dimensioni del tessuto congelato e la vitalità del tessuto e delle cellule congelati primari diminuirà in modo significativo, portando a un tasso di successo notevolmente ridotto nella coltivazione successiva.
D: Come vengono congelati e rianimati gli organoidi?
Il momento ottimale per congelare gli organoidi è nei passaggi 2-5, quando l'attività e il potenziale di differenziazione degli organoidi sono al massimo. La rianimazione degli organoidi può seguire i metodi utilizzati per la rianimazione cellulare.
D: È necessario controllare le dimensioni degli organoidi coltivati? È utile se sono troppo grandi?
Sì, è necessario controllare le dimensioni, preferibilmente entro 500μm, poiché gli organoidi non hanno sistemi di circolazione interna vascolare e gas-liquido. Quando le dimensioni degli organoidi sono grandi, le cellule vicine al centro hanno difficoltà a scambiare ossigeno e nutrienti con l'ambiente esterno. Pertanto, più grande è la struttura, maggiore è il numero di cellule morte.
D: Oltre al gel matrice, cos'altro può essere utilizzato per coltivare gli organoidi?
Oltre al gel di matrice, le alternative per la coltura degli organoidi includono (1) matrice extracellulare decellularizzata e altre proteine derivate, (2) idrogel sintetici e (3) gel proteici ricombinanti ingegnerizzati.
D: Come si può ottenere la differenziazione mirata degli organoidi?
Lo sviluppo precoce della differenziazione indotta dalle cellule staminali negli organoidi è regolato congiuntamente da molteplici vie di segnalazione. La coltivazione in vitro richiede l'aggiunta di fattori di crescita per simulare l'attività di queste vie di segnalazione, guidando le cellule a differenziarsi in direzioni specifiche. Ad esempio, l'induzione con Y27632 e Activin A può differenziare le cellule staminali embrionali (ESC) o le cellule staminali pluripotenti indotte (iPSC) in corpi embrionali (EB). Successivamente, le vie di segnalazione sono regolate da fattori come Wnt3a, FGF-4 e Noggin per indurre la differenziazione delle cellule staminali in direzioni specifiche.
D: Come si può evitare la contaminazione quando si ottengono campioni clinici?
(1) Garantire il campionamento asettico il più possibile. (2) Prima dell'estrazione, immergere in PBS contenente antibiotici per diversi minuti: per i tumori situati in aree con potenziale contatto con l'ambiente esterno, come stomaco, intestino e vescica, si consiglia di immergere in PBS contenente antibiotici al 3%-5% per 5-10 minuti; per altri tumori comuni, immergere in PBS contenente antibiotici all'1%-2% per circa 5 minuti. (3) Tutti i reagenti utilizzati durante l'estrazione cellulare devono contenere antibiotici all'1% e una concentrazione appropriata di antibiotici primari.
D: Quali precauzioni devono essere adottate per la raccolta, la conservazione e il trasporto dei tessuti tumorali?
Raccogliere il più possibile tessuti tumorali con un alto contenuto di cellule tumorali e ridurre al minimo il tempo di esposizione dei campioni di tessuto all'aria per ridurre la probabilità di contaminazione. Collocare i campioni di tessuto tumorale raccolti in provette sterili contenenti una speciale soluzione di conservazione del campione il prima possibile e trasportarli rapidamente all'unità di test a bassa temperatura (circa 4°C) (cercare di consegnarli entro 2~4 ore dal campionamento).
D: Esiste una differenza tra gli organoidi coltivati da lesioni e quelli coltivati da tessuti adiacenti?
Quali sono i requisiti per i siti di campionamento dei tessuti tumorali? Sì, c'è una differenza. I tumori stessi mostrano eterogeneità, quindi è comune osservare differenze tra organoidi derivati da fonti diverse. Morfologicamente, gli organoidi derivati da lesioni primarie tendono ad avere una struttura più invasiva rispetto a quelli dei tessuti adiacenti, apparendo generalmente più irregolari. Per ridurre al minimo gli errori nella modellazione o nello screening dei farmaci, è necessario prelevare più campioni da aree con buona attività.
D: Quali tipi di farmaci possono essere utilizzati per i test di sensibilità farmacologica degli organoidi tumorali?
I principali tipi di farmaci antitumorali nella pratica clinica possono essere classificati in tre categorie: farmaci citotossici (come paclitaxel, cisplatino/carboplatino, 5-FU, ecc.), farmaci mirati (farmaci che hanno come bersaglio EGFR, HER2, VEGFR, ecc.) e farmaci immunoterapici rappresentati da inibitori dei checkpoint immunitari (anticorpi PD-1, anticorpi PD-L1, ecc.).
D: Qual è il tasso di successo della coltivazione DOP?
Il tasso di successo della coltivazione di PDO varia leggermente a seconda della fonte. La maggior parte dei PDO ha un tasso di successo tra il 63% e il 70%, o anche più alto, fino al 90%, che è ampiamente correlato all'attività del tessuto stesso. Inoltre, i trattamenti clinici possono influenzare il tasso di successo. I tassi di successo possono essere migliorati riducendo il tempo di tessuto ex vivo e le fasi operative.
D: Il tessuto congelato può essere utilizzato per la coltivazione di organoidi?
In genere, la crioconservazione dei tessuti non è raccomandata a causa della significativa perdita di vitalità. Tuttavia, se i tessuti vengono conservati a -80°C, la finestra ottimale per la coltivazione di organoidi è entro 6 settimane dalla conservazione. Se i tessuti vengono conservati in azoto liquido, il tempo di conservazione può essere più lungo ma preferibilmente non superare i sei mesi.
D: Quando si estraggono cellule primarie, di solito ci sono fibroblasti mescolati. Come dovrebbero essere trattati?
(1) A causa della scarsa adesione dei fibroblasti, questi possono essere rimossi mediante ripetute adesioni.(2) Possono essere utilizzati reagenti per la rimozione dei fibroblasti, ma è necessaria una convalida sperimentale per stabilire se influenzino la coltivazione degli organoidi.
D: Quanto tessuto tumorale originale è necessario per la coltura degli organoidi tumorali? Il campione bioptico è sufficiente?
In genere, i tessuti chirurgici devono essere più grandi di 2-3 semi di soia; se ottenuti tramite biopsia con ago, sono necessari almeno 2-3 campioni, mentre le biopsie endoscopiche richiedono almeno sei o più tessuti tumorali da pinzare.
D: Cosa si deve fare se il campione di tessuto tumorale è troppo piccolo e il numero di organoidi coltivati è insufficiente per i test successivi?
Poiché gli organoidi derivati da fonti tumorali possono presentare differenze fenotipiche dopo il passaggio, il passaggio è generalmente sconsigliato. In letteratura si raccomanda di limitare il passaggio degli organoidi a 2-3 generazioni, con un massimo di 5 generazioni. Se il numero di cellule è troppo piccolo e non può soddisfare i requisiti di test dopo 5 generazioni, si consideri di cambiare il metodo di test, ad esempio utilizzando una piastra più piccola da 384 pozzetti o provando chip microfluidici per il test.
D: Ci saranno cellule normali nei tessuti tumorali? Come si rimuovono queste cellule normali?
Potrebbe esserci un piccolo numero di cellule normali. Innanzitutto, cercare di evitare di campionare tessuti normali durante la raccolta. In secondo luogo, dopo l'estrazione delle cellule primarie, è possibile utilizzare la selezione con microsfere magnetiche o la citometria a flusso per un'ulteriore coltivazione di organoidi. Quando è presente un numero molto piccolo di cellule normali, ciò non influisce in modo significativo sulla successiva modellazione e coltivazione di organoidi, quindi la rimozione potrebbe non essere necessaria.
D: Perché quando si estraggono cellule primarie dai tessuti tumorali, le cellule appaiono rosse?
I tessuti sono ricchi di apporto di sangue in vivo, quindi ci sono molti globuli rossi. Nella maggior parte dei casi, questo non richiede elaborazione e non influisce sulla coltivazione degli organoidi. Se ci sono troppi globuli rossi, possono essere trattati in modo appropriato con tampone di lisi prima della coltivazione.
D: Durante la coltivazione degli organoidi, si trovano particelle nere. Come rimuoverle?
Le particelle nere sono molto probabilmente impurità o detriti cellulari. Possono essere rimosse in due modi:
Digerire gli organoidi e lavarli ripetutamente con il mezzo per diluire le impurità.
Utilizzare un bisturi sterile per tagliare a metà gli organoidi, quindi utilizzare una siringa da 1 ml riempita di terreno per eliminare delicatamente le impurità dagli organoidi.
D: Esiste un limite al numero di passaggi per la coltivazione di organoidi e quanti passaggi possono essere effettuati?
Il numero di passaggi dipende generalmente dalle proprietà delle cellule di origine. La maggior parte degli organoidi può essere sottoposta a passaggi in vitro fino a 10 volte (>6 mesi). Anche la scelta delle condizioni di coltura può avere una certa influenza, con il mezzo condizionato generalmente superiore al mezzo di fattore sintetico.
D: Le linee cellulari tumorali (come la linea cellulare HepG2) possono essere coltivate in PDO?
Le PDO sono strutture complesse autoassemblate. I sistemi di coltura 3D formati da singole linee cellulari non possono essere chiamati PDO; sono semplicemente definiti stati sferici 3D.
D: Quali sono i criteri per il passaggio degli organoidi?
A seconda dello stato di sviluppo degli organoidi, il tempo varia, solitamente tra 5 e 10 giorni, con un diametro di circa 100-200μm. Alcuni organoidi a lento sviluppo potrebbero impiegare diverse settimane per raggiungere uno stato di passaggio adatto.
D: Come contare il numero di organoidi vitali?
Durante l'esperimento, estrarre la soluzione di conservazione Calcein-AM preparata in precedenza e aggiungere la soluzione Calcein-AM al mezzo fino a una concentrazione finale di 0,2 μmol/L. Incubare a 37 °C per 60 minuti. Dopo che il tempo è trascorso, lavare lentamente via il mezzo contenente Calcein-AM con PBS e aggiungere mezzo fresco. Utilizzare un microscopio a fluorescenza con una lunghezza d'onda di eccitazione di 490 nm e una lunghezza d'onda di emissione di 515 nm per osservare e fotografare gli organoidi. Gli organoidi vivi appariranno verdi e avranno bordi chiari. Contare gli organoidi con un diametro >20 μm.
D: Come si calcola la vitalità degli organoidi?
La vitalità degli organoidi viene calcolata secondo la formula: X=(Nvivi/Ntotale)×100%, dove: X rappresenta la vitalità degli organoidi; Nvivi rappresenta il numero di organoidi vivi; Ntotale rappresenta il numero totale di organoidi.
D: Quali sono i metodi per identificare gli organoidi?
Il metodo più elementare è osservare la morfologia degli organoidi tramite un microscopio ed eseguire la colorazione H&E. Ulteriori metodi includono Western Blot, qRT-PCR, immunofluorescenza, citometria a flusso per rilevare se gli organoidi esprimono i corrispondenti biomarcatori. Il sequenziamento genetico può identificare la corrispondenza genetica tra gli organoidi coltivati e il tessuto di origine. Per alcuni organoidi, possono essere condotti test funzionali per vedere se possiedono funzioni specifiche. Ad esempio, gli studi hanno dimostrato che gli organoidi gastrici possono secernere acido gastrico e gli organoidi cardiaci possono battere autonomamente.
D: Anche le cellule normali possono trasformarsi in organoidi? Come rimuovere gli organoidi normali durante la coltivazione di organoidi tumorali?
Anche le cellule normali possono crescere in organoidi. I metodi per rimuovere gli organoidi normali includono: (1) Selezione manuale basata sui risultati della colorazione HE al microscopio; (2) Purificazione dei PDO regolando la composizione del mezzo di coltura (come fattori di crescita/inibitori di piccole molecole); (3) Dispersione dei PDO in singole cellule per citometria a flusso o ordinamento con biglie magnetiche.
D: Durante gli esperimenti sulla sensibilità ai farmaci, i PDO devono essere digeriti dal gel della matrice?
No, i PDO necessitano di una struttura tridimensionale per simulare le condizioni in vivo. Se non c'è supporto dal gel matrice, l'accuratezza degli esperimenti sulla sensibilità ai farmaci sarà influenzata. In genere, i farmaci solubili possono penetrare nel gel matrice per agire sugli organoidi, ma quando si conducono esperimenti immunocitochimici, è necessario rimuovere il gel matrice.
D: Gli esperimenti PDO possono sostituire completamente i modelli animali (PDX)?
I PDO possono sostituire parzialmente i PDX, ma non completamente.
D: Quali potrebbero essere le ragioni della crescita anomala delle DOP durante la coltivazione, caratterizzata da cicli di crescita più brevi e da una proliferazione rapida rispetto alle condizioni precedenti?
Fattori esterni: (1) Questa anomalia può essere causata dalla crescita estesa di alcune cellule contaminanti, come i fibroblasti. In tali casi, si raccomanda di eseguire la colorazione e l'osservazione delle sezioni per confermare la presenza di queste cellule contaminate e quindi procedere alla loro rimozione. (2) Le modifiche nelle condizioni di coltura, inclusa l'aggiunta di alcuni fattori o piccole molecole, possono ulteriormente attivare i percorsi di proliferazione dei PDO.
Fattori interni: Possibili mutazioni genetiche. Per verificarlo, si raccomanda il sequenziamento e i risultati dovrebbero essere confrontati con quelli dei PDO primari per determinare se ci sono mutazioni genetiche.
D: Come si può testare la sensibilità dei PDO ai farmaci?
I PDO possono essere testati per la sensibilità ai farmaci utilizzando metodi quali il test CCK8, il test di vitalità cellulare ATP e la colorazione vivo/morto. La valutazione dell'attività ATP degli organoidi tumorali è il metodo più comune. L'ATP è la molecola energetica più importante nelle cellule e può essere utilizzata per misurare i livelli metabolici cellulari, riflettendo il numero di cellule vitali. Sulla base dell'effetto della somministrazione del farmaco sul contenuto cellulare di ATP, il valore IC50 (concentrazione inibitoria semi-massimale del farmaco testato) per ciascun regime farmacologico può essere calcolato utilizzando un software di analisi per selezionare i farmaci più efficaci per l'inibizione del tumore.
D: Gli intervalli di concentrazione per gli esperimenti sulla sensibilità ai farmaci dei PDO sono gli stessi di quelli per le cellule tumorali primarie?
No, non sono la stessa cosa. In genere, la concentrazione del farmaco per i PDO deve essere più alta di quella per le cellule primarie. Si possono condurre esperimenti preliminari per analizzare le concentrazioni ottimali per gli esperimenti formali di sensibilità al farmaco.
D: In quale fase della crescita gli organoidi dovrebbero essere utilizzati per i test sui farmaci?
In genere si raccomanda di utilizzare organoidi entro 5 passaggi per i test antidroga. In questa fase, gli organoidi mostrano la migliore stabilità e attività.
D: Quali sono i criteri per determinare il successo dell'insediamento degli organoidi?
(1) Valutazione preliminare precoce: la morfologia degli organoidi cambia da uno stato cellulare a forme come vacuolare, in gemmazione, compatta o lassa. (2) Identificazione dell'espressione di specifici biomarcatori, che dovrebbe essere simile alla distribuzione nelle fette di tessuto. Ulteriori analisi di sequenziamento possono essere eseguite per confronti più dettagliati.
D: In che modo la coltivazione di organoidi differisce dalla normale coltura cellulare?
(1) Diversi metodi di coltura cellulare: gli organoidi richiedono il supporto di substrati o strutture spaziali per mantenere la loro struttura tridimensionale, mentre la normale coltura cellulare non lo richiede. (2) La coltura organoide richiede il raggiungimento di differenziazione ex vivo e autoassemblaggio, richiedendo quindi l'uso di combinazioni di varie citochine per l'induzione, con conseguenti componenti del mezzo di coltura relativamente complessi. La normale coltura cellulare di solito coinvolge solo un singolo tipo di cellula, quindi i componenti del mezzo di coltura sono relativamente semplici.(3) Diverse fonti cellulari: gli organoidi derivano da cellule epiteliali multipotenti, mentre la normale coltura cellulare è adatta per coltivare vari tipi di cellule selezionate.
D: Come posso determinare se le sfere 3D che ho coltivato sono organoidi e se sono compatibili con il tessuto target?
I metodi per identificare gli organoidi includono la colorazione H&E, l'immunoistochimica (IHC), il sequenziamento di singole cellule e altri. È necessario formulare giudizi multidimensionali da prospettive morfologiche, istopatologiche e genetiche molecolari per determinare se sono coerenti con l'organo o il tessuto bersaglio. Per gli organoidi tumorali, il rilevamento di biomarcatori specifici può essere utilizzato per la conferma.
D: Se la morfologia degli organoidi osservata durante la coltivazione differisce da quanto riportato in letteratura, quale potrebbe essere il motivo?
In primo luogo, potrebbero esserci differenze individuali ed eterogeneità nelle fonti e nei sottotipi dei campioni. In secondo luogo, le differenze nella qualità di citochine selezionate e di alcuni inibitori di piccole molecole utilizzati per l'induzione potrebbero portare a variazioni nella morfologia di differenziazione di diversi organoidi. Si suggerisce di confermare la coerenza tra la morfologia dell'organoide e il tessuto di origine attraverso metodi quali colorazione HE, IHC e sequenziamento genetico, piuttosto che basarsi esclusivamente sulle descrizioni della letteratura.
D: Quando si conducono esperimenti sulla sensibilità ai farmaci con organoidi, è necessario controllare la quantità di DMSO utilizzata come solvente per i farmaci?
Sì, in genere gli esperimenti sulla sensibilità ai farmaci richiedono che la percentuale in volume di DMSO sia inferiore allo 0,5%.
D: Come si possono recuperare gli organoidi dal gel della matrice?
Si raccomandano i seguenti metodi: (1) Le soluzioni di recupero degli organoidi disponibili in commercio (CAT#41421ES) possono essere utilizzate per ottenere sospensioni cellulari in modo delicato ed efficace senza danneggiare le cellule o le proteine della superficie cellulare. (2) Il gel della matrice può essere scongelato a bassa temperatura per ammorbidirlo e rilasciare gli organoidi.
D: Molti organoidi aderiscono alle pareti della provetta da centrifuga durante il recupero. Come si può migliorare il tasso di recupero?
Quando si centrifuga dopo la raccolta, utilizzare una centrifuga a rotore orizzontale e aumentare la velocità di centrifugazione in modo appropriato. In genere, sono adatte una forza centrifuga di circa 300 g e una velocità di circa 1000-1200 giri/min.
Citochine correlate informazioni
| Pprodotto Nio sono | GATTO | Misurare |
| Wnt-3a umano | 92276ES10 | 10ioG |
| 92278ES20 | 20ioG | |
| 92701ES10 | 10ioG | |
| Testa umana | 92528ES10 | 10ioG |
| 91330ES10 | 10ioG | |
| 91306ES10 | 10ioG | |
| 91502ES10 | 10ioG | |
| 91701ES08 | 10ioG | |
| 92602ES60 | 100ioG | |
| 91204ES10 | 10ioG | |
| 90601ES10 | 10ioG | |
| 91113ES10 | 10ioG | |
| 92279ES10 | 10ioG | |
| 92055ES10 | 10ioG | |
| 92053ES10 | 10ioG | |
| 92129ES08 | 5ioG | |
| 91304ES10 | 10ioG | |
| 91702ES10 | 10ioG | |
| 92252ES60 | 100ioG | |
| 90103ES10 | 10ioG | |
| 90104ES10 | 10ioG | |
| 90197ES10 | 10ioG | |
| 90144ES08 | 10ioG | |
| 90196ES10 | 10ioG | |
| 90194ES10 | 10ioG | |
| 90111ES10 | 10ioG | |
| 90120ES10 | 10ioG | |
| 90198ES10 | 10ioG | |
| 91605ES10 | 10ioG | |
| 92251ES10 | 10ioG | |
| 92566ES08 | 5ioG | |
| 92102ES10 | 10ioG | |
| 91103ES10 | 10ioG | |
| 92711ES10 | 10ioG | |
| 92122ES60 | 100ioG | |
| 92201ES60 | 100ioG | |
| 92275ES20 | 20ioG | |
| BMP-2 umano | 92051ES10 | 10ioG |
Letture correlate:
Riferimento
