체외 세포 형질 전환 시약 제품 선택 가이드
세포 형질감염 시약은 진핵 세포에서 유전자 기능을 연구하고 제어하는 데 사용되는 일상적인 시약이 되었습니다. 형질감염 시약은 유전자 기능 연구, 유전자 발현 조절 및 돌연변이 분석, 유전자 치료, 세포 치료, 단백질 생산 및 백신 생산에 널리 사용됩니다. 그렇다면 형질감염이란 무엇일까요? 그리고 실험에 따라 어떤 종류의 형질감염 시약을 선택해야 할까요?
형질감염에는 어떤 종류가 있나요?
실험에 따라 어떤 종류의 형질전환 시약을 선택해야 합니까?
적용 사례
형질감염 조건에 대한 참고사항
자주 묻는 질문
독서에 관하여
형질감염에는 어떤 종류가 있나요?
핵산이 형질감염 후 숙주 세포 염색체에 통합되는지 여부에 따라 "일시적"(일시적 형질감염)과 "안정적"(안정적 형질감염)으로 나뉩니다. 다양한 형질감염 방법의 형질감염 효율, 세포독성, 정상 생리학에 대한 영향 및 유전자 발현 수준은 다릅니다. 원리, 응용 프로그램 및 특성은 다음 표에서 비교됩니다.
표 1 다양한 형질전환 방법의 비교
|
기술 |
원칙 |
장점 |
단점 |
|
화학적 형질전환 방법 |
|||
|
양이온 리포좀 |
양전하를 띤 리포좀은 음전하를 띤 핵산의 인산기와 복합체를 형성하고 세포에 의해 세포 내로 흡수됩니다. |
|
|
|
인산칼슘 공침 |
인산칼슘 DNA 복합체는 세포막에 흡착되어 세포에 의해 세포 내로 흡수됩니다. |
|
|
|
덱스트란 |
양전하를 띤 DEAE-덱스트란과 음전하를 띤 핵산의 인산 골격이 상호 작용하여 형성된 복합체는 세포에 의해 세포 내로 흡수됩니다. |
|
|
|
기타 양이온성 고분자 |
양전하를 띤 중합체는 핵산의 음전하를 띤 인산기와 양전하를 띤 복합체를 형성한 후, 세포 표면의 음전하를 띤 프로테오글리칸과 상호 작용하고, 세포 내포작용을 통해 세포로 들어갑니다. |
|
|
|
바이오트랜스펙션 방법 |
|||
|
바이러스 형질감염 |
본능은 세포를 감염시키고 유전 물질을 전달합니다. |
|
|
|
물리적 형질전환 방법 |
|||
|
전기 전송 |
높은 펄스 전압은 세포막 전위를 교란시키고, DNA는 세포막에 형성된 구멍을 통해 도입됩니다. |
|
|
|
생물 전달 입자 전달 (입자 폭격) |
DNA는 미세한 중금속 입자와 함께 침전된 후, 코팅된 입자가 탄도 장치를 이용해 세포 내부로 투사됩니다. DNA는 점차적으로 세포 내에서 방출되어 발현됩니다. |
|
|
|
미세주입 |
미세조작법은 표적 세포의 핵에 DNA를 직접 주입하는 데 사용됩니다. |
|
|
Yeasen 의 트랜스펙션 시약의 특징
DNA 트랜스펙션 시약과 RNA 트랜스펙션 시약의 경우,
|
Hieff Trans™ 서스펜션 셀프리 리포좀 트랜스펙션 시약 |
|
|
40802ES |
40805ES |
|
40806ES |
40816ES |
- 높은 효율성: 세포주에 대한 일시적 형질감염이나 안정적 형질감염에 적합합니다.
- 독성이 낮음: 형질전환된 세포는 생존력이 좋습니다.
- 폭넓은 적응성: 일반 세포와 형질전환이 어려운 일차 세포를 포괄적으로 포괄합니다.
- 사용이 간편합니다. 혈청이 존재하는 배지에 적합하며, 형질전환 전후에 배지를 교체할 필요가 없습니다.
- 비용 효율성: 경제적이고 실용적이며, 형질감염 효율이 높고 가격이 저렴합니다.
실험에 따라 어떤 종류의 형질전환 시약을 선택해야 합니까?
형질전환 시약의 선택은 형질전환 물질, 특정 세포, 조작 편의성 및 기타 요소와 같은 다양한 실험 목적 및 실험 내용에 따라 선택해야 합니다.
|
제품 |
Hieff Trans™ 서스펜션 셀프리 리포좀 트랜스펙션 시약 |
|||
|
세포 유형 |
기존 셀 |
기존 셀 |
기존 셀 |
기존 셀 |
|
/ |
/ |
형질전환이 어려운 세포 |
형질전환이 어려운 세포 |
|
|
핵산의 종류 |
DNA |
DNA |
/ |
DNA |
|
siRNA |
siRNA |
siRNA |
/ |
|
|
/ |
/ |
미르나(miRNA) |
/ |
|
|
/ |
/ |
miRNA를 모방하다 |
/ |
|
|
/ |
/ |
항미르나 |
/ |
|
|
DNA/siRNA 공동 형질 전환 |
DNA/siRNA 공동 형질 전환 |
/ |
/ |
|
|
바이러스 패키징 |
바이러스 패키징 |
/ |
바이러스 패키징 |
적용 사례
Hieff Trans™는 멸균 액상 형태로 공급됩니다. 일반적으로 24웰 플레이트 트랜스펙션의 경우, 한 번에 약 1.5 μL, 1 mL의 Hieff Trans™는 약 660회의 트랜스펙션을 수행할 수 있습니다. 6웰 플레이트의 경우, 한 번에 약 6 μL, 1 mL의 Hieff Trans™는 약 660회의 트랜스펙션을 수행할 수 있습니다. 160회의 트랜스펙션;
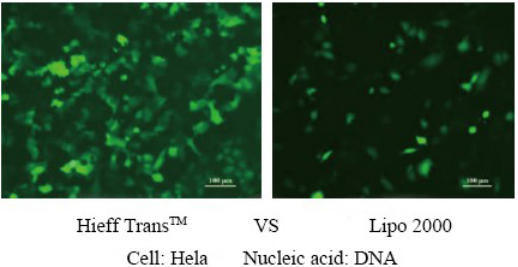
자세한 내용은 Hieff Trans™ Lipofectamine Reagent를 사용한 트랜스펙션의 확신을 참조하세요.
폴리에틸렌이민 선형(PEI) MW40000(빠른 용해)
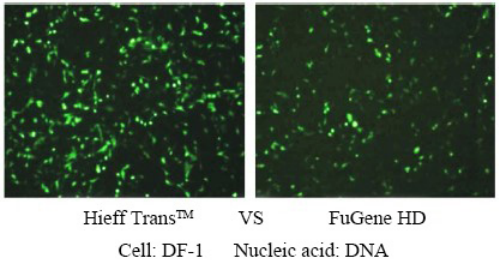
PEI 40000은 분자량이 40,000인 고전하 양이온성 폴리머로, 음전하 핵산 분자를 매우 쉽게 결합하여 복합체를 형성하고 복합체가 세포로 유입되도록 합니다. PEI 40000은 HEK293 및 CHO와 같은 세포에서 낮은 세포독성, 높은 형질전환 효율 및 높은 유전자 발현 효율을 가진 일시적 형질전환 시약입니다. 선형 PEI 형질전환 시약은 HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, Sf9, HepG2 및 Hela 세포를 포함한 광범위한 세포주에 대해 검증되었습니다. 형질전환 효율은 80%~90%에 달합니다.
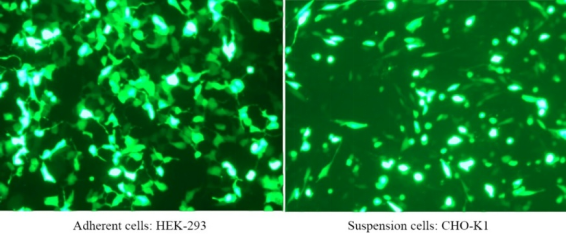
자세한 내용은 새로운 트랜스펙션용 즐겨찾기 —— 더욱 효율적인 트랜스펙션 시약인 Linear PEI MW 40000을 참조하세요.
Hieff Trans™ 시험관 내 siRNA/miRNA 형질감염 시약
이 제품은 광범위한 세포주에서 1 nM siRNA의 90% 이상의 발현 효율을 달성하여 오프타겟 효과를 피할 수 있습니다. Hela, MCF-7, HepG2, CHO 및 기타 부착 세포를 포함한 다양한 세포의 형질감염에 적합하며, K562 또는 THP-1 세포와 같이 형질감염이 어려운 현탁 세포주는 80%의 침묵 효율을 달성할 수 있습니다. 일부 일차 세포, 일차 인간 섬유아세포 및 일차 인간 간세포 등을 포함하여 80%의 침묵 효율을 달성할 수 있습니다.
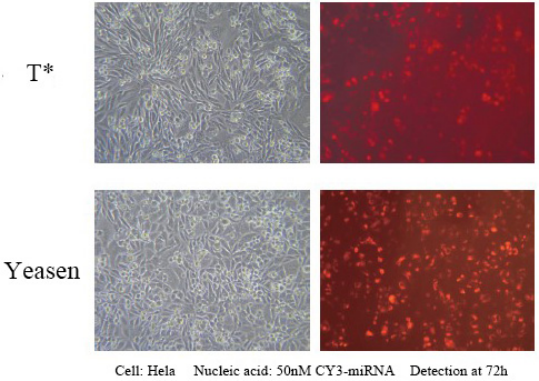
형질감염 조건에 대한 참고사항
각 제품에 대한 설명서 외에도 고객은 특정 실험 내용에 따라 작업하며 사용량에는 차이가 있습니다. 제품을 사용한 후 고객이 보고한 시험관 내 세포 형질 도입 조건에 따라 참고용으로 정리했습니다.
|
제품 이름/품목 번호 |
Hieff Trans™ 리포좀 트랜스펙션 시약 /40802ES |
||||
|
셀 |
배양 용기 |
세포 도금 밀도 |
DNA |
히프 번역 |
형질전환 효율 |
|
A549 |
6 웰 |
90% |
0.7μg |
1.15 μL |
+++ |
|
비비2 |
24 웰 |
95% |
0.2μg(마이크로그램) |
0.2 μL |
++ |
|
C2C12 |
24 웰 |
80% - 90% |
1μg(마이크로그램) |
5 μL |
++ |
|
DF1 |
24 웰 |
80% - 90% |
0.5μg(마이크로그램) |
0.5 μL |
+++ |
|
H520 |
6 웰 |
80% |
1.2μg |
6 μL |
++ |
|
하캇 |
96 웰 |
70% |
100 ng |
1 μL |
++ |
|
에이치티씨티116 |
6 웰 |
90% |
4μg(4μg) |
10 μL |
++ |
|
HEK 293 |
6 웰 |
95% |
2μg(2μg) |
10 μL |
80~90% |
|
헤크 293피트 |
24 웰 |
85% |
1μg(마이크로그램) |
4 μL |
90% |
|
HEK 293T |
12 웰 |
1×105 |
1μg(마이크로그램) |
2 μL |
+++ |
|
HEK 293T(서스펜션) |
30ml |
80% |
30μg |
60 μL |
++ |
|
헬라 |
12 웰 |
90% |
0.2μg |
0.6 μL |
90% |
|
헬라 |
12 웰 |
80% |
1μg(마이크로그램) |
3 μL |
+++ |
|
헵지2 |
12 웰 |
80% |
1μg(마이크로그램) |
3 μL |
++ |
|
휴벡 |
24 웰 |
80% |
1μg(마이크로그램) |
2 μL |
++ |
|
엠씨에프10A |
10cm 접시 |
60% |
5μg(5μg) |
15 μL |
++ |
|
N2A |
24 웰 |
70% - 80% |
300 ng |
900 μL |
+ |
|
NCI H1975 |
6 웰 |
80% |
4μg(4μg) |
10 μL |
+++ |
|
미국 국립보건원(NIH) 3T3 |
6 웰 |
90% |
4μg(4μg) |
10 μL |
+++ |
|
원시 264.7 |
35mm 접시 |
80% |
1μg(마이크로그램) |
2 μL |
90% |
|
베로 |
6 웰 |
80% |
3μg(마이크로그램) |
9 μL |
+++ |
|
셀 |
배양 용기 |
세포 도금 밀도 |
siRNA |
히프 번역 |
형질전환 효율 |
|
홍콩2 |
6 웰 |
65% |
100피몰 |
6 μL |
+++ |
자주 묻는 질문
1 Hieff Trans™ 리포좀 트랜스펙션 시약
1.1 Q: 핵산 형질감염 시약 복합체를 제조할 때 혈청이 존재할 수 있습니까?
A: 혈청의 존재는 리포좀의 형성에 영향을 미칩니다. 핵산 트랜스펙션 시약 복합체를 제조할 때는 혈청이 없는 배지(일반적으로 MEM 배지)를 사용하는 것이 좋습니다.
1.2 Q: Hieff Trans™ 리포좀 핵산 형질감염 시약을 사용할 때 주의해야 할 점은 무엇입니까?
에이:
1) 세포를 형질전환할 때 세포 밀도는 바람직하게는 80%-95%이고, 구체적인 도금 밀도는 세포의 상황에 따라 결정됩니다.
2) 고순도 DNA를 사용하면 더 높은 형질 전환 효율을 얻는 데 도움이 됩니다.
3) 트랜스펙션 복합체를 제조할 때 DNA와 트랜스펙션 시약은 혈청이 없는 배지로 희석해야 합니다.
4) 형질감염 중 배지에 항생제를 첨가할 수 없습니다.
5) 시약은 2~8℃에서 보관해야 하며, 장시간 뚜껑을 반복해서 열지 않도록 주의해야 합니다.
6) DNA 농도와 양이온성 리포좀 시약의 수는 첫 번째 사용 시 최대 트랜스펙션 효율을 얻기 위해 최적화되어야 합니다. DNA와 트랜스펙션 시약의 비율은 일반적으로 1:2-1:3이 권장됩니다.
1.3 Q: 형질감염 후에는 종료해야 합니까?
A: 필요 없습니다. 리포좀 복합체는 6시간 동안 안정적입니다. 트랜스펙션 전에 세포 배지를 바꾸지 않으면 정상적인 세포 성장에 필요한 영양소를 보장하기 위해 4-6시간 후에 새로운 배지로 바꿔야 합니다. 그러나 트랜스펙션 전에 배지를 바꾼 경우 리포좀 트랜스펙션 후에 배지를 바꿀 필요는 없습니다.
1.4 Q: DNA와 siRNA의 공동 형질감염을 수행할 수 있습니까? 효과는 어떻습니까?
A: 네, DNA와 siRNA를 동시에 형질전환하는 경우 siRNA 형질전환 효율이 약간 떨어집니다.
1.5 질문: 트랜스펙션 시약을 렌티바이러스 패키징의 트랜스펙션에 사용할 수 있나요?
A: 렌티바이러스 포장이 가능합니다.
1.6 질문: 현탁 세포도 Hieff Trans™ 리포좀 핵산 형질감염 시약으로 형질감염시킬 수 있습니까?
A: Hieff Trans™ 리포좀 핵산 트랜스펙션 시약은 현탁 세포 트랜스펙션에 사용할 수 있습니다. 자세한 내용은 프로토콜을 참조하세요. 또한, 현탁 세포에 특화된 트랜스펙션 시약(Cat No. 40805, Hieff Trans™ 현탁 세포 없는 리포좀 트랜스펙션 시약)도 출시했습니다.
2 Hieff Trans™ 시험관 내 siRNA/miRNA 형질감염 시약
2.1 Q: 형질감염 후에 형질감염 시약을 교체해야 합니까?
A: 이 문제는 두 가지 경우로 나눌 수 있습니다. 1. 트랜스펙션 전에 배지 교체가 없는 경우, 트랜스펙션 후 약 6시간 후에 배지를 교체하여 세포 성장에 필요한 영양소를 확보해야 합니다. 2. 트랜스펙션 전에 배지 교체가 있는 경우, 배양 세포의 정상적인 작동에 따라 작동할 수 있습니까? ? 액체 교체 작업 후?
2.2 Q: 형질감염 시약을 동결할 수 있나요?
A: 동결할 수 없습니다. 왜냐하면 트랜스펙션 시약은 PEI 양이온 트랜스펙션 시약이기 때문입니다. 낮은 온도에서 동결하면 PEI 트랜스펙션 시약의 활성이 파괴됩니다. 따라서 최상의 트랜스펙션 효능을 유지하려면 2-8°C에서 보관하는 것이 가장 좋습니다.
제품 정보
| 제품 이름 | 제품유형 | 명세서 |
| Hieff Trans™ 리포좀 트랜스펙션 시약 | 40802ES02 | 0.5ml (100ml) |
| 40802ES03 | 1.0ml (1.0ml) | |
| 40802ES08 | 5×1ml | |
| Hieff Trans™ 서스펜션 셀프리 리포좀 트랜스펙션 시약 (문의) | 40805ES02 | 0.5ml (100ml) |
| 40805ES03 | 1.0ml (1.0ml) | |
| 40805ES08 | 5×1ml | |
| Hieff Trans™ 시험관 내 siRNA/miRNA 형질감염 시약 (문의) | 40806ES02 | 0.5ml (100ml) |
| 40806ES03 | 1.0ml (1.0ml) | |
| 폴리에틸렌이민 선형(PEI) MW40000(빠른 용해) | 40816ES02 | 100mg |
| 40816ES03 | 1g(그램) | |
| 40816ES08 | 5×1g |
우리 제품을 사용하여 게시된 일부 기사
[1] Liu R, Yang J, et al. 엔지니어링된 광전환 RNA 결합 단백질을 사용한 RNA 기능 및 대사의 광유전학적 제어. Nat Biotechnol. 2022년 1월 3일. (IF:55)
[2] Luo J, Yang Q, et al. TFPI는 과독성 클레이드 2 C. difficile의 TcdB에 대한 결장 융기부 수용체입니다. Cell. 2022 Mar 17.(IF:41.582)
[3] Zhou J, Chen P, et al. 엄격한 PAM 인식을 통해 낮은 게놈 전역 오프타겟 효과를 위해 설계된 Cas12a 변종. Mol Ther. 2022년 1월 5일.(IF:11.454)
[4] Chen S, Cao X, et al. circVAMP3는 CAPRIN1 상 분리를 구동하고 c-Myc 번역을 억제하여 간세포암을 억제합니다. Adv Sci(Weinh). 2022년 1월 24일.(IF:16.808)
[5] Gu C, Wang Y, et al. AHSA1은 다발성 골수종의 세포 증식 및 프로테아좀 억제제 저항에 대한 유망한 치료 표적입니다. J Exp Clin Cancer Res. 2022년 1월 6일.(IF:11.161)
[6] Zhang Y, Yu X, et al. 스플라이싱 인자 아르기닌/세린이 풍부한 8은 CACYBP의 대체 스플라이싱과 엑소솜 기반 세포 통신을 통해 다발성 골수종 악성 종양 및 골 병변을 촉진합니다. 임상 의학. 2022년 2월(IF:11.492)
[7] Qin J, Cai Y, et al. 그렐린 수용체의 작용 및 역작용의 분자적 메커니즘. Nat Commun. 2022년 1월 13일.(IF:14.9)
[8] Tang X, Deng Z, et al. circHNRNPU에 의해 인코딩된 새로운 단백질은 골수 미세환경과 대체 스플라이싱을 조절하여 다발성 골수종 진행을 촉진합니다. J Exp Clin Cancer Res. 2022년 3월 8일.(IF:11.161)
[9] Xie F, Su P, et al. COVID-19 치료제로서 팔미토일화된 ACE2가 풍부한 세포외소포 엔지니어링. Adv Mater. 2021년 10월 19일. (IF:30.849)
[10] Liang Y, Lu Q, et al. NamiRNA 네트워크를 통한 인핸서 스위칭에 의한 유방암의 종양 억제제 재활성화. Nucleic Acids Res. 2021년 9월 7일.(IF:16.9)
[11] Fan Y, Wang J 외. CircNR3C2는 삼중 음성 유방암에서 miR-513a-3p 스폰징을 통해 HRD1 매개 종양 억제 효과를 촉진합니다. Mol Cancer. 2021년 2월 2일.(IF:27.403)
[12] Dai L, Dai Y, et al. 손상된 크로마틴에 대한 BRCA1-BARD1 복합체 모집에 대한 구조적 통찰력. Mol Cell. 2021년 7월 1일.(IF:17.97)
[13] Zhang K, Wang A, et al. UBQLN2-HSP70 축은 폴리-Gly-Ala 응집체를 감소시키고 C9ORF72 동물 모델에서 행동 결함을 완화합니다. Neuron. 2021년 6월 16일.(IF:17.17)
[14] Li T, Chen X, et al. 마우스에서 포도당 항상성을 가능하게 하는 맥동성 형질전환 유전자 발현을 위한 합성 BRET 기반 광유전학 장치. Nat Commun. 2021년 1월 27일.(IF:14.92)
[15] Yan F, Huang C, et al. 박테리아 효과기 패밀리에 의한 유비퀴틴의 트레오닌 ADP-리보실화는 숙주 유비퀴틴화를 차단합니다. Mol Cell. 2020년 5월 21일.(IF:17.97)
[16] Sun X, Peng X, et al. ADNP는 Wnt/β-catenin 신호전달을 조절하여 신경 분화를 촉진합니다. Nat Commun. 2020년 6월 12일.(IF:14.911)
[17] Yang X, Wang H, et al. ERBB3 및 ERK 신호 전달 재배선은 ERBB3-E928G 돌연변이를 지닌 위장관암에서 FGFR1 억제에 대한 저항성을 부여합니다. 단백질 세포. 2020년 12월(IF:14.872)
[18] Zou Y, Wang A, et al. 유전적으로 인코딩된 형광 센서를 사용하여 살아있는 세포와 생체내의 산화환원 경관 및 역학 분석. Nat Protoc. 2018년 10월(IF:13.490)
[19] Hao H, Hu S, et al. 내피세포 CXCR7 손실은 심근경색 후 혈관 항상성 및 심장 리모델링을 손상시킵니다. 심혈관 약물 발견에 대한 의미. Circulation. 2017년 3월 28일.(IF:29.69)
