생명공학의 급속한 발전은 시험관 내 RNA 합성 기술을 통해 생산된 mRNA 백신을 통해 COVID-19와 같은 감염성 질병과 싸우는 데 큰 영향을 미쳤습니다. 미국의 Moderna, 독일의 CureVac, 독일의 BioNTech를 포함한 수많은 회사는 치료용 mRNA 백신뿐만 아니라 종양, 감염성 질병, 만성 질환과 같은 질환에 대한 치료법도 개발했습니다.
mRNA 백신의 연구와 제형은 성공적인 개발을 보장하기 위해 다양한 원료가 필요합니다. 분자 효소 산업의 선구자로서
제품 품질과 생산 용량을 보장하기 위해
1. GMP의 장점
2.
3.
4.
5.
6. 주문 정보
1. GMP의 장점
"GMP 등급"은 ISO 13485 인증 시설에서 제조된 시약을 설명하는 데
표 1. GMP의 장점
| 품질 관리 | 연구 수준 | GMP 등급 |
| 동물성 없음 | 동물성 원료를 사용할 수 있습니다 | 필요한 경우 동물성 비사용 인증서를 제공할 수 있습니다. |
| 세포은행 특성화 | 덜 엄격하다 | 엄격함(GMP 규정 준수) |
| 원자재 및 완제품에 대한 추적 정보 | 덜 엄격하다 | 엄격함(GMP 규정 준수) |
| 엔도톡신 수치 제어 | / | 절박한 |
| 무균 관리 | / | 절박한 |
| 제조 및 테스트를 위한 배치 기록 | 덜 엄격하다 | 엄격함(필요한 경우 일괄 기록 제공 가능) |
| 프로세스 검증 보고서 | / | 필요한 경우 보고서를 제공할 수 있습니다. |
| 변화 관리 시스템 | 자기평가 | 엄격함(GMP 규정 준수) |
| 품질경영시스템 | 자기평가 | ISO 13485 인증 |
| DMF 번호 | / | 네 (보고) |
2. Yeasen 은 GMP 등급 제품을 제공할 수 있습니다.
효소 개발 및 산업 규모 생산 분야에서 광범위한 전문 지식과 기술적 우수성을 활용하여
GMP 등급 제품을 위해 특별히 건설된
3. Yeasen 은 많은 제품에 대한 DMF 번호를 획득했습니다.
약물 마스터 파일(DMF)은 미국 식품의약국(FDA)에 자발적으로 제출된 기밀 문서입니다. 여기에는 인간 약물 제품의 생산, 가공, 포장 및 보관에 사용되는 시설, 프로세스 또는 품목에 대한 자세한 정보가 포함되어 있습니다.
FDA는 활성 약제 성분(API) 제조업체가 Investigational New Drug Application(IND), New Drug Application(NDA), Abbreviated New Drug Application(ANDA) 또는 Export Application을 지원하기 위해 DMF를 참조할 때 DMF의 기술적 내용을 면밀히 조사합니다. DMF는 이러한 신청에서 핵심적인 역할을 합니다. 제조업체가 특정 재료에 대한 DMF를 제출하면 FDA 승인 프로세스가 상당히 빨라질 수 있습니다.
4. Yeasen 제품의 적용 시나리오
4.1 템플릿 생성
플라스미드 선형화는 플라스미드 벡터가 전사 템플릿으로 사용될 때 템플릿 생성 중에 없어서는 안 될 단계입니다. 전사가 DNA 템플릿의 끝까지 진행됨에 따라 플라스미드 선형화는 정의된 길이와 시퀀스의 RNA 전사본이 생성되도록 합니다.
4.2 시험관 내 전사 (IVT)
시험관 내 전사는 다양한 요인에 의해 영향을 받습니다. 효소, 완충액, 변형 기질은 모두 전사 효율에 큰 영향을 미칩니다.
YEASEN Biotech는 ZymeEditor 플랫폼을 기반으로 시험관 내 전사(IVT) 과정 중 dsRNA 생성을 크게 줄이는 새로운 T7 RNA 중합효소를 개발했습니다( T7 RNA 중합효소, 낮은 ds RNA, 250 U/μL ). mRNA의 면역원성을 크게 낮추고 어느 정도 mRNA의 무결성을 향상시킵니다. 이 개발은 mRNA 백신과 항암제 개발을 앞당기는 데 중요한 역할을 할 것으로 기대됩니다.

완충액을 최적화하고, 뉴클레오타이드 기질의 염 유형을 조절함으로써 전사 효율을 크게 향상시키고, dsRNA 생성을 감소시켰습니다.

그림 2. Tris NTP는 lVT 효율성을 크게 향상시키고 dsRNA 생산을 감소시킬 수 있습니다.
4.3 mRNA 캡핑
5′ 캡 구조는 면역원성을 감소시키고 mRNA의 효율적인 번역에 필요하므로 전사에 의해 생성된 mRNA의 5′ 말단에 캡 구조를 추가하는 것이 필요합니다.
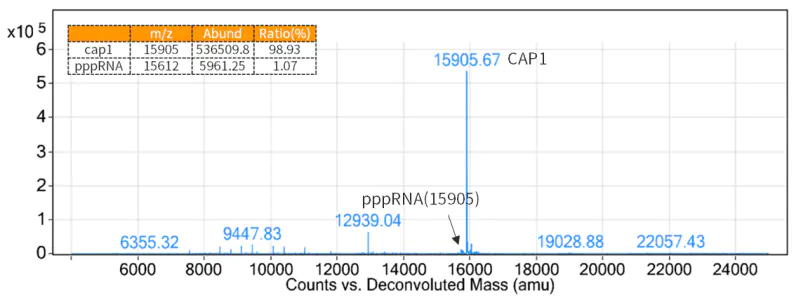
그림 3. 캡레이트 검출 결과(LC-MS 검출)
4.4 mRNA 정제
정제는 고순도 mRNA를 얻는 데 필수적인 단계입니다.
5. Yeasen 에서 제공하는 mRNA 백신 제조 원료
현재,
표 2.
|
템플릿 준비 |
시험관 내 전사 |
||
|
10164ES |
10623ES |
||
|
10122ES |
10625ES |
||
|
10922ES |
10672ES |
||
|
10300ES |
10621ES |
||
|
|
10611ES |
||
| 10661ES |
10133ES |
||
| RNAse R(20U/uL) | 14615ES |
10650ES |
|
|
엑스바 1 |
10662ES |
10651ES |
|
|
캡핑 |
정화 |
||
|
10614ES |
12602ES | ||
|
10612ES |
자기 분리 랙 | 80460ES | |
|
10619ES |
36717ES |
||
|
10681ES |
|||
6. 주문 정보
다음은
표 3. 주문 정보
독서에 관하여:
mRNA 시험관 내 합성을 위한 GMP 등급 시약
DNase I 및 생물의학에서의 응용
참고문헌:
[1] Chaudhary, N., Weissman, D., & Whitehead, KA (2021). 감염성 질환에 대한 mRNA 백신: 원리, 전달 및 임상적 전환. Nature 리뷰. 약물 발견, 20(11), 817–838.
[2] Vogel, AB et al. 자체 증폭 RNA 백신은 mRNA 백신과 동등한 인플루엔자 보호 효과를 제공하지만
훨씬 낮은 복용량에서. 분자 치료: 미국 유전자 치료 학회 저널 26, 446-455,
[3] Fuchs, AL, Neu, A. 및 Sprangers, R. 5'의 빠르고 비용 효율적인 대량 생산을 위한 일반 방법
캡핑된 RNA. RNA(New York, NY) 22, 1454-1466, doi:10.1261/rna.056614.116(2016).
[4] Schmid, A. 임상 시험을 위한 mRNA 백신 생산을 위한 고려 사항. 분자 생물학 방법(Clifton, NJ) 1499, 237-251,
[5] Banerji, A. et al. COVID-19 질병 및 보고된 알레르기 반응을 예방하기 위한 mRNA 백신: 현재 증거 및 제안된 접근 방식. 알레르기 및 임상 면역학 저널. 실무 9, 1423-1437,
[6] Richner, JM et al. 변형 mRNA 백신은 지카 바이러스 감염으로부터 보호합니다. Cell 168, 1114-1125.e1110,
[7] Corbett, KS et al. 프로토타입 병원체 준비를 통해 가능해진 SARS-CoV-2 mRNA 백신 설계. Nature 586,567-571,
[8] Corbett, KS et al. mRNA-1273은 비인간 영장류에서 SARS-CoV-2 베타 감염으로부터 보호합니다. Nature immunology 22, 1306-1315,
[9] Keech, C. et al. SARS-CoV-2 재조합 스파이크 단백질 나노입자 백신의 1-2상 시험. New England 저널 오브 메디신 383, 2320-2332,
[10] Kramps, T. & Elbers, K. RNA 백신 소개. 분자생물학 방법(Clifton, NJ) 1499, 1-11,
[11] Linares-Fernández, S., Lacroix, C., Exposito, JY & Verrier, B. 선천/적응 면역 반응의 균형을 맞추기 위한 mRNA 백신 조정. 분자 의학 동향 26, 311-323,
