
Khái niệm và sự cần thiết của việc phát hiện HCP
Các sản phẩm sinh học thường được sản xuất bằng công nghệ tái tổ hợp trong các tế bào vật chủ (như vi khuẩn, nấm men, động vật có vú, côn trùng hoặc tế bào thực vật), bao gồm kháng thể đơn dòng, protein tái tổ hợp và vắc-xin. Các quy trình sản xuất và tinh chế các sản phẩm này chắc chắn sẽ đưa protein tế bào vật chủ (HCP) vào dưới dạng tạp chất, bao gồm cả protein cấu trúc của tế bào vật chủ và các yếu tố tăng trưởng do tế bào vật chủ tiết ra, tạo thành hỗn hợp phức tạp với nhiều đặc tính lý hóa và miễn dịch khác nhau. Mặc dù sử dụng các kỹ thuật tinh chế tiên tiến, một số protein tế bào vật chủ vẫn có thể tồn tại dưới dạng tạp chất liên quan đến quy trình trong các sản phẩm thuốc trung gian.
Các tạp chất này có khả năng sinh miễn dịch và có thể làm tăng phản ứng sinh miễn dịch của các sản phẩm dược phẩm sinh học, ảnh hưởng đến độ ổn định và hiệu quả của chúng, do đó gây ra rủi ro cho sự an toàn của con người. Do đó, cần thiết lập các chiến lược giám sát thích hợp để loại bỏ HCP và cần kiểm soát hàm lượng HCP trong sản phẩm cuối cùng để đáp ứng các yêu cầu về chất lượng thuốc.
Yêu cầu về quy định đối với HCP
Hàm lượng HCP còn lại trong các sản phẩm sinh học thường được coi là một thuộc tính chất lượng quan trọng (CQA) của sản phẩm, một chỉ số đánh giá quan trọng để theo dõi độ bền của quy trình và là chỉ số kiểm soát chất lượng chính của sản phẩm. Các cơ quan quản lý ở nhiều quốc gia có các quy định liên quan đến HCP, yêu cầu phân tích và tinh chế dược phẩm sinh học để giảm HCP protein tế bào chủ xuống mức chấp nhận được. Mức độ chấp nhận HCP sẽ được đánh giá dựa trên các trường hợp cụ thể và phụ thuộc vào một số yếu tố, bao gồm liều lượng, tần suất dùng thuốc, loại thuốc và mức độ nghiêm trọng của bệnh.
Dược điển Trung Quốc (phiên bản năm 2020) quy định: Đối với tế bào CHO, HCP còn lại cần phải <0,05% (tương đương với nhỏ hơn 500 ppm); đối với E. coli, HCP còn lại cần phải <0,01%.
Chương USP <1132> của Dược điển Hoa Kỳ quy định: Nên sử dụng phương pháp có độ nhạy cao để phát hiện HCP trong thuốc và hàm lượng phải thấp hơn giới hạn phát hiện (thường là dưới 100 ppm, tức là hàm lượng HCP trong 1 mg tổng protein phải nhỏ hơn 100 ng hoặc <0,01%).
Dược điển Châu Âu EP 2.6.34 quy định: Trong các sản phẩm sinh học, hàm lượng HCP phải nhỏ hơn 0,1%.
Hướng dẫn của Hội nghị quốc tế về hài hòa các yêu cầu kỹ thuật để đăng ký dược phẩm dùng cho người (ICH): ICH Q6B nêu rằng nên áp dụng các phương pháp nhạy cảm và đã được xác nhận để theo dõi HCP còn lại, với lượng còn lại thường được yêu cầu phải nhỏ hơn 100 ppm.
Có thể thấy rằng các cơ quan quản lý có các yêu cầu rất nhất quán đối với HCP. Quá trình phát triển các sản phẩm sinh học phải trải qua quá trình phát hiện HCP, chứng minh rằng quá trình tinh chế có thể giảm HCP xuống mức an toàn và giới hạn khuyến nghị đối với hàm lượng dư trong sản phẩm cuối cùng là dưới 0,01% ở cả Trung Quốc và Hoa Kỳ.
Phương pháp phát hiện HCP
Xét nghiệm miễn dịch liên kết với enzyme (ELISA) hiện là phương pháp được sử dụng phổ biến nhất để phát hiện HCP. Các phương pháp phát hiện dư lượng protein chủ được đề cập trong Chương 3412/3413/3414 của ấn bản năm 2020 của Dược điển Trung Quốc đều là phương pháp ELISA.
Chương USP <1132> của Dược điển Hoa Kỳ cũng đề cập rằng các phương pháp như điện di, ELISA và LC-MS/MS có thể được sử dụng để phát hiện hàm lượng HCP và ELISA được khuyến nghị là phương pháp ưu tiên để phát hiện HCP do dễ vận hành, tốc độ, độ nhạy cao và thông lượng cao.
ELISA:
Mục đích: Phát hiện tổng lượng protein trong HCP, có thể được sử dụng để phát triển sản phẩm và kiểm soát quy trình, và hiện là phương pháp phổ biến để phát hiện HCP.
Thuận lợi: Độ nhạy và độ đặc hiệu cao; Năng suất cao và khả năng tự động hóa; Định lượng; Vận hành dễ dàng và nhanh chóng.
Nhược điểm: Yêu cầu kháng thể đặc hiệu; Không thể xác định và đánh giá cụ thể từng HCP; Việc phát triển phương pháp phức tạp, đòi hỏi phải chuẩn bị kháng nguyên đặc biệt; Nhiều yếu tố ảnh hưởng đến phương pháp, phạm vi HCP cần được đánh giá; Không thể xác định loài.

Phương pháp Western Blotting:
Mục đích: Được sử dụng để sàng lọc nhất quán số lượng lớn mẫu và phát hiện các protein chưa biết phản ứng với kháng thể anti-HCP. Thích hợp để phát hiện HCP và cung cấp thông tin gần đúng về trọng lượng phân tử tương đối của HCP.
Thuận lợi: Tính đặc hiệu; Kết quả trực quan: hình dung sự khác biệt về kích thước protein và mức độ biểu hiện; Có thể phát hiện và định lượng các HCP cụ thể.
Nhược điểm: Bán định lượng; Giới hạn ở các protein cụ thể: chỉ có thể phát hiện HCP liên kết với kháng thể; Không đủ nhạy cảm với hỗn hợp protein phức tạp; Biến tính SDS protein có thể dẫn đến mất các epitope cấu hình; Độ nhạy phụ thuộc vào chất lượng của kháng thể đa dòng.
Điện di gel hai chiều (2-DE):

Mục đích: Thường được sử dụng để phát triển và mô tả quy trình thượng nguồn hoặc hạ nguồn, nó có thể phân biệt các HCP khác nhau trên một gel duy nhất.
Thuận lợi: Không cần dùng phương pháp Western blotting, tránh các vấn đề về chuyển giao; Có thể tách một lượng nhỏ tạp chất HCP ra khỏi sản phẩm; Cung cấp thông tin gần đúng về trọng lượng phân tử tương đối và điểm đẳng điện.
Nhược điểm: Lượng protein quá mức có thể che khuất các đốm HCP; Sự phân bố của HCP trong mẫu có thể được quan sát nhưng không thể định lượng được.

Phân tích phổ khối:
Mục đích: Xác định từng HCP, cung cấp thông tin định lượng và nhận dạng chính xác cho các protein tế bào chủ.
Thuận lợi: Độ phân giải và độ chính xác cao; Xác định và theo dõi từng HCP; Cung cấp phổ toàn diện của HCP; Có thể bao phủ nhiều loại protein; Có thể xác định các loài HCP.
Nhược điểm: Yêu cầu về thiết bị và kỹ thuật cao; Vận hành phức tạp; Chi phí cao; Năng suất phương pháp thấp; Xử lý mẫu phức tạp; Hiệu ứng ma trận tiềm ẩn; Yêu cầu khả năng phân tích dữ liệu chuyên biệt.
ELISA là phương pháp được khuyến nghị để phát hiện HCP còn sót lại trong các sản phẩm sinh học theo dược điển ở nhiều quốc gia, có khả năng xác định tổng lượng HCP. Tuy nhiên, nó có những hạn chế trong việc xác định loại và số lượng HCP và cần được bổ sung bằng các phương pháp khác. Mỗi phương pháp phát hiện đều có ưu điểm và nhược điểm riêng, và trong các ứng dụng thực tế, có thể lựa chọn dựa trên mục đích thử nghiệm, đặc điểm mẫu, độ chính xác và sự tiện lợi khi vận hành, trong số các yếu tố khác, kết hợp với việc sử dụng các phương pháp khác nhau để có được kết quả toàn diện và chính xác hơn.
Ngoài ra, Dược điển Hoa Kỳ USP <1132> và Dược điển Châu Âu EP 2.6.34. XÉT NGHIỆM PROTEIN TẾ BÀO CHỦ chỉ ra rằng nên sử dụng các thuốc thử ELISA khác nhau để phát hiện HCP ở các giai đoạn phát triển sản phẩm khác nhau, phân loại các phương pháp phát hiện HCP thành thuốc thử thương mại, phương pháp dành riêng cho sản phẩm/quy trình và phương pháp nền tảng.
USP <1132> đề cập rằng khi không có phương pháp nền tảng, các thuốc thử thương mại có thể được sử dụng trong các thử nghiệm lâm sàng tiền lâm sàng, Giai đoạn I và Giai đoạn II; trong các thử nghiệm lâm sàng/xác thực quy trình Giai đoạn III và sản phẩm sau khi đưa ra thị trường, do những hạn chế như phạm vi kháng thể không đủ của thuốc thử phát hiện HCP chung thương mại, cần cân nhắc đến các yếu tố như loại tế bào và tính đặc hiệu của quy trình, sử dụng các phương pháp nền tảng hoặc các phương pháp dành riêng cho sản phẩm/quy trình để phát triển quy trình thượng nguồn.
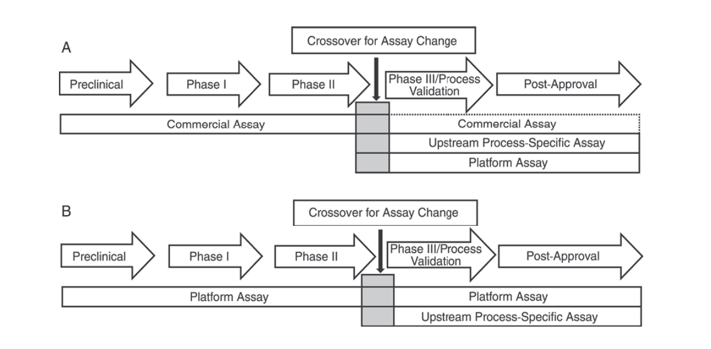
Hình 1. Trong USP <1132>, các giai đoạn phát triển sản phẩm khác nhau được đề xuất sử dụng các phương pháp cụ thể để phát hiện HCP.
| Phương pháp | Bộ thuốc thử thương mại | Phát hiện sản phẩm/quy trình cụ thể Bộ dụng cụ | Phát hiện nền tảng Bộ dụng cụ |
| Khả dụng | Có sẵn
| Yêu cầu chuẩn bị kháng nguyên, bao gồm cả việc nhân bản dòng tế bào chủ
| Yêu cầu chuẩn bị kháng nguyên bằng cách sử dụng dòng tế bào vector trần hoặc rỗng
|
| Phát triển | Yêu cầu chuẩn bị tối thiểu | Phát triển phát hiện bao gồm đặc tính kháng nguyên, miễn dịch và xác nhận thường mất ít nhất 6 tháng | Phát triển phát hiện bao gồm đặc tính kháng nguyên, miễn dịch và xác nhận thường mất ít nhất 9 tháng |
| Đa dạng | Giới hạn ở các hệ thống biểu hiện phổ biến nhất | Có thể sử dụng nhiều loại hệ thống biểu hiện khác nhau | Có thể sử dụng nhiều loại hệ thống biểu hiện khác nhau |
| Tính đặc hiệu | Độ đặc hiệu có thể kém, với các HCP tiềm ẩn không được phát hiện
| Độ đặc hiệu thường được tăng cường, với phạm vi kháng thể nhắm mục tiêu vào các mô hình HCP cụ thể | So với các phương pháp phát hiện thương mại, tính đặc hiệu được cải thiện, hiểu biết về hiệu suất phát hiện được nâng cao và phạm vi bao phủ của các loại HCP cũng được tăng lên |
| Trị giá | Giá ban đầu tương đối rẻ, nhưng chi phí phát triển sẽ nhanh chóng tăng lên đối với toàn bộ quá trình thanh lọc hạ nguồn | Chi phí ban đầu cao hơn, nhưng điểm hòa vốn thường ở giá trị của 100 bộ thuốc thử | Do có thể áp dụng cho nhiều sản phẩm nên nó có lợi thế đáng kể về chi phí |
| Sự phụ thuộc | Tùy thuộc vào nhà cung cấp cụ thể, thuốc thử và chương trình kiểm soát sẽ ở trạng thái "hộp đen". | Có khả năng kiểm soát toàn diện tất cả các thuốc thử và đệm, có thể điều chỉnh bất cứ lúc nào | Có toàn quyền sở hữu và kiểm soát tất cả các thuốc thử, giảm thiểu rủi ro trong chuỗi cung ứng và khả năng so sánh lô hàng |
| Yêu cầu về quy định | Không phù hợp để hỗ trợ tiếp thị đơn xin cấp phép | Áp dụng để hỗ trợ toàn bộ quá trình từ phát triển ban đầu đến tiếp thị các sản phẩm được cấp phép | Áp dụng cho việc hỗ trợ phát triển ban đầu cho đến khi được cấp phép tiếp thị |
Bảng 1.So sánh các loại bộ dụng cụ thuốc thử HCP khác nhau
Yeasen Dịch vụ phát triển xét nghiệm HCP tùy chỉnh của Biotech
Với tầm quan trọng của việc phát hiện HCP,
Dòng thời gian tùy chỉnh
Dịch vụ tùy chỉnh cho bộ dụng cụ phát hiện protein còn sót lại của tế bào chủ thường mất từ 6 đến 10 tháng.
Chuẩn bị kháng nguyên-kháng thể: Xác định kháng nguyên HCP, thiết lập tiêu chuẩn tham chiếu HCP, đưa ra các con đường và chiến lược miễn dịch, chuẩn bị kháng thể HCP, v.v., thường mất từ 4 đến 6 tháng.
Phát triển bộ xét nghiệm: Tối ưu hóa kháng thể, phân tích phạm vi bao phủ, xác nhận phương pháp bộ xét nghiệm, v.v., thường mất từ 2 đến 4 tháng.
Yeasen Dịch vụ xác minh phạm vi kháng thể HCP của Biotech
Người ta biết rằng ELISA là tiêu chuẩn vàng để phát hiện HCP còn sót lại trong ngành, nhưng độ chính xác của phương pháp này phụ thuộc vào phạm vi bao phủ của kháng thể đa dòng đối với HCP. Dược điển Hoa Kỳ và Dược điển Châu Âu đề cập đến phương pháp tinh chế miễn dịch và 2D-WB là các phương pháp được khuyến nghị để mô tả kháng thể ELISA HCP và phạm vi bao phủ của chúng.
Phạm vi kháng thể HCP Xác minh Dịch vụ
2D-WB đầu tiên phân tách protein dựa trên kích thước và điện tích bằng phương pháp điện di gel hai chiều, sau đó chuyển các protein này sang màng để ủ với kháng thể HCP nhằm phát hiện dấu ấn protein.
Chúng tôi có đầy đủ bộ thiết bị 2D-WB và kinh nghiệm phòng thí nghiệm sâu rộng để cung cấp dịch vụ xác minh phạm vi kháng thể cho các mẫu HCP từ tế bào chủ như CHO, E.coli, HEK293, v.v.
Sản phẩm liên quan:
| Sản phẩm | Số danh mục | Kích cỡ |
| 36712ES | 48T/96T | |
| 36713ES | 48T/96T | |
| Bộ xét nghiệm ELISA CHO HCP (CHO-K1) | 36714ES | 48T/96T |
| Bộ xét nghiệm E.coli HCP ELISA (Plasmid) | 36721ES | 48T/96T |
