Molekylær diagnose er det hurtigst udviklende underområde inden for IVD. Det har fordelene ved kort detektionstid, høj følsomhed og stærk specificitet. Det er meget udbredt til samtidig tumordiagnostik og screening af infektionssygdomme og genetiske sygdomme. Inden for molekylær diagnose er PCR ikke kun den mest modne teknologiplatform med den største markedsandel, men også "guldstandard"-teknologien for klinisk diagnose. I den traditionelle PCR-reaktion opstår ofte problemet med uspecifik amplifikation. Uspecifik amplifikation påvirker direkte fortolkningen af detektionsresultater og vil føre til faldet i amplifikationsfølsomheden og endda udbyttet af målfragmenter. Hvordan opstår uspecifik amplifikation, og hvordan kan den effektivt undgås?
1. Konventionel DNA-polymerase kan føre til uspecifik amplifikation
2. Hot Start-polymerase kan forbedre amplifikationsspecificiteten
3. Dobbeltblok Taq-antistof kan dobbeltforbedre amplifikationsspecificitet og stabilitet
4. Ydeevnevisning af Yeasens Double-Block Taq antistof
5. Produktinformation
1. Konventionel DNA-polymerase kan føre til uspecifik amplifikation
Den dårlige sekvensspecificitet af primere er den direkte årsag til uspecifik amplifikation. Som promotor for konventionel DNA-polymerase kan dens exonukleaseaktivitet trunkere DNA-primersekvensen under fremstillingen af PCR-systemet for at reducere specificiteten af primere.
Derudover har konventionel DNA-polymerase ikke kun exonukleaseaktivitet, men har også polymeraseaktivitet. Selvom den optimale forlængelsestemperatur for DNA-polymerase er 72 ℃, er polymerasen stadig aktiv ved stuetemperatur. Derfor kan primere under forberedelsen af PCR-reaktionen og den indledende opvarmningsprocessen danne uspecifik binding med nogle enkeltstrengede skabeloner og strække sig under påvirkning af Taq DNA-polymerase, hvilket resulterer i amplifikation af ikke-målsekvenser og påvirker reaktionens specificitet.
Derfor er PCR-systemer ofte konfigureret på is til at hæmme aktiviteten af DNA-polymerase. Selvom denne metode er enkel og billig, kan den ikke fuldstændigt hæmme enzymaktiviteten, så den kan ikke eliminere amplifikationen af uspecifikke produkter.
2. Hot Start-polymerase kan forbedre amplifikationsspecificiteten
Hotstart-polymerase er kernekomponenten i varmstart-PCR. Ved stuetemperatur blokeres det aktive sted af DNA-polymerase af en enzymmodifikator. Først efter PCR-denaturering ved 95 ℃ falder enzymmodificeringsmidlet, og enzymaktiviteten startes, hvilket undgår uspecifik amplifikation forårsaget af enzymet.
På nuværende tidspunkt omfatter de almindeligt anvendte hotstart-modifikationsmetoder for DNA-polymerase på markedet hovedsageligt en kemisk metode, ligandmetode og antistofmetode. Blandt dem er blokeringseffekten af antistofmodificeret varmstartpolymerase den bedste, og frigivelseshastigheden af enzymaktivitet er hurtig, hvilket i høj grad kan reducere reaktionstiden for PCR. Det er en hot-start enzymmodifikationsmetode, der er meget udbredt på IVD-markedet.
Det skal dog bemærkes, at den traditionelle antistof-hotstartmetode kun blokerer 5'→3'-polymeraseaktiviteten af Taq DNA-polymerase, som kun kan forhindre uspecifik amplifikation forårsaget af mismatch eller primer-dimer ved lave temperaturer.Som nævnt ovenfor har Taq DNA-polymerase imidlertid ikke kun 5'→3'-polymeraseaktivitet, men har også 5'→3'-exonukleaseaktivitet. Denne exonukleaseaktivitet kan føre til nedbrydning af uoverensstemmende prober eller andre materialer ved lave temperaturer, hvilket resulterer i nogle uspecifikke signaler.
3. Dobbeltblok Taq-antistof kan dobbeltforbedre amplifikationsspecificitet og stabilitet
Som en innovativ leder i den indenlandske molekylære enzymindustri, fokuserer Yeasen Biotechnology (Shanghai) Co., Ltd. (herefter kaldet Yeasen) på forskning og udvikling og produktion af molekylære enzymråmaterialer og vover at innovere. Ved at stole på sin egen modne antistofscreeningsplatform screener den det blokerende antistof med Taq DNA-polymerase som målmolekylet. Efter mange års omhyggelig forskning og systemoptimering har den udviklet sig dobbeltblok-anti-Taq DNA-polymerase-antistoffet, Det kan ikke kun blokere polymeraseaktiviteten af Taq DNA-polymerase, men også blokere exonukleaseaktiviteten af Taq DNA-polymerase. I en tostrenget tilgang kan den ikke kun effektivt forhindre uspecifik amplifikation forårsaget af mismatch eller primerdimer, men også forhindre materialenedbrydning i at generere uspecifikke signaler og dobbeltforbedre stabiliteten af reagenset.
4. Ydeevnevisning af Yeasens Double-Block Taq antistof
4.1 Brugen af Double-Block Taq-antistof er nøjagtig og mere følsom
Efter blokering af Taq-polymerase med Yeasens dobbeltblok-antistof og T-firmaets antistof, blev de positive prøver påvist ved ARMS-PCR.
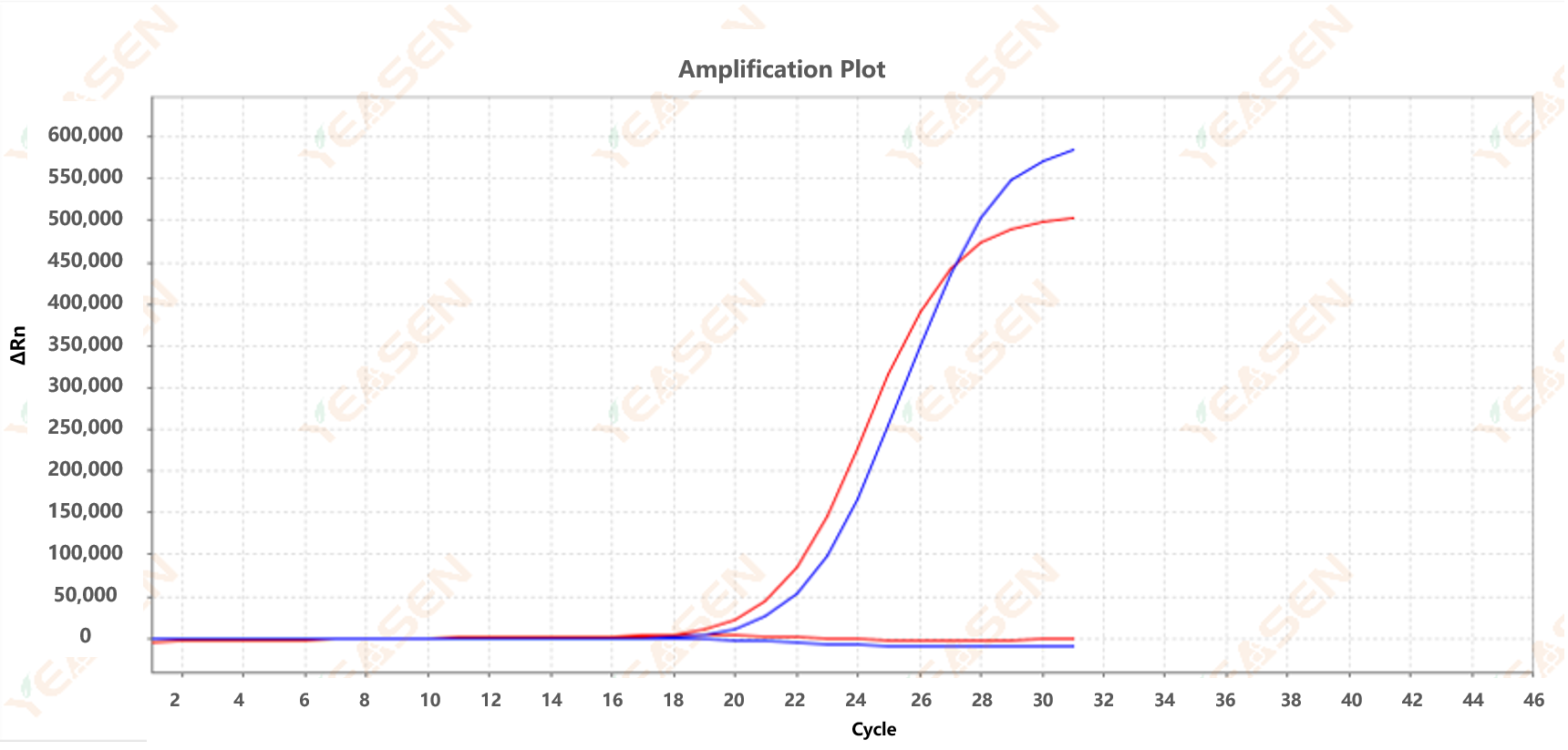
Figur 1. ARMS-PCR amplifikationskurve; Blå: T-virksomhedens blokerende antistof; Rød: Yeasens dobbeltblokerende antistof
Det kan ses fra figur 1, at Taq-polymerasen blokeret af Yeasens dobbeltblok-antistof har nøjagtig typebestemmelse og højere følsomhed i ARMS-PCR-amplifikation.
4.2 Dobbelt-blok Taq-antistoffet effektivt Blokeret Exonuclease-aktiviteten af Taq DNA-polymerase
De syntetiserede primerprober blev matchet med reaktionsopløsningen af Taq DNA-polymerase blokeret af henholdsvis ulukkede og dobbeltblokerede antistoffer og reagerede ved 40 ℃ for at detektere deres fluorescenssignaler fra dem.
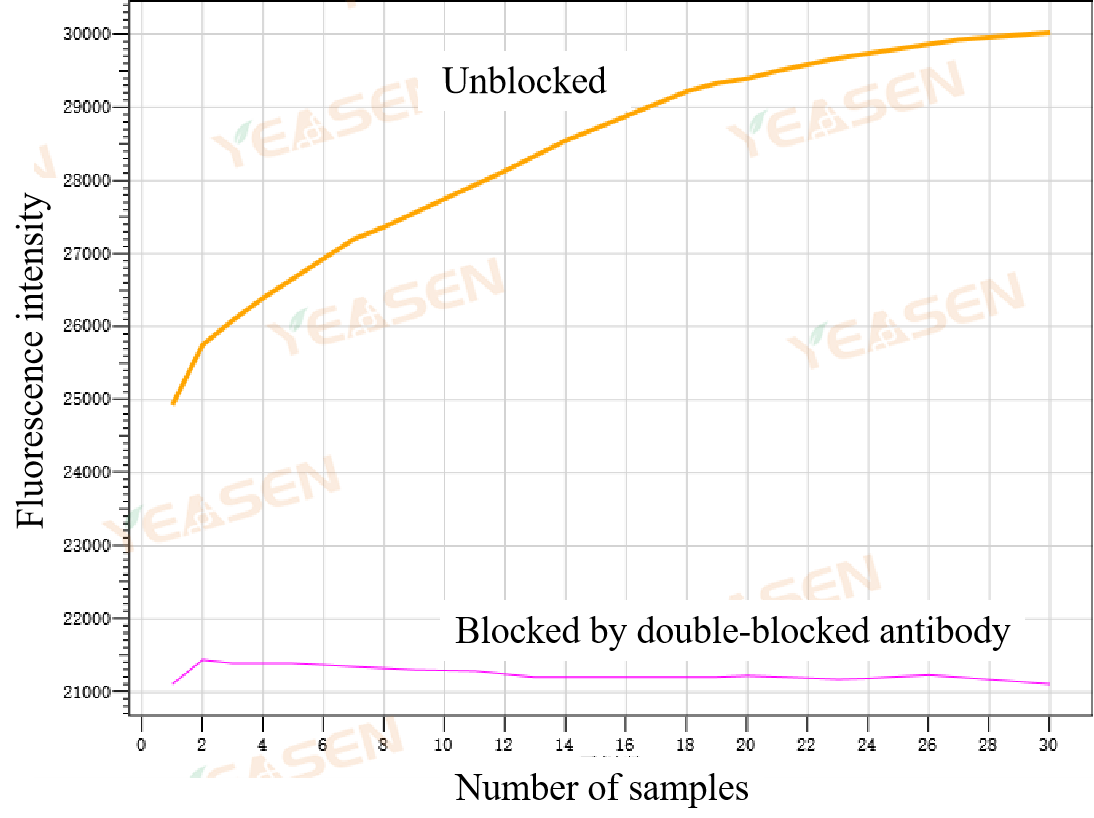
Figur 2. Påvisning af blokeringseffektivitet af dobbeltblokantistof for exonukleaseaktivitet; Gul: ulukket Taq DNA-polymerasegruppe; Lilla: Taq DNA-polymerasegruppe blokeret af dobbeltblokantistof
Det kan ses af figur 2 at dobbeltblok-antistoffet effektivt kan blokere exonukleaseaktiviteten af Taq DNA-polymerase.
4.3 Dobbeltblok Taq-antistof kan effektivt forbedre stabiliteten af detektionsreagens
Taq DNA-polymerase blev blokeret med henholdsvis traditionelt blokerende antistof og dobbeltblokantistof og konfigureret til en fuld forblanding indeholdende primerprobe. 10.000 kopier af ASF-plasmid blev amplificeret ved 4 ℃ i 10 dage eller ved 37 ℃ i 1, 3 og 5 dage. Amplifikationskurven og ændringer i Ct-værdien blev observeret, og virkningerne af traditionelt blokerende antistof og dobbeltblokantistof på stabiliteten af fuld forblandingsreaktionsopløsning blev sammenlignet.
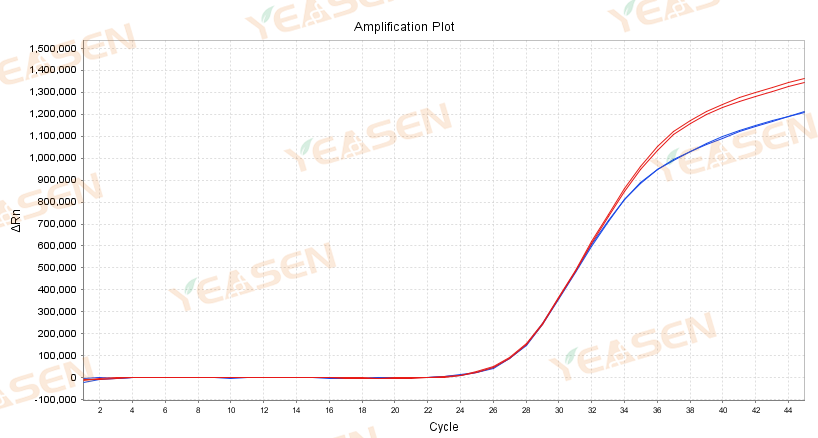
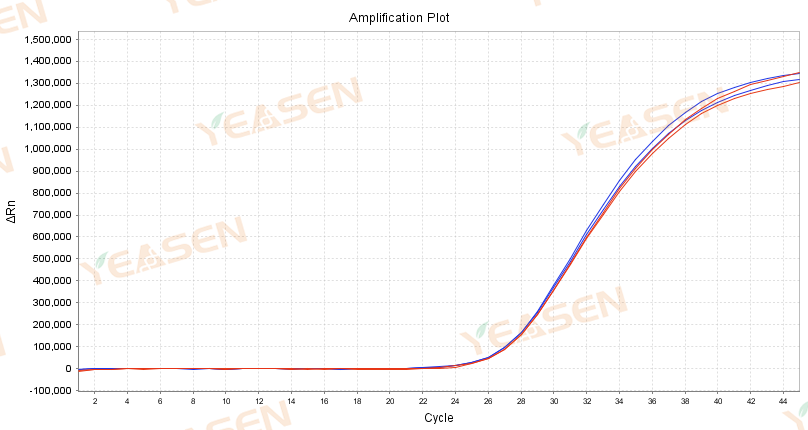
Figur 3.Amplifikationskurve på 10.000 kopier af ASF-plasmid amplificeret med traditionelt blokerende antistof (a) og dobbeltblokerende antistof (b) blokerende reaktionsopløsning; Blå: opbevares ved 4 ℃ i 10 dage; Rød: placeret ved 4 ℃ i 0 dage (kontrol)
Det kan ses af figur 3, at dobbeltblokantistoffet kan opretholde stabiliteten af reaktionsopløsningen og effektivt forbedre stabiliteten af detektionsreagenset end det traditionelle blokerende antistof. Amplifikationskurven og Ct-værdien ændrede sig ikke signifikant, efter at hele forblandingen indeholdende primerproben blev blokeret af et dobbeltblok-antistof og anbragt ved 4 ℃ i 10 dage.
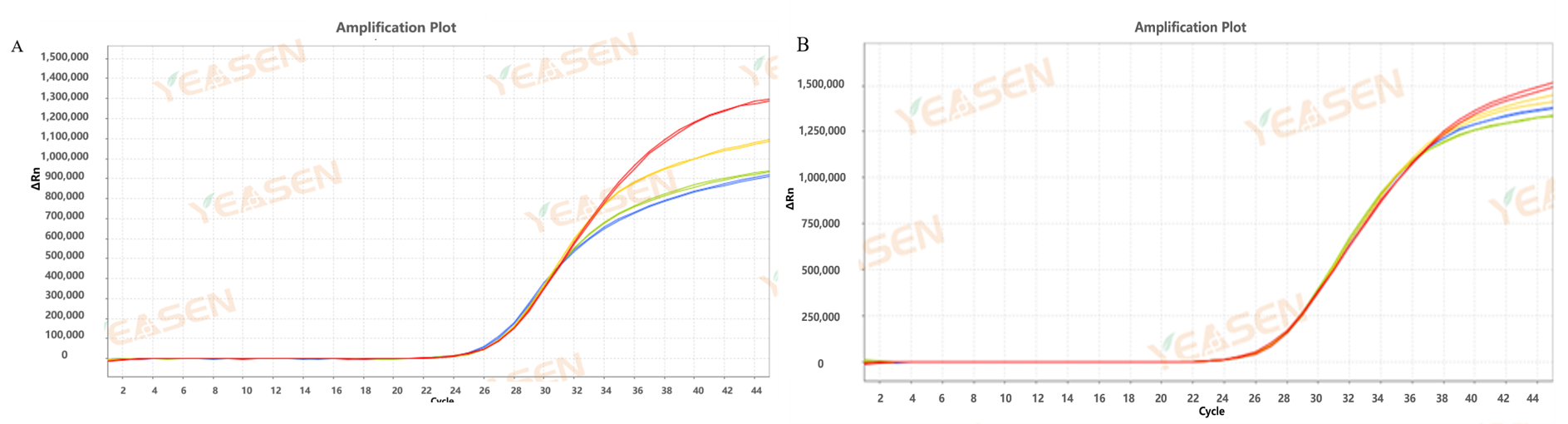
Figur 4. Amplifikationskurve for 10.000 kopier af ASF-plasmid amplificeret med traditionelt blokerende antistof (a) og dobbeltblokerende antistof (b) blokerende reaktionsopløsning; Blå: opbevares ved 37 ℃ i 5 dage; Grøn: 37 ℃ i 3 dage; Gul: 37 ℃ i 1 dag; Rød: placeret ved 37℃ i 0 dage (kontrol)
Det kan ses af figur 4, at dobbeltblokantistoffet kan opretholde stabiliteten af reaktionsopløsningen og effektivt forbedre stabiliteten af detektionsreagenset end det traditionelle blokerende antistof. Dobbeltblok-antistof blokerer hele præmixet, der indeholder primer-proben, og forskellen i Ct-værdi er mindre end 0,2 efter at være blevet anbragt ved 37 ℃ i 1, 3 og 5 dage.
4.4 Dobbeltblok Taq-antistof hjælper med at løse problemet med baseline-afdrift
Når nogle primere samarbejder med en specifik buffer og instrumenter, vil der være baseline-drift. Yeasen prøvede mange metoder til at forbedre baseline-problemet og fandt ud af, at dobbeltblok-antistof var mere befordrende for en stabil baseline.
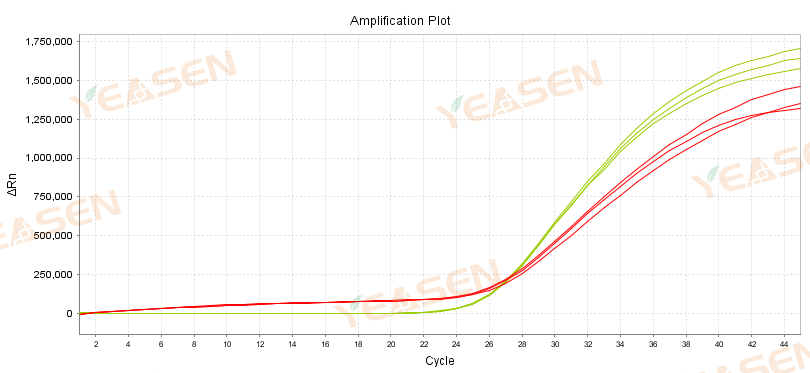

Figur 5. Amplifikationskurve for N-gen (a) og ACT-gen (b); Rød: traditionelt blokerende antistof; Grøn: dobbeltblokerende antistof
Som det kan ses af figur 5, kan anvendelsen af dobbeltblok-antistoffer under specifikke primere og buffere hjælpe med at løse problemet med baseline-drift.
4.5 God linearitet blev opnået ved hjælp af dobbeltblok-Taq-antistof
100.000, 10.000, 1000 og 100 kopier af ASF/ACT-dobbeltplasmider blev amplificeret med reaktionsopløsningen blokeret af et dobbeltblok-antistof, og standardkurven blev lavet.
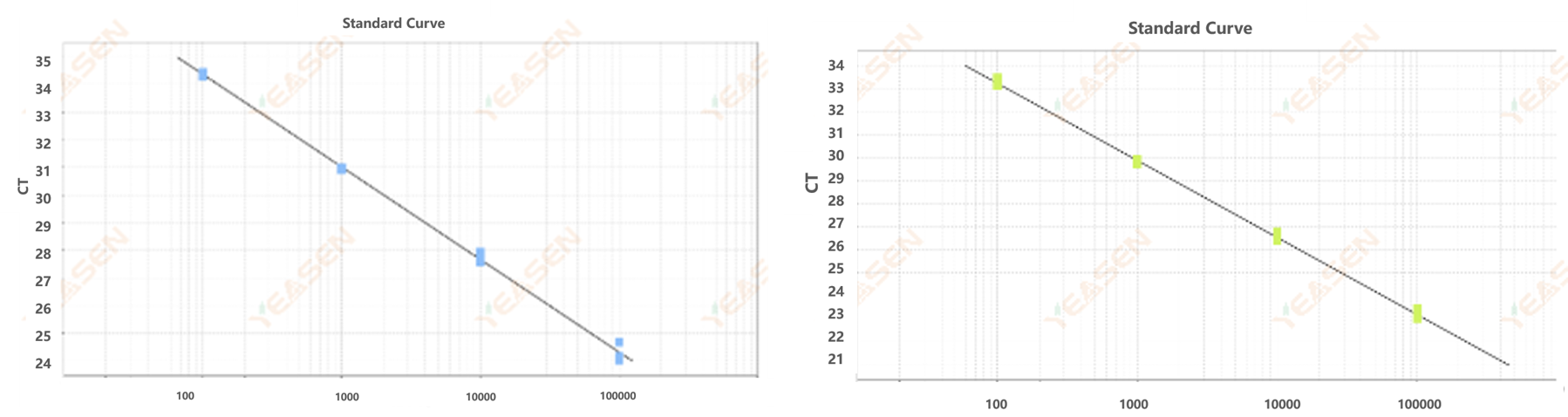
Figur 6. Standardkurver for ASF-gen (a) og ACT-gen (b) produceret af dobbeltblok reaktionsopløsning
Som det kan ses af figur 6, er standardkurven R2 af ASF-genet er 0,998, og amplifikationseffektiviteten er 98,848%; Standardkurven R2 af ACT-genet var 0,998, og amplifikationseffektiviteten var 98,113%.
4.6 Dobbeltblok Taq Antistof kan hurtigt frigive enzymaktivitet
Taq-polymerase blev blokeret med importeret T-firmas antistof og Yeasens dobbeltblok-antistof (kat#31303) og enzymaktiviteten blev detekteret efter varmechok ved 95 ℃ i 20 s. Det kan ses, at 31303 kan frigive mere end 95% af enzymaktiviteten efter varmechok ved 95 ℃ i 20 sek., hvilket svarer til T-firmaets antistof.
Tabel 1. Enzymaktivitet
|
| Protoenzym | Yeasens dobbeltblokerende antistof(95℃, 20 s) | T-firmaets antistof(95℃, 20 s) |
| Enzymaktivitet -U/μL | 2.15 | 2.1 | 2.2 |
4.7 Dobbeltblok Taq Antistof Kan blokere mange typer Taq-enzymer
Tre typer Taq-enzymer (vildtype og 2 mutanter) blev blokeret af Yeasens dobbeltblok-antistof (kat#31303), og blokeringsforholdet var 1 μg: 5 U, hvilket målte fluorescensværdien og forseglingseffektiviteten. Det kan ses, at den blokerende virkning af Yeasens dobbeltblokerende antistof (kat#31303) er bedre for forskellige typer Taq-enzymer.
Tabel 2. Blokeringseffektivitet af forskellige typer Taq-enzymer
|
| Fluorescensværdi | Blokerende effektivitet |
| Tom | 6461,74 |
|
| Protoenzym-Taq000 | 56221,33 |
|
| Protoenzym-Taq019E | 50819,64 |
|
| Protoenzym-Taq019H | 56466.33 |
|
| 31303-Taq000 | 7949,68 | 97,01 % |
| 31303-Taq019E | 8267,35 | 95,93 % |
| 31303-Taq019H | 8015,47 | 96,90 % |
4.8 Yeasens Dobbeltblokeret Taq-antistof havde ingen genomisk rest i mus
Ved at tage vand som skabelonen for den negative kontrol og musegenomet som skabelonen for den positive kontrol, blev 31303 forskellige batches amplificeret. Det blev fundet, at målfragmentet ikke var amplificeret i prøven, hvilket indikerer, at der ikke var nogen musegenomrest i antistoffet.
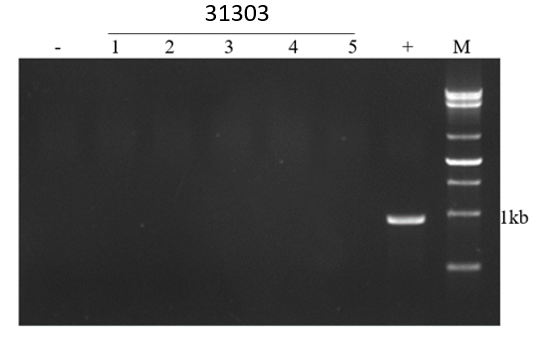
Figur 7. Musegenomrestdetektionsdiagram
Bemærk: - er den negative kontrol, + er en positiv kontrol, og 1-5 er 31303 prøver af forskellige batcher
5. Produktinformation
Produktet leveret af Yeasen er som følger:
Tabel 3.Produktinformation
| Produktnavn | SKU | Specifikationer |
| Hieff™ Dobbelt-blok anti-Taq DNA Polymerase Antistof | 31303ES | 100μg/1mg/5mg/10mg/100mg/1000mg |
| Hieff UNICON™ Hotstart E-Taq DNA-polymerase | 10726ES | 250U/500U/1000U/10KU/100KU |
| Hieff™ Taq DNA-polymerase | 10101ES | 1KU/10KU |
| Hieff UNICON™ Hotstart Taq DNA-polymerase | 10729ES | 250U/500U/1000U/10KU/100KU |
Angående læsning:
Afrikansk svinepestvirus - Total Master Mix/Direkte Amplifikation qPCR-opløsning
