Das kommerzielle HCP-Reagenzienkit von

Konzept und Notwendigkeit der HCP-Erkennung
Biologische Produkte werden typischerweise mithilfe rekombinanter Technologie in Wirtszellen (wie Bakterien, Hefe, Säugetier-, Insekten- oder Pflanzenzellen) hergestellt, darunter monoklonale Antikörper, rekombinante Proteine und Impfstoffe. Bei den Herstellungs- und Reinigungsprozessen dieser Produkte werden zwangsläufig Wirtszellproteine (HCPs) als Verunreinigungen eingeführt, darunter sowohl Strukturproteine der Wirtszellen als auch von den Wirtszellen abgesonderte Wachstumsfaktoren, die eine komplexe Mischung mit verschiedenen physikochemischen und immunologischen Eigenschaften bilden. Trotz des Einsatzes fortschrittlicher Reinigungstechniken können einige Wirtszellproteine immer noch als prozessbedingte Verunreinigungen in Zwischenarzneimitteln verbleiben.
Diese Verunreinigungen sind potenziell immunogen und können die Immunreaktion biopharmazeutischer Produkte verstärken, ihre Stabilität und Wirksamkeit beeinträchtigen und somit ein Risiko für die menschliche Sicherheit darstellen. Daher müssen geeignete Überwachungsstrategien zur Entfernung von HCPs entwickelt und der HCP-Gehalt im Endprodukt kontrolliert werden, um die Anforderungen an die Arzneimittelqualität zu erfüllen.
Regulatorische Anforderungen für HCPs
Der Restgehalt an HCPs in biologischen Produkten wird allgemein als kritisches Qualitätsmerkmal (CQA) des Produkts angesehen, als wichtiger Bewertungsindex für die Überwachung der Prozessrobustheit und als wichtiger Qualitätskontrollindex des Produkts. Aufsichtsbehörden in verschiedenen Ländern haben Bestimmungen bezüglich HCPs erlassen, die eine Analyse und Reinigung von Biopharmazeutika vorschreiben, um den HCP-Gehalt der Wirtszellproteine auf ein akzeptables Niveau zu senken. Die Akzeptanz von HCPs wird anhand spezifischer Umstände beurteilt und hängt von mehreren Faktoren ab, darunter Dosis, Dosierungshäufigkeit, Arzneimitteltyp und Schwere der Erkrankung.
Das chinesische Arzneibuch (Ausgabe 2020) schreibt vor: Für CHO-Zellen muss der Rest-HCP <0,05 % (entspricht weniger als 500 ppm) betragen; für E. coli muss der Rest-HCP <0,01 % betragen.
Im Kapitel USP <1132> der United States Pharmacopeia wird Folgendes festgelegt: Zum Nachweis von HCPs in Arzneimitteln muss eine hochempfindliche Methode verwendet werden und der Gehalt muss unterhalb der Nachweisgrenze liegen (normalerweise weniger als 100 ppm, d. h. der HCP-Gehalt in 1 mg Gesamtprotein sollte weniger als 100 ng oder < 0,01 %) betragen.
Das Europäische Arzneibuch EP 2.6.34 legt fest: In biologischen Produkten sollte der Gehalt an HCPs weniger als 0,1 % betragen.
Die Leitlinien der International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH): ICH Q6B besagen, dass sensible und validierte Methoden zur Überwachung von HCP-Rückständen eingesetzt werden sollten, wobei die Restmenge typischerweise unter 100 ppm liegen muss.
Es ist ersichtlich, dass die Aufsichtsbehörden sehr einheitliche Anforderungen an HCPs stellen. Die Prozessentwicklung biologischer Produkte muss einer HCP-Erkennung unterzogen werden, es muss nachgewiesen werden, dass der Reinigungsprozess HCPs auf sichere Werte senken kann, und die empfohlenen Grenzwerte für den Restgehalt im Endprodukt liegen sowohl in China als auch in den USA unter 0,01 %.
HCP-Erkennungsmethoden
Der Enzyme-Linked Immunosorbent Assay (ELISA) ist derzeit die am häufigsten verwendete Methode zum Nachweis von HCP. Die in den Kapiteln 3412/3413/3414 der Ausgabe 2020 des chinesischen Arzneibuchs genannten Methoden zum Nachweis von Wirtsproteinrückständen sind allesamt ELISA-Methoden.
Im Kapitel USP <1132> der United States Pharmacopeia wird auch erwähnt, dass Methoden wie Elektrophorese, ELISA und LC-MS/MS zum Nachweis des HCP-Gehalts verwendet werden können. Aufgrund seiner einfachen Handhabung, Geschwindigkeit, hohen Empfindlichkeit und seines hohen Durchsatzes wird ELISA als bevorzugte Methode zum Nachweis von HCP empfohlen.
ELISA:
Zweck: Erkennt die Gesamtmenge an Proteinen in HCPs, kann für die Produktentwicklung und Prozesskontrolle verwendet werden und ist derzeit eine gängige Methode zum Nachweis von HCPs.
Vorteile: Hohe Sensitivität und Spezifität; Hoher Durchsatz und Automatisierungsfähigkeit; Quantitativ; Einfache und schnelle Bedienung.
Nachteile: Erfordert spezifische Antikörper; Einzelne HCPs können nicht spezifisch identifiziert und bewertet werden; Die Methodenentwicklung ist komplex und erfordert eine spezielle Antigenpräparation; Viele Einflussfaktoren auf die Methode, HCP-Abdeckung muss bewertet werden; Arten können nicht identifiziert werden.

Western Blotting:
Zweck: Wird für die konsistente Überprüfung einer großen Anzahl von Proben und zum Erkennen unbekannter Proteine verwendet, die mit Anti-HCP-Antikörpern reagieren. Geeignet zum Erkennen von HCPs und zum Bereitstellen ungefährer Informationen zum relativen Molekulargewicht von HCPs.
Vorteile: Spezifität; Ergebnisse sind visuell intuitiv: visualisiert Unterschiede in Proteingröße und Expressionsniveaus; kann spezifische HCPs erkennen und quantifizieren.
Nachteile: Semiquantitativ; Beschränkt auf bestimmte Proteine: kann nur an Antikörper gebundene HCPs erkennen; Nicht empfindlich genug für komplexe Proteinmischungen; Protein-SDS-Denaturierung kann zum Verlust von Konformationsepitopen führen; Die Empfindlichkeit hängt von der Qualität der polyklonalen Antikörper ab.
Zweidimensionale Gelelektrophorese (2-DE):

Zweck: Es wird häufig für die Entwicklung und Charakterisierung von Upstream- oder Downstream-Prozessen verwendet und kann verschiedene HCPs auf einem einzigen Gel unterscheiden.
Vorteile: Kein Western Blotting erforderlich, dadurch werden Übertragungsprobleme vermieden; Spuren von HCP-Verunreinigungen können vom Produkt getrennt werden; Bietet ungefähre Informationen zum relativen Molekulargewicht und isoelektrischen Punkt.
Nachteile: Überschüssiges Protein kann HCP-Flecken verdecken. Die Verteilung der HCPs in der Probe kann beobachtet, aber nicht quantifiziert werden.

Massenspektrometrieanalyse:
Zweck: Identifiziert einzelne HCPs und bietet genaue Identifizierungs- und Quantifizierungsinformationen für Wirtszellproteine.
Vorteile: Hohe Auflösung und Genauigkeit; Identifiziert und überwacht einzelne HCPs; Bietet umfassende Spektren von HCPs; Kann ein breites Spektrum an Proteinen abdecken; Kann HCP-Arten identifizieren.
Nachteile: Hohe Anforderungen an Ausrüstung und Technik; Komplexe Bedienung; Hohe Kosten; Geringer Methodendurchsatz; Komplexe Probenvorbehandlung; Mögliche Matrixeffekte; Erfordert spezielle Datenanalysefunktionen.
ELISA ist die von Arzneibüchern in verschiedenen Ländern empfohlene Methode zum Nachweis von HCP-Rückständen in biologischen Produkten und kann die Gesamtmenge an HCP bestimmen. Es gibt jedoch Einschränkungen bei der Identifizierung der Arten und Häufigkeit von HCP und muss durch andere Methoden ergänzt werden. Jede Nachweismethode hat ihre Vor- und Nachteile, und in praktischen Anwendungen kann die Auswahl unter anderem auf der Grundlage von Versuchszwecken, Probeneigenschaften, Genauigkeit und Bedienkomfort erfolgen, kombiniert mit der Verwendung verschiedener Methoden, um umfassendere und genauere Ergebnisse zu erzielen.
Darüber hinaus legen das US-amerikanische Arzneibuch USP <1132> und das Europäische Arzneibuch EP 2.6.34. HOST-CELL PROTEIN ASSAYS fest, dass in verschiedenen Phasen der Produktentwicklung unterschiedliche ELISA-Reagenzien zum Nachweis von HCP verwendet werden sollten. Dabei werden die Nachweismethoden für HCP in kommerzielle Reagenzien, produkt-/prozessspezifische Methoden und Plattformmethoden eingeteilt.
USP <1132> erwähnt, dass bei Fehlen von Plattformmethoden kommerzielle Reagenzien in präklinischen sowie klinischen Studien der Phase I und Phase II verwendet werden können. Bei klinischen Studien/Prozessvalidierungen der Phase III und bei Produkten nach der Markteinführung sollten aufgrund von Einschränkungen wie z. B. unzureichender Antikörperabdeckung kommerzieller allgemeiner HCP-Nachweisreagenzien Faktoren wie Zelltyp und Prozessspezifität berücksichtigt werden und für die vorgelagerte Prozessentwicklung Plattformmethoden oder produkt-/prozessspezifische Methoden verwendet werden.
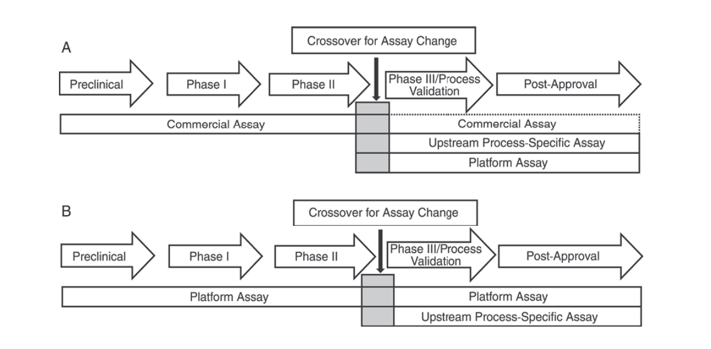
Abbildung 1. In der USP <1132> wird in verschiedenen Phasen der Produktentwicklung die Verwendung spezifischer Methoden zur Erkennung von HCPs vorgeschlagen.
| Verfahren | Kommerzielles Reagenzienkit | Produkt-/Prozessspezifische Erkennung Bausatz | Plattformerkennung Bausatz |
| Verfügbarkeit | Sofort verfügbar
| Erfordert die Herstellung von Antigenen, einschließlich des Klonens von Wirtszelllinien
| Erfordert die Herstellung von Antigenen unter Verwendung von nackten oder leeren Vektorzelllinien
|
| Entwicklung | Erfordert nur minimale Vorbereitung | Die Entwicklung des Nachweises einschließlich Antigencharakterisierung, Immunisierung und Bestätigung dauert in der Regel mindestens 6 Monate | Die Entwicklung des Nachweises einschließlich Antigencharakterisierung, Immunisierung und Bestätigung dauert in der Regel mindestens 9 Monate |
| Diversität | Beschränkt auf die gängigsten Expressionssysteme | Es können verschiedene Expressionssysteme verwendet werden | Es können verschiedene Expressionssysteme verwendet werden |
| Spezifität | Die Spezifität kann gering sein, mit potenziell unentdeckten HCPs
| Die Spezifität wird normalerweise erhöht, da die Antikörperabdeckung auf bestimmte HCP-Muster abzielt | Im Vergleich zu kommerziellen Nachweismethoden ist die Spezifität verbessert, das Verständnis der Nachweisleistung wird verbessert und die Abdeckung von HCP-Typen wird ebenfalls erhöht |
| Kosten | Die Anfangspreise sind relativ niedrig, aber die Entwicklungskosten für den gesamten nachgelagerten Reinigungsprozess werden schnell steigen | Die anfänglichen Kosten sind höher, aber der Break-Even-Punkt liegt normalerweise beim Wert von 100 Sätzen Reagenzienkits | Aufgrund der Anwendbarkeit auf mehrere Produkte bietet es erhebliche Kostenvorteile |
| Abhängigkeit | Abhängig von einem bestimmten Lieferanten befinden sich Reagenzien und Kontrollschemata in einem „Black Box“-Zustand. | Verfügt über umfassende Kontrolle über alle Reagenzien und Puffer, kann jederzeit angepasst werden | Verfügt über die vollständige Verantwortung und Kontrolle über alle Reagenzien, wodurch Risiken in der Lieferkette und die Chargenvergleichbarkeit reduziert werden |
| Regulatorische Anforderungen | Nicht zur Unterstützung des Marketings geeignet Zulassungsanträge | Geeignet für die Unterstützung des gesamten Prozesses von der frühen Entwicklung bis zur Vermarktung lizenzierter Produkte | Geeignet für die Unterstützung der frühen Entwicklung bis zur Marktzulassung |
Tabelle 1.Vergleich verschiedener HCP-Reagenzienkittypen
Maßgeschneiderter HCP-Assay-Entwicklungsservice von Yeasen Biotech
Angesichts der Bedeutung der HCP-Erkennung,
Anpassungszeitleiste
Der Anpassungsservice für Kits zur Erkennung von Wirtszellrückständen dauert normalerweise 6 bis 10 Monate.
Antigen-Antikörper-Vorbereitung: Die Bestimmung von HCP-Antigenen, die Festlegung von HCP-Referenzstandards, die Entwicklung von Immunwegen und -strategien, die Vorbereitung von HCP-Antikörpern usw. dauert normalerweise 4 bis 6 Monate.
Entwicklung von Testkits: Antikörperoptimierung, Abdeckungsanalyse, Validierung der Testkitmethode usw. dauern normalerweise 2 bis 4 Monate.
Yeasen Biotech HCP Antikörper-Abdeckungsüberprüfungsdienst
Es ist bekannt, dass ELISA in der Industrie der Goldstandard zum Nachweis von HCP-Resten ist, aber die Genauigkeit dieser Methode hängt von der Abdeckung durch Multiklon-Antikörper gegen HCP ab. Die United States Pharmacopeia und die European Pharmacopeia erwähnen Immunopurifikation und 2D-WB als empfohlene Methoden zur Charakterisierung von HCP-ELISA-Antikörpern und deren Abdeckung.
HCP-Antikörperabdeckung Überprüfung Service
2D-WB trennt Proteine zunächst mittels zweidimensionaler Gelelektrophorese nach Größe und Ladung und überträgt diese Proteine dann zur Inkubation mit HCP-Antikörpern zur Proteinabdruckerkennung auf eine Membran.
Wir verfügt über einen vollständigen Satz an 2D-WB-Instrumenten und umfangreiche Laborerfahrung, um Dienste zur Überprüfung der Antikörperabdeckung für HCP-Proben aus Wirtszellen wie CHO, E. coli, HEK293 usw. bereitzustellen.
Verwandtes Produkt:
| Produkt | Katalog-Nr. | Größe |
| 36712ES | 48Z/96Z | |
| 36713ES | 48Z/96Z | |
| CHO HCP ELISA-Kit (CHO-K1) | 36714ES | 48Z/96Z |
| E.coli HCP ELISA Kit (Plasmid) | 36721ES | 48Z/96Z |
