Guide de sélection des réactifs de transfection cellulaire in vitro
Les réactifs de transfection cellulaire sont devenus des réactifs courants pour étudier et contrôler la fonction des gènes dans les cellules eucaryotes. Les réactifs de transfection sont largement utilisés dans la recherche sur la fonction des gènes, la régulation de l'expression des gènes et l'analyse des mutations, ainsi que dans la thérapie génique, la thérapie cellulaire, la production de protéines et la production de vaccins. Alors, qu'est-ce que la transfection ? Et comment choisir un type de réactif de transfection en fonction de vos expériences ?
Quels sont les types de transfection ?
Les caractéristiques des réactifs de transfection de Yeasen
Comment choisir un type de réactif de transfection en fonction de vos expériences ?
Cas d'application
Référence pour les conditions de transfection
FAQ
Lecture de respect
Quels sont les types de transfection ?
Selon que l'acide nucléique est intégré ou non dans le chromosome de la cellule hôte après la transfection, il est divisé en « transitoire » (transfection transitoire) et « stable » (transfection stable). L'efficacité de la transfection, la cytotoxicité, les effets sur la physiologie normale et les niveaux d'expression génétique des différentes méthodes de transfection sont différents. Les principes, les applications et les caractéristiques sont comparés dans le tableau suivant :
Tableau 1 Comparaison des différentes méthodes de transfection
| Technologie | Principes | Avantages | Inconvénients |
| Méthode de transfection chimique | |||
| Liposomes cationiques | Les liposomes chargés positivement forment des complexes avec des groupes phosphates chargés négativement d'acides nucléiques et sont endocytés par les cellules. |
|
|
| Coprécipitation du phosphate de calcium | Les complexes ADN-phosphate de calcium s'adsorbent sur les membranes cellulaires et sont endocytés par les cellules |
|
|
| Dextran | Le complexe formé par l'interaction du DEAE-dextran chargé positivement et du squelette phosphate chargé négativement de l'acide nucléique est endocyté par la cellule. |
|
|
| Autres polymères cationiques | Le polymère chargé positivement forme un complexe chargé positivement avec le groupe phosphate chargé négativement de l'acide nucléique, interagit ensuite avec le protéoglycane chargé négativement à la surface de la cellule et pénètre dans la cellule par endocytose. |
|
|
| Méthode de biotransfection | |||
| Transfection virale | L'instinct infecte les cellules et délivre du matériel génétique |
|
|
| Méthode de transfection physique | |||
| Transfert électrique | La tension d’impulsion élevée perturbe le potentiel de la membrane cellulaire et l’ADN est introduit à travers les pores formés dans la membrane. |
|
|
| Biotransmission par apport de particules (bombardement de particules) | L'ADN est précipité avec des particules microscopiques de métaux lourds, puis les particules enrobées sont projetées dans les cellules avec un dispositif balistique, et l'ADN est progressivement libéré et exprimé dans les cellules. |
|
|
| Micro-injection | La micromanipulation est utilisée pour injecter de l’ADN directement dans le noyau de la cellule cible. |
|
|
Les caractéristiques de réactifs de transfection de Yeasen
Pour les réactifs de transfection d'ADN et les réactifs de transfection d'ARN, Yeasen Biotechnology dispose d'une solide équipe de R&D et de production, optimise en permanence les formules, améliore les processus de production et a lancé une variété de produits à base de liposomes cationiques et de polymères cationiques. Les institutions de recherche scientifique et les entreprises proposent une gamme complète de produits, et la gamme de produits couvre tous les domaines impliqués dans les réactifs de transfection.
| Réactif de transfection liposomale sans cellules en suspension Hieff Trans™ | |
| 40802ES | 40805ES |
| 40806ES | 40816ES |
- Haute efficacité : convient à la transfection transitoire ou à la transfection stable de lignées cellulaires.
- Faible toxicité : les cellules transfectées restent bien viables.
- Grande adaptabilité : couverture complète des cellules communes et des cellules primaires difficiles à transfecter.
- Facile à utiliser : convient au milieu en présence de sérum, sans changer le milieu avant et après la transfection.
- Rentable : économique et pratique, efficacité de transfection élevée, prix bas.
Comment choisir un type de réactif de transfection en fonction de vos expériences ?
La sélection des réactifs de transfection doit être effectuée en fonction des différents objectifs expérimentaux et du contenu expérimental, tels que les substances transfectées, les cellules spécifiques, la commodité d'utilisation et d'autres facteurs.
| Produit | Réactif de transfection liposomale sans cellules en suspension Hieff Trans™ | |||
| Type de cellule | cellule conventionnelle | cellule conventionnelle | cellule conventionnelle | cellule conventionnelle |
| / | / | cellules difficiles à transfecter | cellules difficiles à transfecter | |
| Type d'acide nucléique | ADN | ADN | / | ADN |
| ARNsi | ARNsi | ARNsi | / | |
| / | / | miARN | / | |
| / | / | imiter le miRNA | / | |
| / | / | antimiARN | / | |
| Co-transfection ADN/siRNA | Co-transfection ADN/siRNA | / | / | |
| emballage de virus | emballage de virus | / | emballage de virus |
Cas d'application
Réactif de transfection liposomale Hieff Trans™
Hieff Trans™ est fourni sous forme liquide stérile. En général, pour la transfection sur plaque à 24 puits, environ 1,5 μL à chaque fois, 1 mL de Hieff Trans™ peut effectuer environ 660 transfections ; pour une plaque à 6 puits, environ 6 μL à chaque fois, 1 mL de Hieff Trans™ peut faire environ 660 transfections. 160 transfections ;
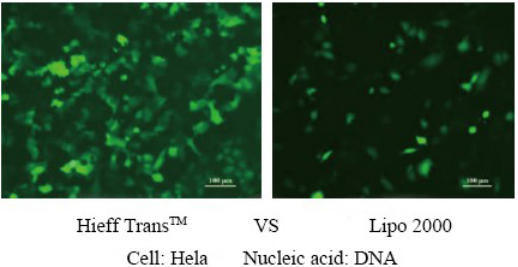
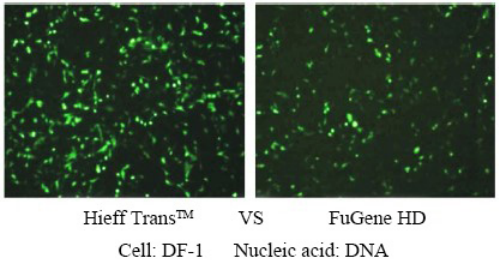
Pour plus de détails, veuillez consulter Confiance dans la transfection avec le réactif Lipofectamine Hieff Trans™
Polyéthylèneimine linéaire (PEI) MW40000 (lyse rapide)
Le PEI 40000 est un polymère cationique hautement chargé d'un poids moléculaire de 40 000 qui lie très facilement les molécules d'acide nucléique chargées négativement, formant un complexe et permettant au complexe de pénétrer dans les cellules. Le PEI 40000 est un réactif de transfection transitoire avec une faible cytotoxicité, une efficacité de transfection élevée et une efficacité d'expression génique élevée dans des cellules telles que HEK293 et CHO. Les réactifs de transfection PEI linéaires ont été validés pour une large gamme de lignées cellulaires, notamment les cellules HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, Sf9, HepG2 et Hela. L'efficacité de transfection peut atteindre 80 à 90 %.
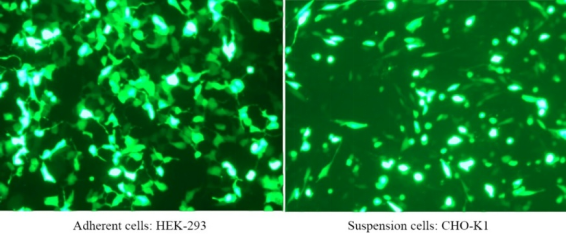
Pour plus de détails, veuillez consulter Nouveau favori pour la transfection —— Linear PEI MW 40000, un réactif de transfection plus efficace
Hieff Trans™ in vitro Réactif de transfection siRNA/miRNA
Ce produit peut atteindre une efficacité d'expression de plus de 90 % de 1 nM d'ARNsi dans une large gamme de lignées cellulaires, évitant ainsi les effets hors cible. Convient à la transfection d'une variété de cellules, notamment Hela, MCF-7, HepG2, CHO et d'autres cellules adhérentes ; et les lignées cellulaires en suspension difficiles à transfecter, telles que les cellules K562 ou THP-1, peuvent atteindre une efficacité de silençage de 80 % ; y compris certaines cellules primaires, les fibroblastes humains primaires et les hépatocytes humains primaires, etc., une efficacité de silençage de 80 % peut être atteinte.
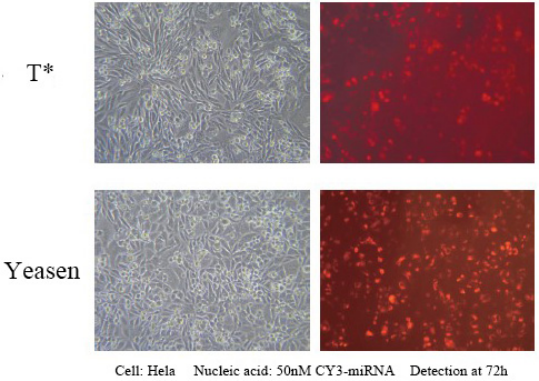
Référence pour les conditions de transfection
En plus des instructions pour chaque produit, les clients opèrent en fonction de leur contenu expérimental spécifique, et il y aura des différences dans la quantité d'utilisation. Selon les conditions de transfection cellulaire in vitro rapportées par les clients après avoir utilisé le produit, elles ont été triées pour votre référence.
| Nom du produit/Numéro d'article | |||||
| Cellule | Récipient de culture | Densités de placage cellulaire | ADN | Transistor Hieff | Efficacité de la transfection |
| A549 | 6 puits | 90% | 0,7 μg | 1,15 μL | +++ |
| BV 2 | 24 puits | 95% | 0,2 μg | 0,2 μL | ++ |
| C2C12 | 24 puits | 80% - 90% | 1 μg | 5 μL | ++ |
| DF 1 | 24 puits | 80% - 90% | 0,5 μg | 0,5 μL | +++ |
| H520 | 6 puits | 80% | 1.2 μg | 6 μL | ++ |
| HaCaT | 96 puits | 70% | 100 ng | 1 μL | ++ |
| HCT116 | 6 puits | 90% | 4 μg | 10 μL | ++ |
| HEK 293 | 6 puits | 95% | 2 μg | 10 μL | 80 - 90% |
| HEK 293FT | 24 puits | 85% | 1 μg | 4 μL | 90% |
| HEK 293T | 12 puits | 1×105 | 1 μg | 2 μL | +++ |
| HEK 293T (suspension) | 30 ml | 80% | 30 μg | 60 μL | ++ |
| Héla | 12 puits | 90% | 0,2 μg | 0,6 μL | 90% |
| Héla | 12 puits | 80% | 1 μg | 3 μL | +++ |
| Hépatite G2 | 12 puits | 80% | 1 μg | 3 μL | ++ |
| HUVEC | 24 puits | 80% | 1 μg | 2 μL | ++ |
| MCF10A | Plat de 10 cm | 60% | 5 μg | 15 μL | ++ |
| N2A | 24 puits | 70% - 80% | 300 ng | 900 μL | + |
| NCI H1975 | 6 puits | 80% | 4 μg | 10 μL | +++ |
| NIH 3T3 | 6 puits | 90% | 4 μg | 10 μL | +++ |
| Brut 264.7 | Plat de 35 mm | 80% | 1 μg | 2 μL | 90% |
| Véro | 6 puits | 80% | 3 μg | 9 μL | +++ |
| Cellule | Récipient de culture | Densités de placage cellulaire | ARNsi | Transistor Hieff | Efficacité de la transfection |
| HK2 | 6 puits | 65% | 100 pmol | 6 μL | +++ |
FAQ
1 réactif de transfection liposomale Hieff Trans™
1.1 Q : Le sérum peut-il être présent lors de la préparation de complexes de réactifs de transfection d’acide nucléique ?
R : La présence de sérum affecte la formation des liposomes. Il est recommandé d'utiliser un milieu sans sérum (généralement un milieu MEM) lors de la préparation de complexes réactifs de transfection d'acides nucléiques.
1.2 Q : À quoi dois-je faire attention lorsque j'utilise le réactif de transfection d'acide nucléique liposomal Hieff Trans™ ?
UN:
1) Lorsque les cellules sont transfectées, la densité cellulaire est de préférence de 80 à 95 %, et la densité de placage spécifique est déterminée en fonction de la situation des cellules ;
2) L’utilisation d’ADN de haute pureté permet d’obtenir une efficacité de transfection plus élevée ;
3) L’ADN et les réactifs de transfection doivent être dilués avec le milieu sans sérum lors de la préparation des complexes de transfection ;
4) Les antibiotiques ne peuvent pas être ajoutés au milieu pendant la transfection ;
5) Les réactifs doivent être conservés entre 2 et 8 °C et il faut veiller à ne pas ouvrir le couvercle de manière répétée pendant une longue période ;
6) La concentration d'ADN et le nombre de réactifs liposomiques cationiques doivent être optimisés lors de la première utilisation afin d'obtenir une efficacité de transfection maximale. Le rapport ADN/réactif de transfection est généralement recommandé entre 1:2 et 1:3.
1.3 Q : Est-il nécessaire de l’arrêter après la transfection ?
R : Pas besoin. Les complexes liposomiques sont stables pendant 6 heures. Si le milieu cellulaire n'est pas modifié avant la transfection, afin de garantir les nutriments nécessaires à la croissance cellulaire normale, il est nécessaire de changer de milieu après 4 à 6 heures. Cependant, si le milieu a été modifié avant la transfection, il n'est pas nécessaire de le changer après la transfection des liposomes.
1.4 Q : Peut-on réaliser une co-transfection d'ADN et d'ARNsi ? Quel est l'effet ?
R : Oui, lorsque l’ADN et l’ARNsi sont co-transfectés, l’efficacité de la transfection de l’ARNsi sera légèrement moins bonne.
1.5 Q : Le réactif de transfection peut-il être utilisé pour la transfection d’un emballage lentiviral ?
A : L’empaquetage lentiviral est possible.
1.6 Q : Les cellules en suspension peuvent-elles être transfectées avec le réactif de transfection d’acide nucléique liposomal Hieff Trans™ ?
A : Le réactif de transfection d'acide nucléique liposomal Hieff Trans™ peut être utilisé pour la transfection de cellules en suspension, voir le protocole pour plus de détails. De plus, nous avons également introduit un réactif de transfection spécifiquement destiné aux cellules en suspension (réf.40805, réactif de transfection liposomale sans cellules en suspension Hieff Trans™)
2 Hieff Trans™ in vitro Réactif de transfection siRNA/miRNA
2.1 Q : Le réactif de transfection doit-il être changé après la transfection ?
R : Ce problème peut être divisé en deux cas : 1. S'il n'y a pas de changement de milieu avant la transfection, le milieu doit être changé environ 6 heures après la transfection pour assurer les nutriments nécessaires à la croissance cellulaire ; 2. S'il y a un changement de milieu avant la transfection, peut-on procéder selon le fonctionnement normal des cellules cultivées ? ? Après l'opération de changement de liquide ?
2.2 Q : Les réactifs de transfection peuvent-ils être congelés ?
R : Il ne peut pas être congelé, car le réactif de transfection est un réactif de transfection cationique PEI. La congélation à basse température détruira l'activité du réactif de transfection PEI. Par conséquent, il est préférable de le conserver à 2-8 °C pour maintenir la meilleure efficacité de transfection.
Informations sur le produit
| Nom du produit | UGS | Caractéristiques |
| Réactif de transfection liposomale Hieff Trans™ | 40802ES02 | 0,5 ml |
| 40802ES03 | 1,0 ml | |
| 40802ES08 | 5×1mL | |
| Réactif de transfection liposomale sans cellules en suspension Hieff Trans™ (renseignements) | 40805ES02 | 0,5 ml |
| 40805ES03 | 1,0 ml | |
| 40805ES08 | 5×1 mL | |
| Hieff Trans™ in vitro Réactif de transfection siRNA/miRNA (Renseigner) | 40806ES02 | 0,5 ml |
| 40806ES03 | 1,0 ml | |
| Polyéthylèneimine linéaire (PEI) MW40000(lyse rapide) | 40816ES02 | 100 mg |
| 40816ES03 | 1 g | |
| 40816ES08 | 5×1 g |
Quelques articles publiés à l'aide de nos produits
[1] Liu R, Yang J, et al. Contrôle optogénétique de la fonction et du métabolisme de l'ARN à l'aide de protéines de liaison à l'ARN photosensibles. Nat Biotechnol. 3 janvier 2022. (IF:55)
[2] Luo J, Yang Q, et al. TFPI est un récepteur cryptique colique pour TcdB du clade 2 hypervirulent C. difficile. Cell. 17 mars 2022. (IF:41.582)
[3] Zhou J, Chen P, et al. Variantes Cas12a conçues pour un effet hors cible moindre à l'échelle du génome grâce à une reconnaissance PAM rigoureuse. Mol Ther. 5 janvier 2022. (IF : 11.454)
[4] Chen S, Cao X, et al. circVAMP3 entraîne une séparation de phase de CAPRIN1 et inhibe le carcinome hépatocellulaire en supprimant la traduction de c-Myc. Adv Sci (Weinh). 24 janvier 2022. (IF : 16.808)
[5] Gu C, Wang Y, et al. AHSA1 est une cible thérapeutique prometteuse pour la prolifération cellulaire et la résistance aux inhibiteurs du protéasome dans le myélome multiple. J Exp Clin Cancer Res. 6 janvier 2022. (IF:11.161)
[6] Zhang Y, Yu X, et al. Le facteur d'épissage riche en arginine/sérine 8 favorise la malignité du myélome multiple et les lésions osseuses par l'épissage alternatif de CACYBP et la communication cellulaire basée sur les exosomes. Clin Transl Med. 2022 février (IF : 11.492)
[7] Qin J, Cai Y, et al. Mécanisme moléculaire de l'agonisme et de l'agonisme inverse dans le récepteur de la ghréline. Nat Commun. 13 janvier 2022. (IF:14.9)
[8] Tang X, Deng Z, et al.Une nouvelle protéine codée par circHNRNPU favorise la progression du myélome multiple en régulant le microenvironnement de la moelle osseuse et l'épissage alternatif. J Exp Clin Cancer Res. 8 mars 2022. (IF:11.161)
[9] Xie F, Su P, et al. Ingénierie de vésicules extracellulaires enrichies en ACE2 palmitoylée comme traitement contre la COVID-19. Adv Mater. 19 octobre 2021. (IF : 30.849)
[10] Liang Y, Lu Q, et al. Réactivation du suppresseur de tumeur dans le cancer du sein par commutation d'amplificateur via le réseau NamiRNA. Nucleic Acids Res. 7 septembre 2021 (IF : 16,9)
[11] Fan Y, Wang J, et al. CircNR3C2 favorise l'effet suppresseur de tumeur médié par HRD1 via l'épongement du miR-513a-3p dans le cancer du sein triple négatif. Mol Cancer. 2 février 2021. (IF:27.403)
[12] Dai L, Dai Y, et al. Aperçu structurel du recrutement du complexe BRCA1-BARD1 dans la chromatine endommagée. Mol Cell. 1er juillet 2021 (IF : 17,97)
[13] Zhang K, Wang A, et al. L'axe UBQLN2-HSP70 réduit les agrégats de poly-Gly-Ala et atténue les défauts comportementaux dans le modèle animal C9ORF72. Neuron. 16 juin 2021. (IF:17.17)
[14] Li T, Chen X, et al. Un dispositif optogénétique synthétique basé sur BRET pour l'expression pulsatile de transgènes permettant l'homéostasie du glucose chez la souris. Nat Commun. 27 janvier 2021. (IF:14.92)
[15] Yan F, Huang C, et al. La ribosylation de l'ubiquitine par la thréonine ADP par une famille d'effecteurs bactériens bloque l'ubiquitination de l'hôte. Mol Cell. 21 mai 2020. (IF:17.97)
[16] Sun X, Peng X, et al. L'ADNP favorise la différenciation neuronale en modulant la signalisation Wnt/β-caténine. Nat Commun. 12 juin 2020. (IF:14.911)
[17] Yang X, Wang H, et al. Le recâblage de la signalisation ERBB3 et ERK confère une résistance à l'inhibition de FGFR1 dans le cancer gastro-intestinal porteur d'une mutation ERBB3-E928G. Protein Cell. 2020 déc. (IF : 14.872)
[18] Zou Y, Wang A, et al. Analyse des paysages et de la dynamique redox dans les cellules vivantes et in vivo à l'aide de capteurs fluorescents génétiquement codés. Nat Protoc. 2018 Oct.(IF:13.490)
[19] Hao H, Hu S, et al. La perte de CXCR7 endothéliale altère l'homéostasie vasculaire et le remodelage cardiaque après un infarctus du myocarde : implications pour la découverte de médicaments cardiovasculaires. Circulation. 28 mars 2017. (IF:29.69)
Lecture de respect
Réactif de transfection – Hieff Trans™ et PEI
PEI linéaire MW 40000, un réactif de transfection plus efficace
