La thérapie cellulaire fait référence à l'utilisation de méthodes biotechnologiques pour obtenir des cellules dotées de fonctions spécifiques, qui sont ensuite améliorées par des processus tels que l'expansion ex vivo et la culture spécialisée. Ces cellules sont dotées de réponses immunitaires accrues, de capacités de destruction des cellules pathogènes et tumorales et d'autres fonctions pour atteindre les objectifs thérapeutiques de certaines maladies. La thérapie génique fait référence à l'approche thérapeutique consistant à modifier l'expression des gènes individuels ou à réparer les gènes défectueux par des méthodes telles que l'ajout de gènes, la modification de gènes et le silençage génique. Le but ultime est de guérir les maladies en rectifiant les gènes anormaux.
| Produit Types | Description | Nombre de Approuvé Médicaments Mondial |
| Gène Thérapie Vecteur Produits | Ces produits utiliser gène thérapie vecteurs à livrer thérapeutique gènes à spécifique cellules dans le du patient tissus, visée pour le expression ou règlement de thérapeutique protéines. Ce catégorie s'appuie sur sur le livraison de gène thérapie vecteurs. | 2 |
| Cellulaire Produits | En utilisant intégrer viral vecteurs (tel comme lentiviral vecteurs), gènes sont introduit dans précurseur cellules ou tige cellule génomes sous ex en direct conditions. Comme cellules diviser, le gènes sont passé à descendant cellules. Le modifié cellules sont alors infusé dos dans le patient. Cellulaire produits principalement inclure catégories tel comme T cellules, Corée du Nord cellules, et tige cellules. | 8 |
| Oncolytique Virus Produits | Dérivé depuis modifié oncolytique virus avec tuer la tumeur capacités, ces produits travail sur le principe de utilisant le virus spécifique reconnaissance de tumeur cellules et le immunitaire activation déclenché sur infectant tumeur cellules. Ce conduit à ciblé meurtre de tumeur cellules. | 1 |
Solution de production et d'expression de vecteurs viraux
Le cœur de la production de médicaments pour thérapie cellulaire et génique (CGT) réside dans l'expression de vecteurs viraux, un processus qui implique généralement à la fois l'expression du vecteur en amont et la purification en aval. La production de vecteurs implique des processus très complexes, présente des défis importants et comporte souvent de longs cycles de préparation. Par conséquent, la capacité mondiale de production GMP de vecteurs viraux approche d'un goulot d'étranglement, ce qui constitue un obstacle majeur au développement de l'ensemble du secteur de la thérapie génique. Le développement, la mise à l'échelle et la production GMP de vecteurs de thérapie génique impliquent des systèmes de production complexes et des systèmes de contrôle qualité rigoureux. Ceux-ci englobent des processus tels que la création de banques de souches, de cellules et de virus, la production à grande échelle d'E.fermentation de C. coli, processus de culture cellulaire, processus de récolte et de purification de virus, traitement aseptique et processus de formulation et de remplissage.
 Coûts de production de l'AAV
Coûts de production de l'AAV
Outre les investissements en immobilisations (tels que les équipements, les salles blanches, etc.) et les coûts de main-d'œuvre, les principales dépenses proviennent de la consommation de matériaux dans les processus en amont et en aval. Les coûts en amont concernent principalement les matières premières telles que les plasmides, les milieux de culture, les réactifs de transfection et les nucléases ; les coûts en aval comprennent principalement les résines de chromatographie, les dépenses de contrôle qualité, etc.
Support polymère cationique
Les polymères cationiques (polymères) comprennent la polyéthylèneimine (PEI), le poly(bêta-amino ester) (PBAE), le chitosane, le polyacrylamide (PAH), le diéthylaminoéthyl dextrane (DEAE-dextrane), les dendrimères poly(amidoamine) (PAMAM) et d'autres. Le principe commun de la transfection de polymères cationiques consiste à complexer l'ADN dans des conditions de pH physiologique pour empêcher la dégradation par la DNase. Par la suite, ces complexes se fixent à la membrane cellulaire et sont absorbés par endocytose, suivie de la rupture et de la libération de l'ADN dans le cytoplasme pour exercer leurs fonctions prévues. La principale distinction entre les polymères cationiques et les lipides cationiques réside dans l'absence de parties hydrophobes dans les polymères cationiques, ce qui les rend complètement solubles dans l'eau et permet des modifications chimiques pratiques.
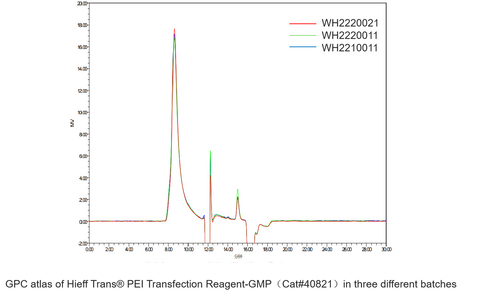
Réactifs de transfection Hieff Trans® PEI

| Test Article | Standard | Recherche et développement Grade (40820) | BPF Grade (40821) |
| UNapparence | Complet, précis information, Non dommage, etc. | √ | √ |
| Transfection etefficacité | > 70% Transfection efficacité> 80% Cellule viabilité | √ | √ |
| Endotoxin | < 0,5 UE/mL | √ | √ |
| Stérilité | Aseptique croissance | √ | √ |
| Mycoplasme Résidu | Nnégatif | √ | √ |
| pH | < 7.0 | √ | |
| Osmotique Plassurer | ≤ 30 mOsm/kg | √ | |
| Impureté Rrésidu | Méthanol(≤ 0.3%) Éthyle éther(≤ 0,5%) Méthylbenzène(≤ 0,002%) | √ | |
| Lourd Metal Rrésidu | ≤ 10 ppm |
| √ |
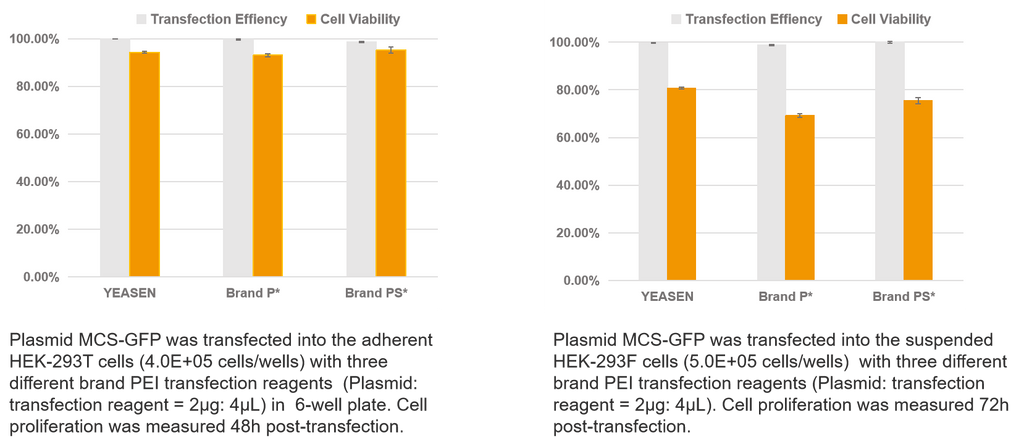
Transfection d'un seul plasmide
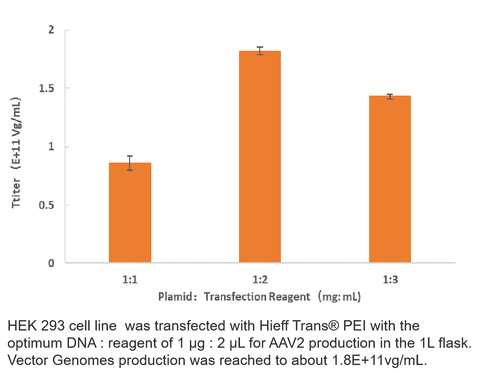
Données sur le titre du virus
1. Production de LV

2. Production de l'AAV2
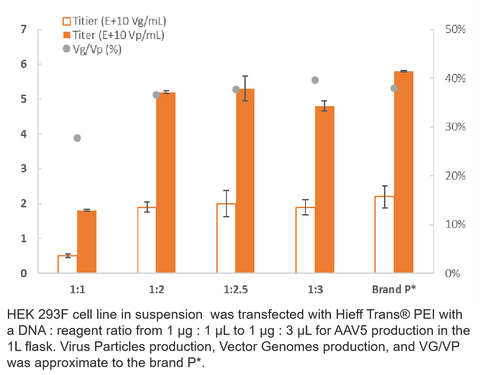
3. Production de l'AAV5
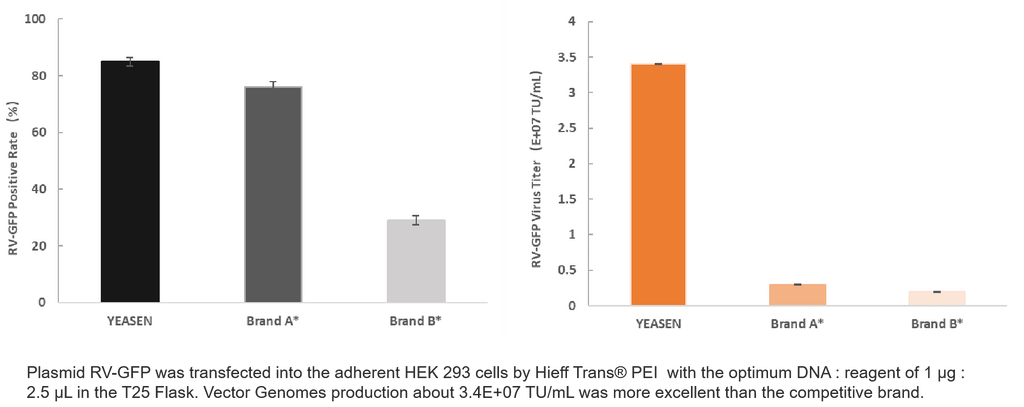
4. Production de véhicules récréatifs
Informations sur le produit
| Nom du produit | N° de chat. |
| Réactif de transfection Hieff Trans® PEI-GMP | 40821ES |
| Kit de détection des résidus d'ADN des cellules hôtes d'E.coli | 41308ES |
| Kit de détection des résidus d'ARN des cellules hôtes d'E.coli | 41318ES |
| Kit ELISA E.coli HCP | 36712ES |
| Kit ELISA pour détection de la protéine HCP HEK293 | 36713ES |
| Kit de détection des résidus d'ADN de la cellule hôte HEK293 | 41302ES |
| Kit d'analyse de la taille de l'ADN résiduel de la cellule hôte HEK293 | 41316ES |
| Kit de détection de mycoplasmes par qPCR en temps réel MycAway™ (2G) | 40619ES |
| UCF.ME® UltraNuclease de qualité GMP | 20157ES |
| Sel actif UltraNuclease de qualité GMP | 20159ES |
| Kit ELISA UltraNuclease | 36701ES |
| Kit ELISA UltraNuclease actif au sel | 36703ES |
| Kit de détection du nombre de copies RCA (E1A) | 41321ES |
| Kit de détection de lentivirus compétent pour la réplication (RCL) | 41311ES |
| Kit de préparation d'échantillons d'ADN résiduel magnétique MolPure™ | 18461ES |
