O rápido avanço da biotecnologia teve um impacto profundo no combate a doenças infecciosas como a COVID-19 por meio da criação de vacinas de mRNA produzidas por meio da tecnologia de síntese de RNA in vitro. Várias empresas, incluindo a Moderna nos Estados Unidos, a CureVac na Alemanha e a BioNTech na Alemanha, não apenas desenvolveram vacinas terapêuticas de mRNA, mas também tratamentos para condições como tumores, doenças infecciosas e doenças crônicas.
A pesquisa e formulação de vacinas de mRNA necessitam de uma gama diversificada de matérias-primas para garantir seu desenvolvimento bem-sucedido. Como uma força pioneira na indústria de enzimas moleculares, a
Para garantir tanto a qualidade do produto quanto a capacidade de produção, a
1. Vantagem do GMP
2.
3.
4. Cenários de aplicação dos produtos
5. Matérias-primas para preparação da vacina de mRNA fornecidas pela
6. Informações sobre pedidos
1. Vantagem do GMP
"Grau GMP" é um termo de marca que a
Tabela 1. Vantagem do GMP
| Controles de qualidade | Nível de pesquisa | Grau GMP |
| Livre de animais | Podem ser utilizados materiais de origem animal | Certificados livres de animais podem ser fornecidos, se necessário |
| Caracterização do banco de células | Menos rigoroso | Rigoroso (em conformidade com os regulamentos GMP) |
| Informações de rastreabilidade para matérias-primas e produtos acabados | Menos rigoroso | Rigoroso (em conformidade com os regulamentos GMP) |
| Controle do nível de endotoxina | / | Rigoroso |
| Controle estéril | / | Rigoroso |
| Registros de lote para fabricação e teste | Menos rigoroso | Rigoroso (registros de lote podem ser fornecidos se necessário) |
| Relatório de validação de processo | / | O relatório pode ser fornecido se necessário |
| Sistema de controle de mudanças | Auto-avaliação | Rigoroso (em conformidade com os regulamentos GMP) |
| Sistema de gestão da qualidade | Auto-avaliação | Certificação ISO 13485 |
| Número DMF | / | Sim (relatórios) |
2. Yeasen pode fornecer produtos de qualidade GMP
Aproveitando ampla experiência e excelência técnica em desenvolvimento de enzimas e produção em escala industrial, a
A unidade de produção de enzimas moleculares da
3. Yeasen adquiriu números DMF para muitos produtos
Os arquivos mestres de medicamentos (DMFs) são documentos confidenciais enviados voluntariamente à Food & Drug Administration (FDA) dos EUA. Eles contêm informações detalhadas sobre instalações, processos ou artigos utilizados na produção, processamento, embalagem e armazenamento de produtos farmacêuticos humanos.
O FDA examina o conteúdo técnico de um DMF quando um fabricante de ingrediente farmacêutico ativo (API) faz referência a ele para dar suporte ao seu Pedido de Novo Medicamento Investigacional (IND), Pedido de Novo Medicamento (NDA), Pedido de Novo Medicamento Abreviado (ANDA) ou Pedido de Exportação. Os DMFs desempenham um papel fundamental nesses pedidos.Quando os fabricantes registram DMFs para materiais específicos, o processo de aprovação do FDA pode ser significativamente acelerado.
A
4. Cenários de aplicação dos produtos Yeasen
4.1 Geração de Template
A linearização do plasmídeo é uma etapa indispensável durante a geração de moldes quando vetores plasmídeos são usados como moldes de transcrição. À medida que a transcrição prossegue até o final dos moldes de DNA, a linearização do plasmídeo garante que transcrições de RNA de um comprimento e sequência definidos sejam geradas. A
4.2 Em vitro Transcrição ( IVT )
A transcrição in vitro é afetada por vários fatores. Enzimas, tampões e substratos modificados têm um grande impacto na eficiência da transcrição.
Com base na plataforma ZymeEditor, a YEASEN Biotech desenvolveu novas polimerases de RNA T7 que reduzem significativamente a geração de dsRNA durante o processo de transcrição in vitro (IVT) (T7 RNA polimerase, RNA ds baixo, 250 U/μL). Ele reduz muito a imunogenicidade do mRNA e, até certo ponto, aumenta a integridade do mRNA. Espera-se que esse desenvolvimento desempenhe um papel crucial no avanço do desenvolvimento de vacinas de mRNA e medicamentos contra o câncer.

Ao otimizar o tampão e ajustar o tipo de sal do substrato nucleotídico, melhoramos muito a eficiência da transcrição e reduzimos a produção de dsRNA.

Figura 2. Tris NTP pode aumentar muito a eficiência do lVT e reduzir a produção de dsRNA
4.3 Capping de mRNA
Como uma estrutura cap 5' reduz a imunogenicidade e é necessária para a tradução eficiente de mRNAs, é necessário adicionar estruturas cap às extremidades 5' do mRNA gerado pela transcrição.
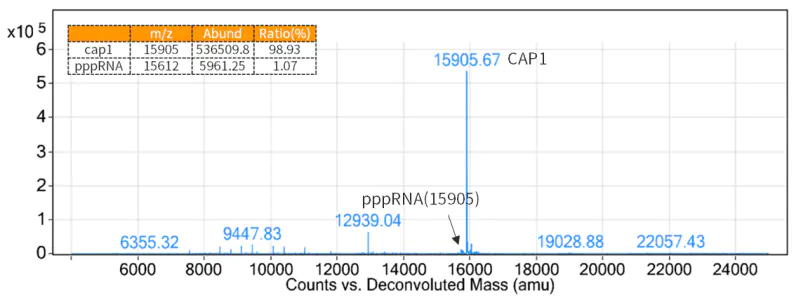
Figura 3. Resultados da detecção da taxa de capitalização (detecção LC-MS)
4.4 Purificação de mRNA
A purificação é uma etapa indispensável para obter mRNAs de alta pureza.
5. Matérias-primas para preparação da vacina de mRNA fornecidas pela Yeasen
Atualmente, a
Tabela 2.Matérias-primas para preparação da vacina de mRNA fornecidas pela
| Preparação do modelo | Transcrição in vitro | ||
| 2× Hieff Canace AdvanceFast Mistura principal de PCR de alta fidelidade | 10164ES | 10623ES | |
| 10122ES | 10625ES | ||
| 10922ES | 10672ES | ||
| 10300ES | 10621ES | ||
|
| 10611ES | ||
| 10661ES | 10133ES | ||
| RNAse R (20U/uL) | 14615ES | 10650ES | |
| Xba eu | 10662ES | 10651ES | |
| Tampando |
| Purificação |
|
| 10614ES | 12602ES | ||
| 10612ES | Rack de separação magnética | 80460ES | |
| 10619ES | 36717ES | ||
| 10681ES |
| ||
6. Informações sobre pedidos
Os seguintes são produtos representativos oferecidos pela
Tabela 3. Informações para pedidos
Sobre a leitura:
Reagentes de grau GMP para síntese in vitro de mRNA
DNase I e suas aplicações em biomedicina
Referências:
[1] Chaudhary, N., Weissman, D., & Whitehead, KA (2021). Vacinas de mRNA para doenças infecciosas: princípios, administração e tradução clínica. Nature reviews. Descoberta de medicamentos, 20(11), 817–838.
[2] Vogel, AB et al. As vacinas de RNA autoamplificadoras oferecem proteção equivalente contra a gripe às vacinas de mRNA, mas
em doses muito mais baixas. Terapia molecular: o jornal da Sociedade Americana de Terapia Genética 26, 446-455,
[3] Fuchs, AL, Neu, A. & Sprangers, R. Um método geral para produção em larga escala, rápida e econômica de 5'
RNA encapsulado. RNA (Nova York, NY) 22, 1454-1466, doi:10.1261/rna.056614.116 (2016).
[4] Schmid, A.Considerações para a produção de vacinas de mRNA para ensaios clínicos. Métodos em biologia molecular (Clifton, NJ) 1499, 237-251,
[5] Banerji, A. et al. Vacinas de mRNA para prevenir a doença da COVID-19 e reações alérgicas relatadas: evidências atuais e abordagem sugerida. O jornal de alergia e imunologia clínica. Na prática 9, 1423-1437,
[6] Richner, JM et al. Vacinas de mRNA modificadas protegem contra a infecção pelo vírus Zika. Cell 168, 1114-1125.e1110,
[7] Corbett, KS et al. O design da vacina de mRNA SARS-CoV-2 foi possibilitado pela preparação do protótipo do patógeno. Nature 586,567-571,
[8] Corbett, KS et al. mRNA-1273 protege contra infecção beta por SARS-CoV-2 em primatas não humanos. Nature immunology 22, 1306-1315,
[9] Keech, C. et al. Ensaio de fase 1-2 de uma vacina de nanopartículas de proteína spike recombinante SARS-CoV-2. The New England journal of medicine 383, 2320-2332,
[10] Kramps, T. & Elbers, K. Introdução às vacinas de RNA. Métodos em biologia molecular (Clifton, NJ) 1499, 1-11,
[11] Linares-Fernández, S., Lacroix, C., Exposito, JY & Verrier, B. Adaptação da vacina de mRNA para equilibrar a resposta imune inata/adaptativa. Tendências em medicina molecular 26, 311-323,
