إن تقنية التسلسل عالي الإنتاجية، والتي يشار إليها غالبًا بتقنية التسلسل من الجيل التالي (NGS)، تمثل قفزة كبيرة إلى الأمام من طرق تسلسل الحمض النووي الأولية، مثل تسلسل سانجر. تسمح تقنية التسلسل من الجيل التالي بتحليل مئات الآلاف، إن لم يكن الملايين، من تسلسلات جزيئات الأحماض النووية في وقت واحد. وتشمل مزاياها الإنتاجية الاستثنائية، والفعالية من حيث التكلفة، وقابلية التوسع، ومجموعة واسعة من التطبيقات، مما يجعلها تقنية التسلسل السائدة في جميع أنحاء العالم.
يشتمل سير عمل تسلسل NGS على أربع مراحل أساسية: تحضير العينة، وبناء المكتبة، والتسلسل، وتحليل البيانات. ويتمثل العنصر الأساسي في بناء المكتبة في ربط تسلسلات محولات منصة NGS القياسية بكلا طرفي الحمض النووي الجينومي المجزأ. تهدف هذه الخطوة إلى توليد إمداد وفير من جزيئات الأحماض النووية في المكتبة، المعدة للتسلسل على أداة NGS من خلال تضخيم تفاعل البوليميراز المتسلسل. اعتمادًا على طبيعة العينة، يمكن تصنيف بناء مكتبة NGS إلى بناء مكتبة DNA وبناء مكتبة RNA. تلعب الإنزيمات دورًا محوريًا في هذه التجارب المترابطة. إذن، ما هي الإنزيمات الرئيسية التي تشارك في عملية بناء المكتبة؟
الشكل 1. سير عمل التسلسل الجيني للجيل التالي[2]
1. بناء مكتبة الحمض النووي وأنزيماتها الرئيسية
2. بناء مكتبة الحمض النووي الريبي وأنزيماتها الرئيسية
3. إرشادات حول إنزيمات NGS الأساسية في بناء مكتبة DNA وRNA
1. بناء مكتبة الحمض النووي وأنزيماتها الرئيسية
في عملية بناء مكتبة الحمض النووي، يعد بناء مكتبة محول ربط استنساخ TA الوسيلة التكنولوجية الأكثر استخدامًا في الوقت الحاضر. عملية بناء المكتبة الرئيسية هي كما يلي:

الشكل 2. عملية بناء مكتبة الحمض النووي (Illumina)
1.1 تجزئة الحمض النووي
عادةً ما يكون طول التسلسل في أجهزة التسلسل الحالية في نطاق 150-500 زوج قاعدي (bp). ونتيجة لذلك، يصبح من الضروري استخدام طرق التفتيت الميكانيكية أو الإنزيمية لتفتيت شظايا الحمض النووي الجينومي الكبيرة إلى شظايا أصغر. يمكن أن يؤدي التفتيت الميكانيكي إلى فقدان عينة مرتفع نسبيًا وينطوي على عملية تشغيلية أكثر تعقيدًا. من ناحية أخرى، يعد الهضم الأنزيمي طريقة شائعة الاستخدام لتفتيت الحمض النووي الجينومي. وبالمقارنة بالطرق الميكانيكية، فإن الهضم الأنزيمي أكثر فعالية من حيث التكلفة ومباشرة، حيث يتطلب التفاعل فترة محددة فقط بعد إضافة إنزيم التفتيت.
في الوقت الحاضر، هناك نوعان أساسيان من القطع قيد الاستخدام. يعتمد النوع الأول على ترانسبوزاز Tn5، استنادًا إلى مبادئ الترانسبوزون، بينما يستخدم النوع الثاني مزيجًا من نوكليازات النهاية. ومع ذلك، يمكن التأثير على فعالية هذه القطع من خلال محتوى GC وتفضيلات القاعدة للحمض النووي. وعلى النقيض من ذلك، تقدم القطع التي طورها Yeasen (رقم القطعة 12917) تأثير هضم مستقر وتظهر تفضيلًا أقل بكثير للموقع مقارنة بترانسبوزاز Tn5. وهي تقدم باستمرار نتائج تسلسل ممتازة لأنواع مختلفة من عينات الحمض النووي، بما في ذلك تلك المأخوذة من عينات FFPE.
1.2 إصلاح النهاية، dA-Tailing
سيولد الحمض النووي المجزأ أطرافًا لزجة بطول 5'/3' وحمض نووي ذو طرف غير حاد، ويجب تحويل جميع الأطراف اللزجة إلى أطراف غير حادة، بما في ذلك إزالة النتوءات بطول 3' وملء أطراف الحمض النووي البارزة بطول 5'. عند استخدام ربط TA لربط المحول، يجب أيضًا فسفرة جزء الحمض النووي عند الطرف 5' وإضافة "A" عند الطرف 3' ليكون مكملًا للمحول بالطرف اللاصق "T".يتم إكمال العملية المذكورة أعلاه من خلال تعاون بوليميراز الحمض النووي T4، وكيناز بولينيوكليوتيد T4، و طق بوليميراز الحمض النووي.
بوليميراز الحمض النووي T4 (رقم القطعة 12901) يتمتع بنشاط بوليميراز الحمض النووي 5'→3'، والذي يمكنه تحفيز تخليق الحمض النووي على طول اتجاه 5'→3' وملء الطرف البارز 5'. وفي الوقت نفسه، يتمتع الإنزيم أيضًا بنشاط إكسونوكلياز 3'→5' لشق الأطراف المتدلية 3'، وبالتالي تحويل شظايا الحمض النووي التي تحتوي على أطراف لزجة إلى حمض نووي ذو طرف غير حاد.
نظرًا لأن نهايات 5' من البادئات والمحولات الخاصة بتفاعل البوليميراز المتسلسل الاصطناعي تكون عادةً عبارة عن مجموعات هيدروكسيل بدلاً من مجموعات الفوسفات. لذلك، يلزم وجود بولينوكليوتيد كيناز T4 (رقم القطعة 12902) لتحفيز نقل مجموعات فوسفات ATP γ إلى نهاية 5' -هيدروكسيل من سلسلة الأوليجونوكليوتيد في وجود ATP، استعدادًا للخطوة التالية من ربط المحول.
س-طق بوليميراز الحمض النووي (رقم القطعة 13486) لديه نشاط بوليميراز 5'→3'، والذي يمكنه تخليق الحمض النووي من اتجاه 5'→3'. وفي الوقت نفسه، لديه نشاط ديوكسينوكليوتيديل ترانسفيراز، والذي يمكنه إضافة نوكليوتيد "A" إلى الطرف 3' من ناتج تفاعل البوليميراز المتسلسل.

الشكل 3. هناك العديد من الإنزيمات المشاركة في عملية الإصلاح النهائية
الشكل 4. يتمتع S-taq بكفاءة عالية جدًا في إضافة A إلى القواعد الأربع لـ ATCG للطرف 3' من أجزاء الجينات التي تم اكتشافها بواسطة الرحلان الكهربائي الشعري.
1.3 ربط المحول
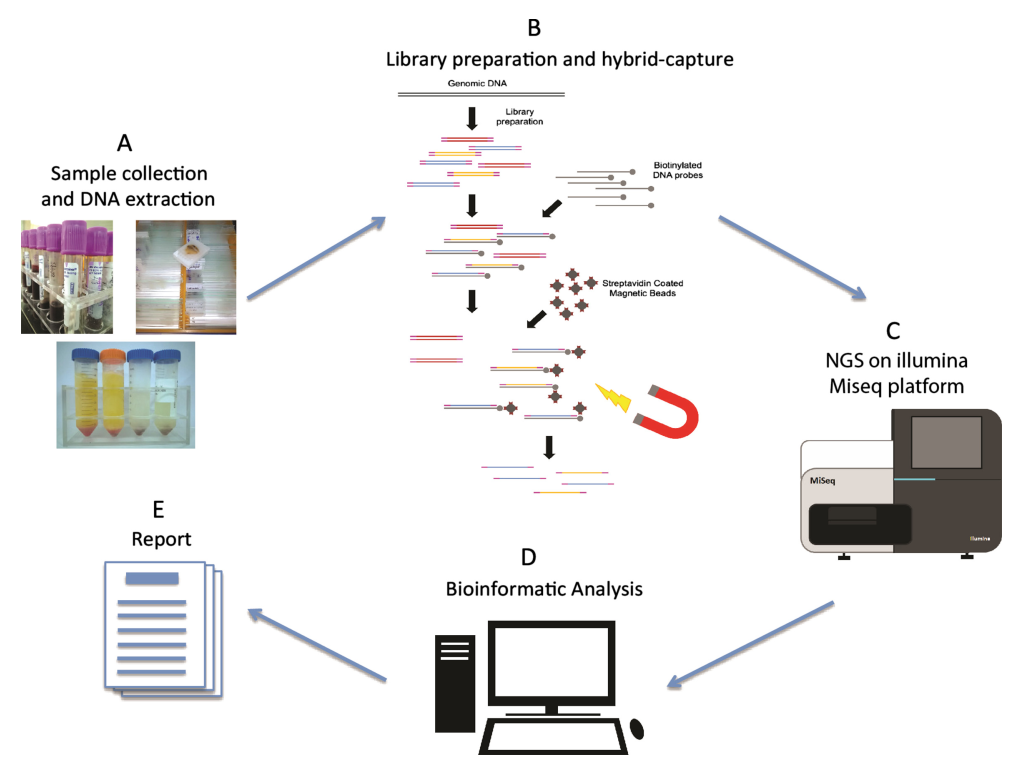
تشكل المحولات مكونًا أساسيًا للمكتبة. في نطاق تسلسل Illumina، تشتمل المحولات من النوع Y المستخدمة بشكل شائع على تسلسلات P5/P7 وIndex وRd1/Rd2 SP. ومن بين هذه السلاسل، يخدم تسلسل P5/P7 الغرض من الاقتران بالتسلسل الموجود على شريحة التسلسل، وبالتالي تثبيت الأجزاء المراد تحليلها على خلية التدفق لتنفيذ تضخيم الجسر. يتم استخدام تسلسل Index للتمييز بين العينات المختلفة داخل المكتبة المختلطة الخاضعة للتسلسل، بينما تشير Rd1/Rd2 SP إلى المناطق لربط بادئات التسلسل Read1 وRead2.
بالنسبة لمهمة ربط المحول، رباط الحمض النووي T4 (رقم القطعة 12996) هو الخيار القياسي. فهو يظهر القدرة على إصلاح الشقوق أحادية السلسلة الموجودة في الحمض النووي ثنائي السلسلة وإعادة ربط النوكليوتيدات المجاورة.
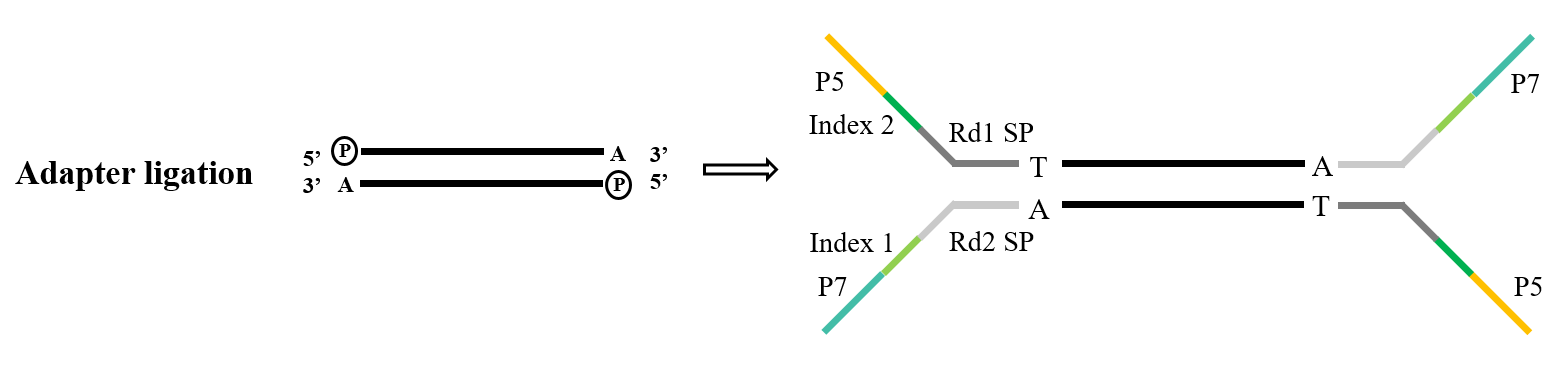
الشكل 5. عملية ربط المحول العام (Illumina)

الشكل 6. التحقق من طفرات ربط الحمض النووي T4 عن طريق ربط الحمض النووي بطول 170 زوجًا قاعديًا بمحولات بطول 80 زوجًا قاعديًا.
1.4 تضخيم تفاعل البوليميراز المتسلسل
الحصول على عدد كافٍ من تسلسلات الحمض النووي باستخدام المحولات من خلال تفاعل البوليميراز المتسلسل، وإكمال تسلسل تسلسل الحمض النووي للعينة على الجهاز. هيف كاناسالعلامة التجارية إن بوليميراز الحمض النووي عالي الدقة (رقم القطعة 13476) المستخدم بشكل شائع في تفاعل البوليميراز المتسلسل له نشاط بوليميراز 5'→3' ويمكنه تخليق الحمض النووي في اتجاه 5'→3'. بالإضافة إلى ذلك، فإنه يتمتع أيضًا بنشاط إكسونوكلياز 3'→5'، والذي يمكنه تصحيح التضمين الخاطئ للقواعد أثناء عملية التضخيم، لتضخيم شظايا الحمض النووي بسرعة وبدقة عالية.
2. بناء مكتبة الحمض النووي الريبي وأنزيماتها الرئيسية
وفقًا لأنواع الحمض النووي الريبي، يمكن تقسيم بناء مكتبة الحمض النووي الريبي إلى مكتبة mRNA، ومكتبة LncRNA، وما إلى ذلك. تتضمن مكتبة الحمض النووي الريبي التقليدية العمليات التالية:
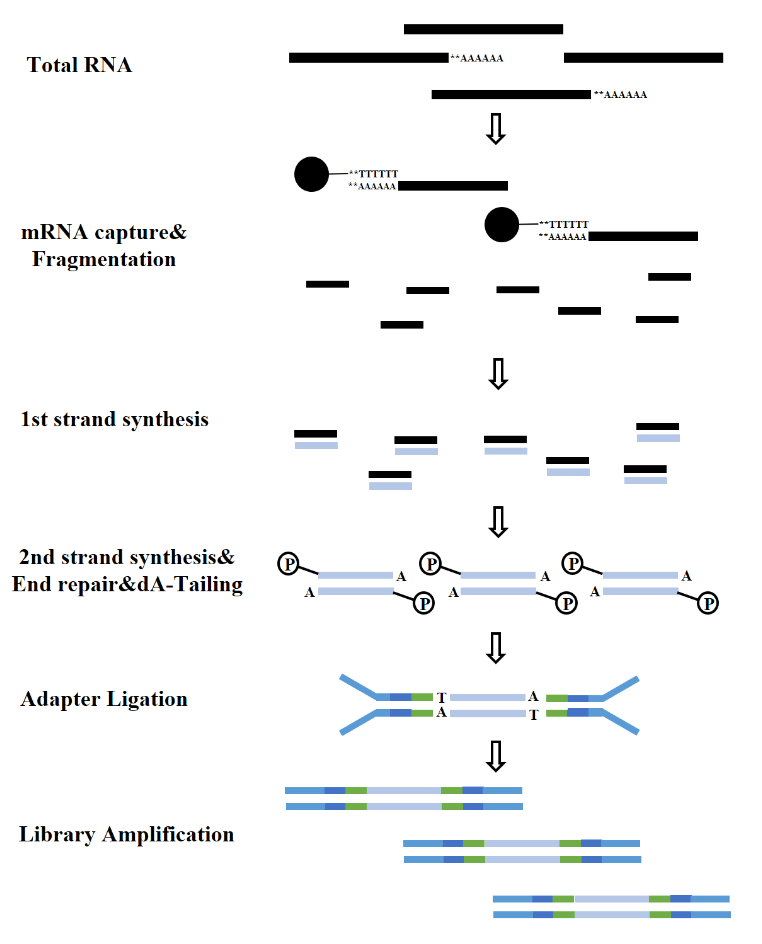
الشكل 7. عملية بناء مكتبة mRNA (Illumina)
2.1 إثراء الحمض النووي الريبوزي
سواء كان التعامل مع حقيقيات النوى أو بدائيات النوى، فإن الحمض النووي الريبوزي الريبوسومي (rRNA) يبرز باعتباره الحمض النووي الريبوزي الأكثر وفرة، حيث يشكل ما يصل إلى 80% من إجمالي محتوى الحمض النووي الريبوزي. عند تسلسل الحمض النووي الريبوزي الكلي لعينة ما بشكل مباشر، فإن جزءًا كبيرًا من بيانات التسلسل سيكون مرتبطًا بالحمض النووي الريبوزي الريبوزي. للتخفيف من هذا التداخل، يجب استخدام طريقة إثراء الحمض النووي الريبوزي. هناك طريقتان أساسيتان لذلك: إثراء الحمض النووي الريبوزي المرسال على أساس طرق oligo-dT واستنزاف الحمض النووي الريبوزي الريبوزي.
في حقيقيات النوى، يظهر mRNA بنية بولي (A) مميزة عند الطرف 3'. يمكن استخدام حبيبات Oligo-dT لالتقاط جميع mRNA المنقول من العينة، مما يجعلها مناسبة للتحليل النسخي، وخاصة مع عينات RNA عالية الجودة. من ناحية أخرى، تتمتع طرق استنزاف rRNA بمتطلبات أكثر تساهلاً فيما يتعلق بجودة العينة ويمكن تطبيقها على كل من العينات منخفضة الجودة (على سبيل المثال، عينات FFPE) وعينات RNA عالية الجودة، وكذلك العينات البدائية. يتضمن النهج التجاري المستخدم بشكل شائع استخدام هضم RNase H لإزالة rRNA، باتباع الخطوات المحددة التالية:
- تصنيع مجسات أوليجونوكليوتيد محددة مصممة للارتباط بـ rRNA.
- استخدم RNase H (Cat#12906)، والذي لديه القدرة على تحلل RNA في الشريط الهجين RNA-DNA، لإزالة rRNA المرتبط بالمجسات بشكل انتقائي.
- أخيرًا، هضم مجسات الحمض النووي باستخدام DNase I (رقم الفهرس 10325)، والتي يمكنها تحلل الحمض النووي أحادي السلسلة والحمض النووي ثنائي السلسلة، مما يؤدي إلى القضاء على الحمض النووي الريبوزي الريبوسومي بشكل فعال. لمزيد من المعلومات حول DNase I، يمكنك متابعة هذا الرابط.
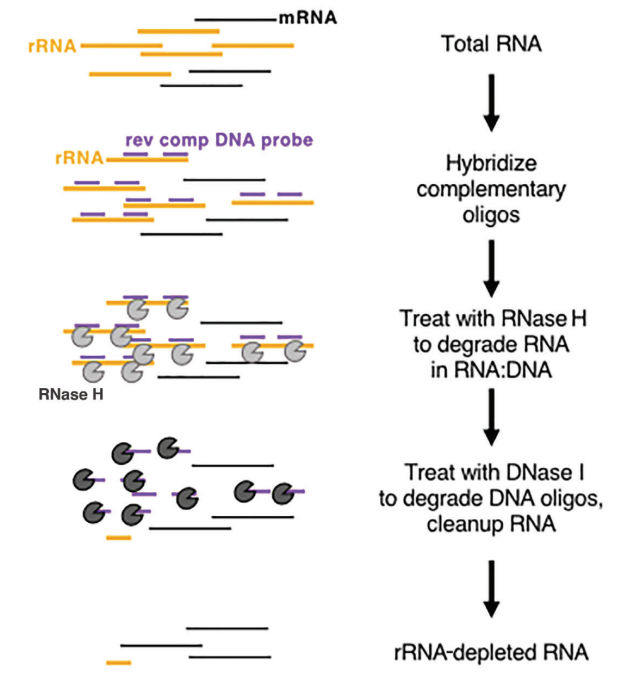
الشكل 8: مخطط تخطيطي لاستنزاف الرنا الريبوسومي القائم على الإنزيم[5]
2.2 تجزئة الحمض النووي الريبوزي
عادة، تحت تأثير الكاتيونات المعدنية ثنائية التكافؤ ودرجة الحرارة المرتفعة، يتم تكسير أجزاء كبيرة من الحمض النووي الريبي إلى أجزاء صغيرة.
2.3 تخليق السلسلة الأولى من cDNA
النسخ العكسي للحمض النووي الريبي المستهدف الناتج إلى السلسلة الأولى من الحمض النووي الريبي التكميلي. نظرًا لأن الحمض النووي الريبي يتحلل بسهولة بواسطة RNases الموجودة في البيئة، فإن استخدام مثبط RNase (رقم القطعة 14672) أثناء النسخ العكسي، يمكن أن يثبط نشاط هذه الإنزيمات ويحمي الحمض النووي الريبي من تحلل RNase. وفي الوقت نفسه، النسخ العكسي (رقم الفهرس 11112) تم استخدامه لنسخ الحمض النووي الريبي القالب إلى الحمض النووي الريبي التكميلي. إن إنزيم النسخ العكسي له نشاط بوليميراز الحمض النووي المعتمد على الحمض النووي الريبي ويمكنه استخدام الحمض النووي الريبي كقالب لتوليف الحمض النووي الريبي التكميلي في الاتجاه 5'→3'. إن الشريط المفرد من الحمض النووي الريبي مكمل لقالب الحمض النووي الريبي.
خلال الأول في تخليق سلسلة cDNA، أدى دمج الأكتينوميسين د إلى تحسين بناء المكتبات الخاصة بالسلسلة بشكل لا يمكن إنكاره، مما أدى إلى تحسين خصوصية السلسلة بشكل كبير. وقد أدى هذا الابتكار إلى تبسيط العملية التجريبية وتبسيطها للباحثين.
ومع ذلك، فإن الأكتينوميسين د له عيوبه: فهو يظهر سمية ويتطلب الحماية من الضوء. وفي ظل المشهد الحالي الذي يشهد زيادة في الطلب على مجموعات بناء المكتبات الجاهزة والألواح، فإن ضرورة الحماية من الضوء تفرض قيودًا على تطورات مجموعات الألواح.
لحسن الحظ، قدمت منصة Yeasen ZymeEditor طفرة إنزيمية رائدة في MMLV (Inquiry) تحل محل وظيفة الأكتينوميسين D. تم تطوير المجموعة (الفئة: 12340ES) بحيث تكون عديمة الرائحة وغير سامة وغير ضارة.أوه بحاجة إلى تجنب الضوء. فهو يوفر خصوصية فائقة للسلسلة، مما يزيل المخاوف المتعلقة بالصحة وحساسية الضوء.

الشكل 9: هندسة MMLV لتحديد طفرات MMLV التي يمكن أن تساهم في Standed RNA-seq
2.4 تخليق سلسلة الحمض النووي التكميلي الثانية
إن الحمض النووي التكميلي أحادي السلسلة الناتج عن النسخ العكسي غير مستقر للغاية، مما يستلزم التخليق الفوري للسلسلة الثانية من الحمض النووي التكميلي تحت تأثير بوليميراز الحمض النووي I. وخلال تخليق السلسلة الثانية، يأتي دور RNase H عن طريق إزالة سلسلة الحمض النووي الريبي من بنية الحمض النووي الريبي الهجينة. وهو يعمل بالتنسيق مع بوليميراز الحمض النووي رقم 1 (رقم الفهرس 12903) لتسهيل التركيب التحفيزي للسلسلة الثانية التكميلية من الحمض النووي الريبوزي منقوص الأكسجين. يمتلك بوليميراز الحمض النووي I نشاط بوليميراز الحمض النووي 5'→3'، وبتوجيه من قالب وبادئ، يقوم بتركيب تسلسل يكمل الحمض النووي الريبوزي منقوص الأكسجين أحادي السلسلة في اتجاه 5'→3'.
تتضمن الخطوات اللاحقة في العملية إصلاح النهاية، وربط dA، وربط المحول، وتضخيم تفاعل البوليميراز المتسلسل، وكلها مفصلة في إجراء بناء مكتبة الحمض النووي ولا داعي لتكرارها هنا. تجدر الإشارة إلى أنه بمجرد اكتمال النسخ العكسي، لا توجد حاجة لمزيد من تفتيت شظية الحمض النووي.
3. إرشادات حول إنزيمات NGS الأساسية في بناء مكتبة DNA وRNA
شركة Yeasen هي شركة للتكنولوجيا الحيوية تعمل في مجال البحث والتطوير والإنتاج وبيع ثلاثة كواشف بيولوجية رئيسية: الجزيئات والبروتينات والخلايا. تنتج شركة Yeasen Biotech مجموعة متنوعة من الإنزيمات المتعلقة ببناء مكتبة NGS. يمكنك اختيار منتج بناء المكتبة الأكثر ملاءمة من الرسم البياني أدناه.
الجدول 1.دليل استخدام إنزيمات الجيل التالي من التسلسل في بناء مكتبة الحمض النووي والحمض النووي الريبي
| يكتب | تحديد موقع المنتج | اسم المنتج | قطة# |
| مكتبة الحمض النووي الريبوزي بناء | الرنا الريبوسومي استنزاف/تخليق سلسلة الحمض النووي التكميلي الثانية | 12906ES | |
| الرنا الريبوسومي استنزاف | 10325ES | ||
| تخليق السلسلة الأولى من cDNA | 14672ES | ||
| 11112ES | |||
| تخليق سلسلة ثانية من cDNA | 12903ES | ||
| مكتبة الحمض النووي الريبوزي بناء & الحمض النووي مكتبة بناء | إصلاح النهاية | 12901ES | |
| 12902ES | |||
| dA-الذيل | 13486ES | ||
| ربط المحول | 10301ES | ||
| تفاعل البوليميراز المتسلسل تضخيم | 12621ES |
الجدول 2.مكتبة DNA وRNA مجموعة التحضير
| اسم | قطة# | ملحوظات | |
| الحمض النووي | مجموعة أدوات تحضير مكتبة Hieff NGS DNA | 13577ES | طريقة الورم/الميكانيكا |
| مجموعة أدوات تحضير مكتبة الحمض النووي Hieff NGS OnePot Pro الإصدار 2 | 12194ES | طريقة الورم/الإنزيم | |
| هيف NGS OnePot مجموعة أدوات تحضير مكتبة الحمض النووي II لـ Illumina | 13490ES | الممرض/ الإنزيمي/ الوقت العادي (140 دقيقة) | |
| مجموعة أدوات تحضير مكتبة Hieff NGS OnePot Flash DNA | 12316ES | مسببات الأمراض/ الإنزيمية/ فائقة السرعة (100 دقيقة) | |
| مجموعة الإعداد المشترك لمكتبة Hieff NGS DNA&RNA V2 | 12305ES | تحضير مشترك للمسببات المرضية/الإنزيمات/الحمض النووي الريبوزي DNA والحمض النووي الريبوزي RNA | |
| الحمض النووي الريبوزي | مجموعة أدوات تحضير مكتبة mRNA ثنائية الوضع Hieff NGS Ultima | 12308ES | بدون خرزات مغناطيسية من نوع oligo dT، 11 أنبوبًا |
| مجموعة أدوات تحضير مكتبة mRNA ثنائية الوضع Hieff NGS Ultima | 12309ES | خرزات مغناطيسية من نوع oligo dT plus، 14 أنبوبًا | |
| مجموعة تحضير مكتبة RNA ثنائية الوضع Hieff NGS® Ultima | 12310ES | نسخة ممزوجة مسبقًا، 5 أنابيب | |
| مجموعة تحضير مكتبة Hieff NGS ® EvoMax RNA (الإصدار المختلط مسبقًا) (أكتينوميسين د) حر) | 12340ES | النسخة المختلطة مسبقًا (أكتينوميسين د حر) | |
| مجموعة استنفاد rRNA من Hieff NGS® MaxUp (نبات) | 12254ES | نبات | |
| مجموعة Hieff NGS® MaxUp Human rRNA Depletion Kit (rRNA & ITS/ETS) | 12257ES | بشر |
مراجع:
[1] مارديس، إلين ر. منصات التسلسل للجيل القادم[J]. المراجعة السنوية للكيمياء التحليلية، 2013، 6(1):287-303.
[2] Gulilat M، Lamb T، Teft WA، وآخرون. تسلسل الجيل التالي المستهدف كأداة للطب الدقيق[J]. BMC Medical Genomics، 2019، 12(1):81.
[3] Lundberg KS, Dan DS, Adams M, et al. High-fidelity amplification using the thermostable DNA polymerase isolation from Pyrococcus furiosus[J]. Gene, 1991, 108(1):1-6.
[4] Miyazaki K. تجزئة الحمض النووي العشوائية باستخدام نوكلياز داخلي V: التطبيق على خلط الحمض النووي [J]. Nucleic Acids Research، 2002، 30(24):e139.
[5] Baldwin A، Morris AR، Mukherjee N. طريقة سهلة وفعالة من حيث التكلفة وقابلة للتطوير لاستنزاف الحمض النووي الريبوزي الريبوسومي البشري لـ RNA-seq[J]. البروتوكولات الحالية، 2021، 1(6):e176.

