Dank der In-vivo-Bildgebungstechnologie können sich „verdeckte“ Zellen nirgendwo mehr verstecken
Möchten Sie das Tumorwachstum bei Nacktmäusen in Echtzeit kontrollieren? Möchten Sie wissen, wo sich die Zellen bei Mäusen ansiedeln? Möchten Sie wissen, welche Auswirkungen eine medikamentöse Behandlung auf Tumore hat? in vivo? Dies kann durch die Installation eines Trackers auf der Zelle erreicht werden, sodass Sie den Standort und die Anzahl der Zellen jederzeit kontrollieren können. Bei dieser Technologie handelt es sich um eine In-vivo-Bildgebungs-„Erkennungs“-Technologie. Was also ist In-vivo-Bildgebungstechnologie?
1. Was ist In-vivo-Bildgebungstechnologie?
2. Eigenschaften der Luciferase-Bildgebung
3. Anwendungsrichtung der Luciferase-Bildgebung
4. Experimentelles Beispiel-Sharing
5. Häufig gestellte Fragen
6. Produktinformationen
7. Zum Thema Lesen
1. Was ist In-vivo-Bildgebungstechnologie?
Bereits 1999 schlug Dr. Weissleder von der Harvard University in den USA das Konzept der molekularen Bildgebung vor, d. h. die Verwendung von Bildgebungsverfahren zur qualitativen und quantitativen Erforschung biologischer Prozesse in vivo auf zellulärer und molekularer Ebene. Die In-vivo-Bildgebung basiert auf der molekularen Bildgebung. Durch dieses Bildgebungssystem können biologische Prozesse wie Tumorwachstum und Metastasierung, die Entwicklung von Infektionskrankheiten und die Expression bestimmter Gene bei lebenden Tieren beobachtet werden.
In vivo werden bei der optischen Bildgebung lebender Tiere hauptsächlich zwei Technologien eingesetzt: Biolumineszenz und Fluoreszenz. Bei der Biolumineszenz werden Zellen oder DNA mit dem Luciferase-Gen markiert, während bei der Fluoreszenztechnologie fluoreszierende Reportergene wie grün fluoreszierendes Protein und rot fluoreszierendes Protein sowie Fluoreszenzelemente wie FITC, Cy5 und Cy7 sowie Quantenpunkte (QD) zur Markierung verwendet werden. Bei der Biolumineszenz bei Säugetieren wird im Allgemeinen das Glühwürmchen-Luciferase-Gen (bestehend aus 554 Nukleotiden, etwa 50 kD), also das Luciferase-Gen, in die chromosomale DNA der erwarteten Beobachtungszelle integriert, um Luciferase zu exprimieren. Dann wird eine Zelllinie kultiviert, die Luciferase stabil exprimieren kann, und wenn sich die Zellen teilen, differenzieren und übertragen, wird die Luciferase auch weiterhin stabil exprimiert. Gene, Zellen und lebende Tiere können alle mit dem Luciferase-Gen markiert werden. Luciferase ist eine Art Enzym, das Substrate katalysieren kann, um Biolumineszenz zu erzeugen. Luciferasen aus verschiedenen Quellen haben ihre eigenen Eigenschaften und können Substrate katalysieren, um verschiedene Farben von Licht zu emittieren. Unter ihnen hat die Glühwürmchen-Luciferase eine hohe Empfindlichkeit und einen breiten linearen Bereich von 7 bis 8 Größenordnungen. Es ist das am häufigsten verwendete Reportergen für Säugetierzellen geworden. Das Luciferase-Reporterplasmid wurde in die Zellen übertragen und sein Substrat Luciferin wurde hinzugefügt, um die Zellen zu inkubieren. In Gegenwart von ATP, O2, und Magnesiumionen, Luciferase könnte das Luciferinsubstrat oxidieren, um eine sichtbare Lichtreaktion hervorzurufen. Realisieren Sie „eine einmalige ‚Tracker‘-Installation und verfolgen und erkennen Sie jederzeit“. Neben Glühwürmchen-Luciferase wird manchmal auch Renilla-Luciferase verwendet. Die Substrate der beiden sind unterschiedlich, das Substrat der ersteren ist D-Luciferin und das Substrat der letzteren ist Coelenterazin. Die Wellenlängen der Lichtemission der beiden sind unterschiedlich, der Bereich der von ersterer emittierten Lichtwellenlänge beträgt 540–600 nm und der Bereich der von letzterer emittierten Lichtwellenlänge beträgt 460–540 nm. Das von ersterer emittierte Licht kann leichter durch Gewebe dringen, während letztere im Körper schneller verstoffwechselt wird und ihre Spezifität nicht so gut ist wie die der ersteren. Daher verwenden die meisten In-vivo-Experimente Glühwürmchen-Luciferase nicht als Reportergen.
Abbildung 1.Lokalisierung von Luciferase-markierten Zellen
Das optische Prinzip der Biolumineszenz: Licht wird bei der Ausbreitung in Säugetiergeweben gestreut und absorbiert, und Photonen werden gebrochen, wenn sie auf Zellmembranen und Zytoplasma treffen, und verschiedene Arten von Zellen und Geweben haben unterschiedliche Eigenschaften bei der Absorption von Photonen. Hämoglobin ist die Hauptursache für die Absorption von sichtbarem Licht im Körper und kann den größten Teil des blaugrünen Bandes des sichtbaren Lichts absorbieren. Im roten Lichtband des sichtbaren Lichts über 600 nm ist die Absorption von Hämoglobin jedoch sehr gering. Daher kann eine große Menge Licht durch Gewebe und Haut dringen und im rötlichen Bereich erkannt werden. Mithilfe der Biolumineszenz-Bildgebungstechnologie bei lebenden Tieren können mindestens einige hundert subkutane Zellen erkannt werden. Abhängig von der Tiefe der Lichtquelle in der Maus variiert jedoch die Mindestanzahl der sichtbaren Zellen. Im Allgemeinen verringert sich die Lichtintensität bei jeder Vergrößerung um 1 cm um das Zehnfache. Bei blutreichen Geweben und Organen ist die Abschwächung größer und bei an Knochen angrenzenden Geweben und Organen geringer. Bei gleicher Tiefe weist die erfasste Lichtintensität eine signifikante lineare Beziehung zur Anzahl der Zellen auf. Die erfasste Lichtintensität kann vom Instrument quantifiziert werden und spiegelt die Anzahl der Zellen wider.
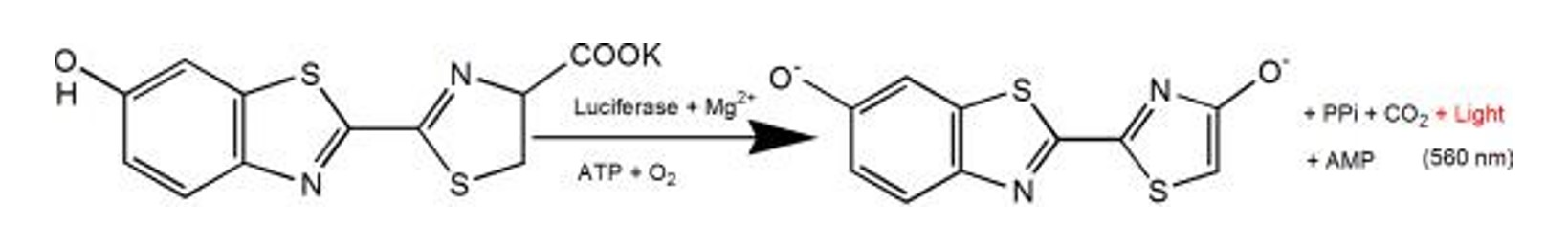
Abbildung 2. Das Lumineszenzprinzip der Luciferase- und Luciferin-Kaliumsalz-Reaktion
Anders als bei der Biolumineszenz werden bei der Fluoreszenztechnologie fluoreszierende Reportergene oder fluoreszierende Farbstoffe (einschließlich neuer Nanomarkierungsmaterialien wie fluoreszierende Quantenpunkte) zur Markierung verwendet. Mithilfe der Fluoreszenz von Reportergenen, fluoreszierenden Proteinen oder Farbstoffen kann eine biologische Lichtquelle in vivo erzeugt werden. Biolumineszenz ist Autofluoreszenz bei Tieren ohne Anregungslichtquelle, während Fluoreszenz eine Anregung durch eine externe Anregungslichtquelle erfordert, bevor sie vom Bildgebungssystem erkannt werden kann. Fluoreszenzmarkierungen werden häufig verwendet, unter anderem bei Tieren, Zellen, Mikroorganismen, Antikörpern, Arzneimitteln, Nanomaterialien usw.
2. Eigenschaften der Luciferase-Bildgebung
◎ keine Strahlung, nahezu unschädlich für Organismen.
◎ Biolumineszenz ohne Anregungslichtquelle.
◎ Hohe Empfindlichkeit, Hunderte von Zellen können erkannt werden.
◎ gute Durchdringbarkeit, 3-4cm Gewebetiefe noch erkennbar.
◎ Hohes Signal-Rausch-Verhältnis, starkes Fluoreszenzsignal und gute Entstörungsfähigkeit.
3. Anwendungsrichtung der Luciferase-Bildgebung
3.1 Tumorwachstum
Im Tumorentstehungsexperiment an Nacktmäusen wurde das Tumorwachstum in Echtzeit ohne Invasion beobachtet und es war nicht erforderlich, den Tumor zur Messung abzustreifen.
3.2 Onkologische Medikamente
Der Einfluss der Verabreichung auf das Tumorwachstum oder die Metastasierung wurde erkannt und das Fluoresceinsubstrat konnte innerhalb von 3 Stunden eliminiert werden, ohne den Arzneimittelversuch zu beeinträchtigen.
3.3 Zelllokalisierung
Die Lokalisierung und Verteilung fremder Zellen im Tier wurde nachgewiesen.
3.4 Regulierung der Genexpression
Das Zielgen oder der Promotor des Zielgens wurde mit dem Luciferase-Gen fusioniert, um Veränderungen der Genexpression während der medikamentösen Behandlung oder im Krankheitsverlauf zu erkennen.
3.5 Stammzellenforschung
Überwachung der Transplantation, des Überlebens und der Proliferation von Stammzellen; Verfolgung der Verteilung und Migration von Stammzellen in vivo.
4. Experiment Beispiel Teilen

Abbildung 3. in vivo Bildgebungsnachweis des therapeutischen Effekts von CAR-MUC1 T/CAR-MUC1-IL22 T-Zellen auf die Tumorbildung durch subkutane Injektion von HN4-Zellen in Mäuse[1].
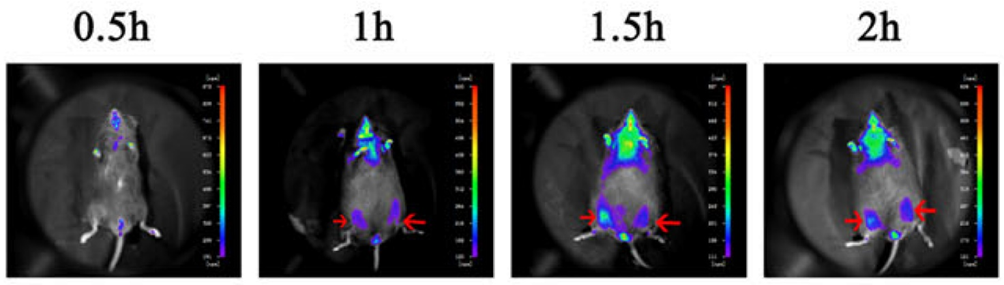
Abbildung 4. Nach der Injektion von HUC-MSC-Zellen in den Skelettmuskel von Mäusen wurde die Lokalisierung der Zellen durch in vivo Bildgebung (mit rotem Pfeil markiert)[2].
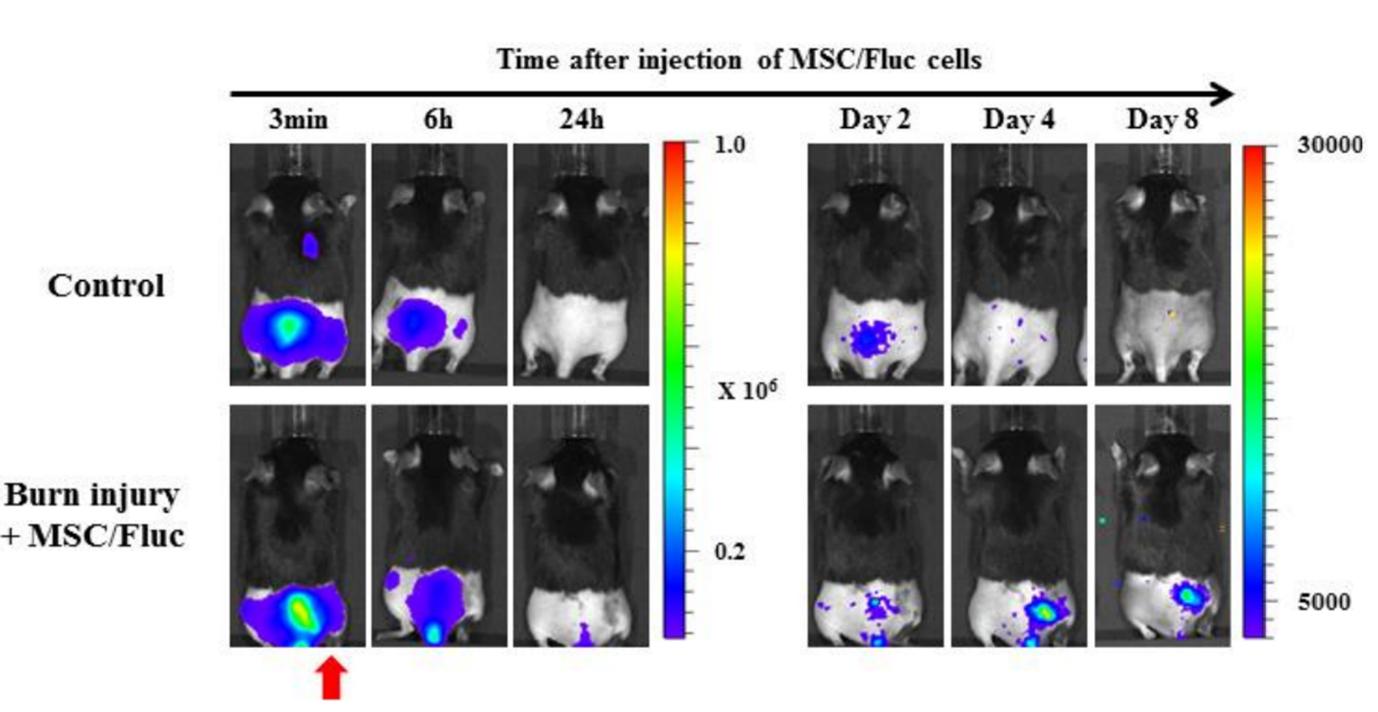
Abbildung 5. Die Fähigkeit von in vivo Bildgebung zur Erkennung der Migration mesenchymaler Stammzellen (MSC) zu Brandwunden. Mesenchymale Stammzellen (MSC/FLuc) wurden intravenös in das Mausmodell für Rückenbrandwunden injiziert. Vier Tage nach der Injektion traten an der verletzten Stelle der Brandwunde Biolumineszenzsignale auf, die dann allmählich abnahmen (der rote Pfeil zeigt die Brandwunde an).[3].
5. Häufig gestellte Fragen
F1: Welche Vorteile bietet die Biolumineszenz-Bildgebungstechnologie im Vergleich zur herkömmlichen Technologie?
Im Vergleich zur herkömmlichen Technologie ist diese Technologie bei der Erforschung von Tumormetastasen, Gentherapie, Epidemiologie, Stammzellenverfolgung, Leukämie und anderen verwandten Forschungsgebieten sensibler als die herkömmlichen Methoden. Sie kann auch die Pathogenese und Arzneimittelprüfung verwandter Krankheiten anhand einer Reihe transgener Tierkrankheitsmodelle schnell und intuitiv untersuchen.
F2: Wie markiert man Stammzellen mit dem Luciferase-Gen?
Die konstitutiv exprimierten Gene können markiert werden, um transgene Mäuse herzustellen, und die Stammzellen werden markiert. Die hämatopoetischen Stammzellen werden aus dem Knochenmark der Maus entnommen und in das Knochenmark einer anderen Maus transplantiert. Mit dieser Technologie kann die Proliferation, Differenzierung und Migration hämatopoetischer Stammzellen im Körper verfolgt werden. Eine andere Methode besteht darin, Stammzellen mit Lentiviren zu markieren.
F3: Wie lange ist eine Testdauer nach der Fluoreszein-Injektion angemessen und wie lange kann die Lumineszenz anhalten?
Im Allgemeinen erreicht das Fluoreszenzsignal nach intraperitonealer Injektion für 10-15 Minuten die stärkste stabile Periode und beginnt nach 20-30 Minuten abzuklingen. Nach 3 Stunden ist das Fluorescein eliminiert und die Lumineszenz verschwindet vollständig.
F4: Wie injiziert man Mäusen Fluorescein? Was ist der Unterschied zwischen den Injektionsmethoden?
Fluorescein kann Mäusen durch intraperitoneale Injektion oder Schwanzveneninjektion injiziert werden. Es kann sich in etwa 1 Minute im gesamten Körper der Mäuse ausbreiten. In den meisten Fällen beträgt die Fluoresceinkonzentration 150 mg/kg. Für 20 g schwere Mäuse können etwa 3 mg Fluorescein verwendet werden. Bei intraperitonealer Injektion ist die Diffusion langsam, die anfängliche Lumineszenz ist langsam und die kontinuierliche Lumineszenzzeit ist lang. Bei der Schwanzveneninjektion von Fluorescein diffundiert es schnell und beginnt schnell zu leuchten, aber die Lumineszenzdauer ist kurz.
6.Produktinformationen
Tabelle 1. Produktinformationen
| Produktinformationen | Produktnummer | Technische Daten |
| D-Luciferin, Natriumsalz | 40901ES01/02/03/08/10 | 0,1/0,5/1/5/10 g |
| D-Luciferin, Kaliumsalz | 40902ES01/02/03/08 | 0,1/0,5/1/5 g |
| D-Luciferin Firefly, freie Säure (Erkundigen) | 40903ES01/02/03 | 0,1/0,5/1 |
| Coelenterazin h (Erkundigen) | 40906ES02/03/08 | 0,5/1/5 mg |
| Gebrauchsfertiges Coelenterazin h (Erkundigen) | 40907ES10 | 10 Fläschchen |
| Dual Luciferase Reporter Gene Assay Kit (Erkundigen) | 11402ES60/80 | 100/1000T |
| Luciferase Reportergen-Assay-Kit (Erkundigen) | 11401ES60/76/80 | 100/500/1000T |
| VDR (Vitamin D-Rezeptor) Luciferase Reporter Plasmid (Erkundigen) | 11502ES03 | 1 μg |
| STAT1 Luciferase Reporterplasmid (Erkundigen) | 11504ES03 | 1 μg |
7. Zum Thema Lesen
Eine neue Generation von Luciferase-Reportergen-Erkennungssystemen – einfacher, empfindlicher, präziser
