Leitfaden zur Produktauswahl für In-vitro-Zelltransfektionsreagenzien
Zelltransfektionsreagenzien sind zu Routinereagenzien für die Untersuchung und Kontrolle der Genfunktion in eukaryotischen Zellen geworden. Transfektionsreagenzien werden häufig in der Genfunktionsforschung, der Regulierung der Genexpression und der Mutationsanalyse sowie in der Gentherapie, Zelltherapie, Proteinproduktion und Impfstoffproduktion verwendet. Was ist also Transfektion? Und wie wählt man basierend auf seinen Experimenten eine Art Transfektionsreagenz aus?
Welche Arten der Transfektion gibt es?
Die Eigenschaften der Transfektionsreagenzien von
Wie wählen Sie auf der Grundlage Ihrer Experimente eine Art Transfektionsreagenz aus?
Anwendungsfall
Referenz für Transfektionsbedingungen
FAQs
Grüße zum Lesen
Welche Arten der Transfektion gibt es?
Je nachdem, ob die Nukleinsäure nach der Transfektion in das Chromosom der Wirtszelle integriert ist, wird sie in „transient“ (vorübergehende Transfektion) und „stabil“ (stabile Transfektion) unterteilt. Die Transfektionseffizienz, Zytotoxizität, Auswirkungen auf die normale Physiologie und die Genexpressionsniveaus verschiedener Transfektionsmethoden sind unterschiedlich. Die Prinzipien, Anwendungen und Eigenschaften werden in der folgenden Tabelle verglichen:
Tabelle 1 Vergleich verschiedener Transfektionsmethoden
| Technologie | Grundsätze | Vorteile | Nachteile |
| Chemische Transfektionsmethode | |||
| Kationische Liposomen | Positiv geladene Liposomen bilden Komplexe mit negativ geladenen Phosphatgruppen von Nukleinsäuren und werden von Zellen endozytiert. |
|
|
| Calciumphosphat-Kopräzipitation | Calciumphosphat-DNA-Komplexe adsorbieren an Zellmembranen und werden von Zellen endozytiert |
|
|
| Dextran | Der durch die Wechselwirkung des positiv geladenen DEAE-Dextrans und des negativ geladenen Phosphatrückgrats der Nukleinsäure gebildete Komplex wird von der Zelle endozytiert. |
|
|
| Andere kationische Polymere | Das positiv geladene Polymer bildet einen positiv geladenen Komplex mit der negativ geladenen Phosphatgruppe der Nukleinsäure. Dann interagiert es mit dem negativ geladenen Proteoglykan auf der Zelloberfläche und gelangt durch Endozytose in die Zelle. |
|
|
| Biotransfektionsmethode | |||
| Virale Transfektion | Instinkt infiziert Zellen und liefert genetisches Material |
|
|
| Physikalische Transfektionsmethode | |||
| Elektrische Übertragung | Die hohe Impulsspannung stört das Zellmembranpotential und die DNA wird durch die in der Membran gebildeten Poren eingeführt. |
|
|
| Biotransmission Partikelabgabe (Partikelbombardierung) | Die DNA wird mit mikroskopischen Schwermetallpartikeln ausgefällt, und dann werden die beschichteten Partikel mit einem ballistischen Gerät in die Zellen geschleudert, wodurch die DNA allmählich freigesetzt und in den Zellen exprimiert wird. |
|
|
| Mikroinjektion | Mittels Mikromanipulation wird DNA direkt in den Zellkern der Zielzelle injiziert. |
|
|
Die Merkmale von Transfektionsreagenzien von Yeasen
Für DNA-Transfektionsreagenzien und RNA-Transfektionsreagenzien verfügt
| Hieff Trans™ Suspension Zellfreies liposomales Transfektionsreagenz | |
| 40802ES | 40805ES |
| 40806ES | 40816ES |
- Hohe Effizienz: Geeignet für die vorübergehende oder stabile Transfektion von Zelllinien.
- Geringe Toxizität: Transfizierte Zellen bleiben gut lebensfähig.
- Breite Anpassungsfähigkeit: umfassende Abdeckung gängiger Zellen und schwer zu transfizierender Primärzellen.
- Einfach zu bedienen: geeignet für Medium in Gegenwart von Serum, ohne Mediumwechsel vor und nach der Transfektion.
- Kostengünstig: wirtschaftlich und praktisch, hohe Transfektionseffizienz, niedriger Preis.
Wie wählen Sie auf der Grundlage Ihrer Experimente eine Art Transfektionsreagenz aus?
Die Auswahl der Transfektionsreagenzien muss entsprechend den unterschiedlichen Versuchszwecken und Versuchsinhalten erfolgen, wie etwa den transfizierten Substanzen, spezifischen Zellen, der Benutzerfreundlichkeit und anderen Faktoren.
| Produkt | Hieff Trans™ Suspension Zellfreies liposomales Transfektionsreagenz | |||
| Zelltyp | konventionelle Zelle | konventionelle Zelle | konventionelle Zelle | konventionelle Zelle |
| / | / | schwer zu transfizierende Zellen | schwer zu transfizierende Zellen | |
| Nukleinsäuretyp | DNA | DNA | / | DNA |
| siRNA | siRNA | siRNA | / | |
| / | / | miRNA | / | |
| / | / | miRNA nachahmen | / | |
| / | / | antimiRNA | / | |
| DNA/siRNA-Kotransfektion | DNA/siRNA-Kotransfektion | / | / | |
| Virenverpackung | Virenverpackung | / | Virenverpackung |
Anwendungsfall
Hieff Trans™ Liposomales Transfektionsreagenz
Hieff Trans™ wird in steriler flüssiger Form geliefert. Im Allgemeinen werden für die Transfektion in 24-Well-Platten jeweils etwa 1,5 μL, 1 ml Hieff Trans™ kann etwa 660 Transfektionen durchführen; für eine 6-Well-Platte, jeweils etwa 6 μL, 1 ml Hieff Trans™ kann etwa 660 Transfektionen durchführen. 160 Transfektionen;
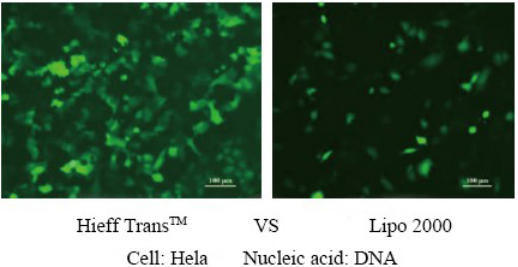
Weitere Einzelheiten finden Sie unter Vertrauen in die Transfektion mit Hieff Trans™ Lipofectamine Reagent
Polyethylenimin linear (PEI) MW40000 (schnelle Lyse)
PEI 40000 ist ein hochgeladenes kationisches Polymer mit einem Molekulargewicht von 40.000, das sehr leicht negativ geladene Nukleinsäuremoleküle bindet, einen Komplex bildet und es dem Komplex ermöglicht, in Zellen einzudringen. PEI 40000 ist ein transientes Transfektionsreagenz mit geringer Zytotoxizität, hoher Transfektionseffizienz und hoher Genexpressioneffizienz in Zellen wie HEK293 und CHO. Lineare PEI-Transfektionsreagenzien wurden für eine breite Palette von Zelllinien validiert, darunter HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, Sf9, HepG2 und Hela-Zellen. Die Transfektionseffizienz beträgt bis zu 80 % bis 90 %.
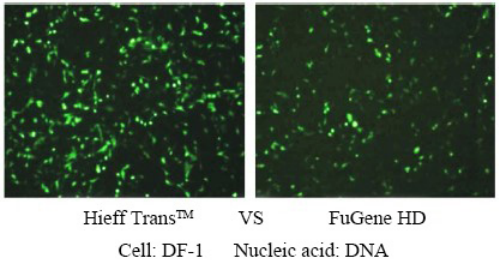
Weitere Einzelheiten finden Sie unter Neuer Favorit für die Transfektion – Linear PEI MW 40000, ein effizienteres Transfektionsreagenz
Hieff Trans™ in vitro siRNA/miRNA-Transfektionsreagenz
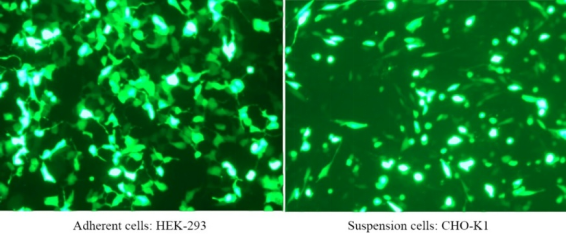
Dieses Produkt kann eine Expressionseffizienz von über 90 % von 1 nM siRNA in einer Vielzahl von Zelllinien erreichen und so unerwünschte Effekte vermeiden. Geeignet für die Transfektion einer Vielzahl von Zellen, einschließlich Hela, MCF-7, HepG2, CHO und anderen adhärenten Zellen; und schwer zu transfizierende Suspensionszelllinien wie K562- oder THP-1-Zellen können eine Silencing-Effizienz von 80 % erreichen; einschließlich einiger Primärzellen, primärer menschlicher Fibroblasten und primärer menschlicher Hepatozyten usw. kann eine Silencing-Effizienz von 80 % erreicht werden.
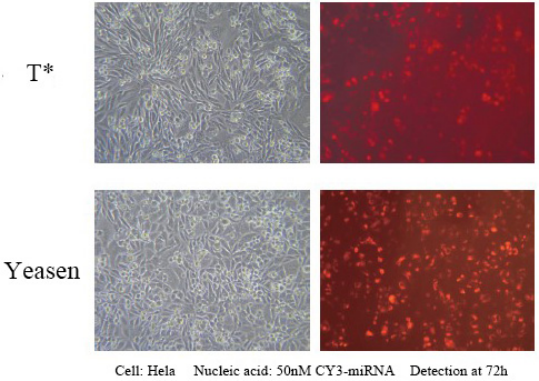
Referenz für Transfektionsbedingungen
Zusätzlich zu den Anweisungen für jedes Produkt gehen Kunden gemäß ihrem spezifischen experimentellen Inhalt vor, und es gibt unterschiedliche Unterschiede in der Nutzungsmenge. Entsprechend den von Kunden nach Verwendung des Produkts gemeldeten In-vitro-Zelltransfektionsbedingungen wurden sie zu Ihrer Information sortiert.
| Produktname/Artikelnummer | |||||
| Zelle | Kulturgefäß | Zellbeschichtungsdichte | DNA | Hieff trans | Transfektionseffizienz |
| A549 | 6 gut | 90 % | 0,7 μg | 1,15 μl | +++ |
| BV 2 | 24 Brunnen | 95 % | 0,2 μg | 0,2 μl | ++ |
| C2C12 | 24 Brunnen | 80 % - 90 % | 1 μg | 5 μl | ++ |
| DF 1 | 24 Brunnen | 80 % - 90 % | 0,5 μg | 0,5 μl | +++ |
| H520 | 6 gut | 80 % | 1.2 μg | 6 μl | ++ |
| HaCaT | 96 Brunnen | 70 % | 100 ng | 1 μl | ++ |
| HCT116 | 6 gut | 90 % | 4 μg | 10 μl | ++ |
| HEK 293 | 6 gut | 95 % | 2 μg | 10 μl | 80 - 90 % |
| HEK 293FT | 24 Brunnen | 85 % | 1 μg | 4 μl | 90 % |
| HEK 293T | 12 Brunnen | 1×105 | 1 μg | 2 μL | +++ |
| HEK 293T (Aufhängung) | 30 ml | 80 % | 30 μg | 60 μl | ++ |
| Hela | 12 Brunnen | 90 % | 0,2 μg | 0,6 μl | 90 % |
| Hela | 12 Brunnen | 80 % | 1 μg | 3 μl | +++ |
| HepG2 | 12 Brunnen | 80 % | 1 μg | 3 μl | ++ |
| HUVEC | 24 Brunnen | 80 % | 1 μg | 2 μL | ++ |
| MCF10A | 10 cm Schale | 60 % | 5 μg | 15 μl | ++ |
| N2A | 24 Brunnen | 70 % - 80 % | 300 ng | 900 μl | + |
| NCI H1975 | 6 gut | 80 % | 4 μg | 10 μl | +++ |
| NIH 3T3 | 6 gut | 90 % | 4 μg | 10 μl | +++ |
| Roh 264.7 | 35 mm Schüssel | 80 % | 1 μg | 2 μL | 90 % |
| Vero | 6 gut | 80 % | 3 μg | 9 μl | +++ |
| Zelle | Kulturgefäß | Zellbeschichtungsdichte | siRNA | Hieff trans | Transfektionseffizienz |
| HK2 | 6 gut | 65 % | 100 pmol | 6 μl | +++ |
FAQs
1 Hieff Trans™ Liposomales Transfektionsreagenz
1.1 F: Kann bei der Herstellung von Nukleinsäure-Transfektionsreagenzkomplexen Serum vorhanden sein?
A: Das Vorhandensein von Serum beeinflusst die Bildung von Liposomen. Es wird empfohlen, bei der Herstellung von Nukleinsäure-Transfektionsreagenzkomplexen ein serumfreies Medium (im Allgemeinen MEM-Medium) zu verwenden.
1.2 F: Worauf muss ich bei der Verwendung des Hieff Trans™ Liposomal Nucleic Acid Transfection Reagent achten?
A:
1) Wenn die Zellen transfiziert werden, beträgt die Zelldichte vorzugsweise 80 %–95 %, und die spezifische Beschichtungsdichte wird entsprechend der Situation der Zellen bestimmt;
2) Die Verwendung hochreiner DNA trägt dazu bei, eine höhere Transfektionseffizienz zu erreichen;
3) DNA und Transfektionsreagenzien müssen bei der Herstellung von Transfektionskomplexen mit dem serumfreien Medium verdünnt werden;
4) Während der Transfektion dürfen dem Medium keine Antibiotika zugesetzt werden.
5) Reagenzien sollten bei 2–8 °C gelagert werden. Dabei ist darauf zu achten, dass der Deckel nicht über einen längeren Zeitraum wiederholt geöffnet wird.
6) Die DNA-Konzentration und die Anzahl der kationischen Liposomenreagenzien sollten für den ersten Einsatz optimiert werden, um eine maximale Transfektionseffizienz zu erzielen. Das Verhältnis von DNA zu Transfektionsreagenz sollte im Allgemeinen 1:2-1:3 betragen.
1.3 F: Muss es nach der Transfektion beendet werden?
A: Nicht nötig. Liposomenkomplexe sind 6 Stunden lang stabil. Wenn das Zellmedium vor der Transfektion nicht gewechselt wird, muss nach 4-6 Stunden auf ein neues Medium gewechselt werden, um die für ein normales Zellwachstum erforderlichen Nährstoffe sicherzustellen. Wenn das Medium jedoch vor der Transfektion gewechselt wurde, ist es nach der Liposomentransfektion nicht notwendig, das Medium zu wechseln.
1.4 F: Kann eine Kotransfektion von DNA und siRNA durchgeführt werden? Wie ist die Wirkung?
A: Ja, wenn DNA und siRNA gemeinsam transfiziert werden, ist die Effizienz der siRNA-Transfektion etwas schlechter.
1.5 F: Kann das Transfektionsreagenz zur Transfektion lentiviraler Verpackungen verwendet werden?
A: Eine lentivirale Verpackung ist möglich.
1.6 F: Können Suspensionszellen mit dem Hieff Trans™ Liposomal Nucleic Acid Transfection Reagent transfiziert werden?
A: Das Hieff Trans™ Liposome Nucleic Acid Transfection Reagent kann für die Transfektion von Suspensionszellen verwendet werden, Einzelheiten finden Sie im Protokoll. Darüber hinaus haben wir auch ein Transfektionsreagenz speziell für Suspensionszellen eingeführt (Kat.-Nr.40805, Hieff Trans™ Suspension, zellfreies liposomales Transfektionsreagenz)
2 Hieff Trans™ in vitro siRNA/miRNA-Transfektionsreagenz
2.1 F: Muss das Transfektionsreagenz nach der Transfektion gewechselt werden?
A: Dieses Problem kann in zwei Fälle unterteilt werden: 1. Wenn vor der Transfektion kein Mediumwechsel stattfindet, sollte das Medium etwa 6 Stunden nach der Transfektion gewechselt werden, um die für das Zellwachstum erforderlichen Nährstoffe sicherzustellen; 2. Wenn vor der Transfektion ein Mediumwechsel stattfindet, kann dann mit den kultivierten Zellen wie gewohnt verfahren werden? ? Nach dem Flüssigkeitswechsel?
2.2 F: Können Transfektionsreagenzien eingefroren werden?
A: Es kann nicht eingefroren werden, da es sich bei dem Transfektionsreagenz um ein kationisches PEI-Transfektionsreagenz handelt. Einfrieren bei niedrigen Temperaturen zerstört die Aktivität des PEI-Transfektionsreagenz. Daher ist es am besten, es bei 2-8 °C zu lagern, um die beste Transfektionswirksamkeit aufrechtzuerhalten.
Produktinformationen
| Produktname | Artikelnummer | Technische Daten |
| Hieff Trans™ Liposomales Transfektionsreagenz | 40802ES02 | 0,5 ml |
| 40802ES03 | 1,0 ml | |
| 40802ES08 | 5×1ml | |
| Hieff Trans™ Suspension Zellfreies liposomales Transfektionsreagenz (Anfrage) | 40805ES02 | 0,5 ml |
| 40805ES03 | 1,0 ml | |
| 40805ES08 | 5×1 ml | |
| Hieff Trans™ in vitro siRNA/miRNA-Transfektionsreagenz (Erkundigen) | 40806ES02 | 0,5 ml |
| 40806ES03 | 1,0 ml | |
| Polyethylenimin linear (PEI) MW40000(schnelle Lyse) | 40816ES02 | 100 mg |
| 40816ES03 | 1 g | |
| 40816ES08 | 5×1 g |
Einige der mit unseren Produkten veröffentlichten Artikel
[1] Liu R, Yang J, et al. Optogenetische Kontrolle der RNA-Funktion und des RNA-Stoffwechsels mithilfe künstlicher lichtschaltbarer RNA-bindender Proteine. Nat Biotechnol. 3. Januar 2022 (IF:55)
[2] Luo J, Yang Q, et al. TFPI ist ein Kolonkryptenrezeptor für TcdB aus dem hypervirulenten Clade 2 C. difficile. Cell. 17. März 2022 (IF:41.582)
[3] Zhou J, Chen P, et al. Cas12a-Varianten, die durch strenge PAM-Erkennung für einen geringeren genomweiten Off-Target-Effekt entwickelt wurden. Mol Ther. 5. Januar 2022 (IF:11.454)
[4] Chen S, Cao X, et al. circVAMP3 treibt die CAPRIN1-Phasentrennung voran und hemmt das hepatozelluläre Karzinom durch Unterdrückung der c-Myc-Translation. Adv Sci (Weinh). 24. Januar 2022 (IF:16.808)
[5] Gu C, Wang Y, et al. AHSA1 ist ein vielversprechendes therapeutisches Ziel für die zelluläre Proliferation und Proteasom-Inhibitor-Resistenz beim multiplen Myelom. J Exp Clin Cancer Res. 2022 Jan 6.(IF:11.161)
[6] Zhang Y, Yu X, et al. Spleißfaktor Arginin/Serin-reich 8 fördert die maligne Erkrankung des multiplen Myeloms und Knochenläsionen durch alternatives Spleißen von CACYBP und Exosomen-basierte zelluläre Kommunikation. Clin Transl Med. 2022 Feb.(IF:11.492)
[7] Qin J, Cai Y, et al. Molekularer Mechanismus des Agonismus und inversen Agonismus im Ghrelinrezeptor. Nat Commun. 13. Januar 2022 (IF:14.9)
[8] Tang X, Deng Z, et al.Ein neues, von circHNRNPU kodiertes Protein fördert das Fortschreiten des multiplen Myeloms durch Regulierung des Knochenmarkmikromilieus und alternatives Spleißen. J Exp Clin Cancer Res. 8. März 2022 (IF:11.161)
[9] Xie F, Su P, et al. Entwicklung extrazellulärer Vesikel, angereichert mit palmitoyliertem ACE2, als COVID-19-Therapie. Adv Mater. 19. Oktober 2021. (IF:30.849)
[10] Liang Y, Lu Q, et al. Reaktivierung des Tumorsuppressors bei Brustkrebs durch Enhancer-Switching über das NamiRNA-Netzwerk. Nucleic Acids Res. 2021 Sep 7.(IF:16.9)
[11] Fan Y, Wang J, et al. CircNR3C2 fördert HRD1-vermittelte tumorsuppressive Wirkung durch Aufsaugen von miR-513a-3p bei dreifach negativem Brustkrebs. Mol Cancer. 2. Februar 2021 (IF:27.403)
[12] Dai L, Dai Y, et al. Strukturelle Einblicke in die Rekrutierung des BRCA1-BARD1-Komplexes zu beschädigtem Chromatin. Mol Cell. 2021 Jul 1.(IF:17.97)
[13] Zhang K, Wang A, et al. Die UBQLN2-HSP70-Achse reduziert Poly-Gly-Ala-Aggregate und lindert Verhaltensstörungen im C9ORF72-Tiermodell. Neuron. 16. Juni 2021 (IF:17.17)
[14] Li T, Chen X, et al. Ein synthetisches BRET-basiertes optogenetisches Gerät für die pulsierende Transgenexpression, das die Glukosehomöostase bei Mäusen ermöglicht. Nat Commun. 2021 Jan 27.(IF:14.92)
[15] Yan F, Huang C, et al. Threonin-ADP-Ribosylierung von Ubiquitin durch eine bakterielle Effektorfamilie blockiert die Ubiquitinierung des Wirts. Mol Cell. 21. Mai 2020 (IF:17.97)
[16] Sun X, Peng X, et al. ADNP fördert die neuronale Differenzierung durch Modulation der Wnt/β-Catenin-Signalgebung. Nat Commun. 12. Juni 2020 (IF:14.911)
[17] Yang X, Wang H, et al. Die Neuverdrahtung der ERBB3- und ERK-Signalgebung verleiht gastrointestinalem Krebs, der eine ERBB3-E928G-Mutation aufwies, Resistenz gegen die Hemmung von FGFR1. Protein Cell. 2020 Dez. (IF:14.872)
[18] Zou Y, Wang A, et al. Analyse von Redoxlandschaften und -dynamiken in lebenden Zellen und in vivo mithilfe genetisch kodierter Fluoreszenzsensoren. Nat Protoc. 2018 Okt.(IF:13.490)
[19] Hao H, Hu S, et al. Der Verlust von endothelialem CXCR7 beeinträchtigt die vaskuläre Homöostase und die kardiale Umgestaltung nach einem Herzinfarkt: Auswirkungen auf die Entdeckung kardiovaskulärer Arzneimittel. Circulation. 28. März 2017 (IF:29.69)
Grüße zum Lesen
Transfektionsreagenz – Hieff Trans™ und PEI
Lineares PEI MW 40000, ein effizienteres Transfektionsreagenz
