Lineares PEI 40000, ein effizienteres Transfektionsreagenz
Im Allgemeinen ist Transfektion der Prozess der künstlichen Einführung von Nukleinsäuren (DNA oder RNA) in eukaryotische Zellen. Transfektionsreagenzien sind, wie der Name schon sagt, eine Reihe von Reagenzien, die an der Transfektion beteiligt sind. Während des Transfektionsprozesses sind wir oft besorgt über die geringe Transfektionseffizienz, den engen Anwendungsbereich, die starke Toxizität, die umständliche Handhabung und den hohen Preis der Transfektionsreagenzien. Gibt es also ein Transfektionsreagenz, das diese Probleme lösen kann? Ja, lineares PEI ist die beste Wahl zur Lösung dieser Probleme.
Hinweis:
1. Welche Arten der Zelltransfektion gibt es?
2. Was ist lineares PEI MW 40000?
3. Wie funktioniert lineares PEI MW 40000?
4. Was sind die Merkmale von PEI MW 40000?
5. Weitere Transfektionsreagenzien von
6. Lesen beachten
1. Welche Arten der Zelltransfektion gibt es?
Bevor wir lineares PEI MW 40000 vorstellen, wollen wir zunächst kurz die Arten der Zelltransfektion verstehen. Die Zelltransfektion ist von großer Bedeutung für die genetische Forschung, die Proteinforschung und die Zytologieforschung. Dabei handelt es sich um den Prozess der künstlichen Einführung von Nukleinsäuren (DNA oder RNA) in Zellen unter Verwendung nicht-viraler Infektionsmittel. Der Hauptzweck der Transfektion besteht darin, die Funktion von Genen oder Genprodukten zu untersuchen, indem die spezifische Genexpression in Zellen verstärkt oder gehemmt wird, oder rekombinante Proteine herzustellen. Die Einführung exogener Nukleinsäure verändert die Eigenschaften von Zellen, um den Zweck der Transfektion zu erreichen, was für die Untersuchung der Genregulation und Proteinexpression sowie der Synthese und Produktion von Proteinen hilfreich ist.
Zelltransfektionen können durch chemische, biologische und physikalische Methoden oder die Verweildauer eines Fremdgens in der Zelle unterteilt werden. Bei der transienten Transfektion kann die eingeführte Nukleinsäure für eine begrenzte Zeit in der Zelle existieren, ohne sich zu replizieren, während bei der stabilen Transfektion die eingeführte Nukleinsäure in das Wirtsgenom integriert wird und in den Nachkommen der transfizierten Zelle exprimiert werden kann.
Wie wählt man bei so vielen verschiedenen Zelltransfektionsmethoden die richtige aus?
Es gibt keine einzige Transfektionsmethode, die für alle Zelltypen geeignet ist und alle experimentellen Anforderungen erfüllt. Die optimale Transfektionsmethode sollte entsprechend den Anforderungen des Zelltyps und den experimentellen Bedingungen ausgewählt werden.
Derzeit sind chemische Transfektionsreagenzien aufgrund ihrer einfachen Handhabung und Kompatibilität mit einer Vielzahl von Zelllinien noch immer die gängigsten Methoden zur Zelltransfektion.
2. Was ist lineares PEI MW 40000?
Polyethylenimin linear (PEI) MW40000 (Rapid Lysis) ist ein transientes Transfektionsreagenz auf Basis von Polyethylenimin mit einem Molekulargewicht von 40.000 (PEI 40000). PEI 40000 ist ein hochgeladenes kationisches Polymer, das leicht negativ geladene Nukleinsäuremoleküle binden und Komplexe bilden kann, wodurch Komplexe in Zellen eingebracht werden.
Im Vergleich zum Transfektionsreagenz PEI 25000 ist PEI 40000 leicht löslich und kann direkt in Wasser gelöst werden. Darüber hinaus enthält PEI 25000 4-11 % Propionylreste, die verhindern, dass das Polymerrückgrat an DNA bindet.Da es sich beim PEI 40000 jedoch um eine komplette Schuppenkonstruktion handelt, ist seine Leistung durchweg effizient.
3. Wie funktioniert lineares PEI MW 40000?
Polyethylenimin (PEI) ist ein ausgezeichneter multifunktionaler nicht-viraler Vektor mit guter Zellhaftung und kann zur Transfektion von Zellen unabhängig von lysosomalen Inhibitoren verwendet werden. PEI und DNA werden durch elektrostatische Kräfte gebunden, wodurch die DNA aus der lockeren, spulenartigen Struktur in sphärische Partikelkomplexe zerfällt. Die PEI-DNA-Komplexe sind normalerweise positiv geladen, um elektrostatisch mit der äußeren Zellmembran zu interagieren und durch Endozytose aufgenommen zu werden. Die endozytierten PEI-DNA-Komplexe werden dann von Endosomen eingefangen und zur Degradation in Lysosomen übertragen. Der ständig steigende innere Ionendruck führt dazu, dass das Endosom anschwillt und reißt, wodurch fremde DNA in das Zytoplasma freigesetzt wird. Dieser Transfektionsmechanismus wird als „Protonenschwamm“-Effekt bezeichnet.
Studien haben gezeigt, dass PEI-Moleküle die Oberfläche der PEI-DNA-Komplexe beschichten können, um die DNA ausreichend vor dem Abbau durch Nukleasen im Zytoplasma zu schützen und so den Transport der fremden DNA vom Zytoplasma zum Zellkern sicherzustellen. Darüber hinaus können sich PEI-Moleküle in die Phospholipidmembranen einfügen und stabile Kanäle für den DNA-Transfer in den Zellkern bilden. PEI-Moleküle dringen nicht in den Zellkern ein und spielen eine wichtige Rolle als DNA-Vektor.
Die Genexpression kann 1-4 Tage nach der Einführung des exogenen Gens in Säugetierzellen nachgewiesen werden. Diese Expression ist darauf zurückzuführen, dass ein Teil der eingeführten DNA nach dem Eintritt in den Zellkern in mRNA transkribiert und dann in das Zytoplasma translatiert wird. Da diese Methode relativ einfach und leicht umzusetzen ist, kann durch die Auswahl eines guten Expressionsvektors und einer guten Transfektionsmethode die Menge der Proteinexpression ein höheres Niveau erreichen. Die PEI-Transfektionsreagenzien werden in der wissenschaftlichen Forschung und in industriellen Anwendungen häufig als gängige Transfektionsmethode zur Untersuchung der Proteinstruktur und -funktion verwendet.
4. Was sind die Merkmale von PEI MW 40000?
Als transientes Transfektionsreagenz mit geringer Zytotoxizität weist PEI 40000 eine hohe Transfektionseffizienz und Genexpression in Zellen wie HEK293 und CHO auf. Das lineare PEI-Transfektionsreagenz wurde für eine Vielzahl von Zelllinien validiert, darunter HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, HepG2 und Hela-Zellen. Die Transfektionseffizienz beträgt bis zu 80 % bis 90 %. Sehen Sie sich weiterhin die Leistungsdaten an:
- Hohe Transfektionseffizienz, geeignet für adhärente und Suspensionszellen
Es ist für eine Vielzahl von Zelllinien geeignet, darunter HEK-293, HEK293T, CHO-K1, COS-1, COS-7, NIH/3T3, Sf9, HepG2 und Hela-Zellen usw. Die Transfektionseffizienz liegt bei 80–90 %.
Tabelle 1.Liste validierter Zelllinien
| Anhaftende Zellen (1 μg DNA) | Effizienz | Suspensionszellen (2 μg DNA) | Effizienz |
| HEK-293 | 80 % – 90 % | CHO-K1 | 85 % |
| Sf9 | 80 % – 90 % | HEK-293T | 70 % – 80 % |
| HepG2 | 80 % – 90 % | THP-1 | 70 % – 80 % |
| Hela | 80 % – 90 % |
| |
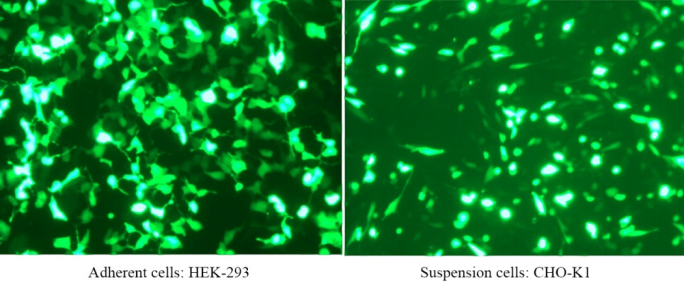
Abbildung 2. Mit PEI 40000 transfiziertes GFP-Plasmid in adhärente HEK-293-Zellen, die Transfektionseffizienz erreichte nach 72 Stunden 90 % (links); PEI 40000 transfizierte GFP-Plasmid in Suspensionszellen CHO-K1, und die Transfektionseffizienz erreichte nach 72 Stunden 80 % (rechts)
- Geringe Toxizität
Es stellt die Zelllebensfähigkeit sicher und verbessert die Transfektionseffizienz.
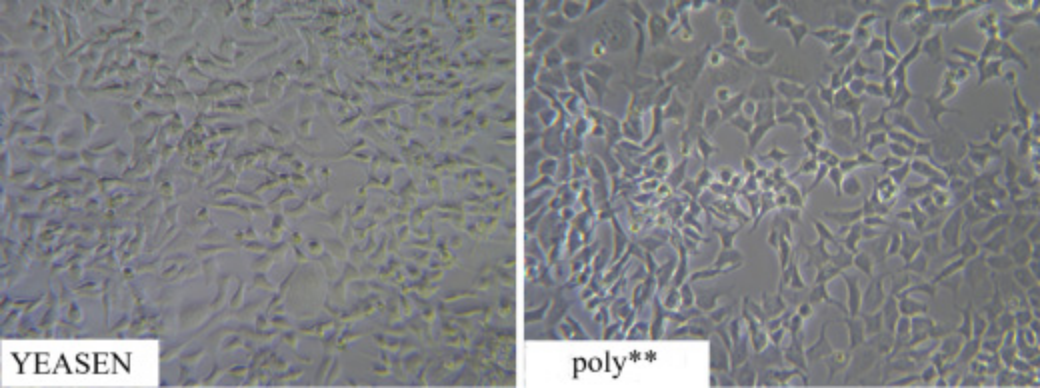
Abbildung 3. PEI 40000 von YEASEN hat eine viel geringere Zytotoxizität als konkurrierende Poly**
- Die Transfektionseffizienz ist höher als die von PEI 25000, das PEI 25000 vollständig ersetzen kann
PEI 25000 enthält 4-11 % Propionylreste, die verhindern, dass das Polymerrückgrat an DNA bindet. Im Vergleich zu PEI 25000 ist PEI 40000 eine vollständige Schuppenkonstruktion, sodass seine Leistung durchweg effizient ist.
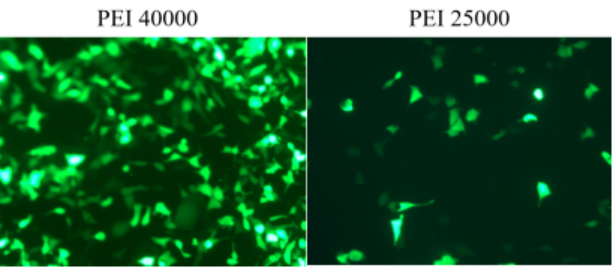
Abbildung 4. HEK-293-Zellen wurden unter Verwendung der Transfektionsreagenzien PEI 25000 und PEI 40000 vorübergehend mit GFP-Plasmid transfiziert und die Fluoreszenz wurde nach 72 Stunden beobachtet. Versuchsergebnisse: Die Transfektionseffizienz von PEI 40000 ist besser als die von PEI25000.
- Einfache Konfiguration und kurze Transfektionszeit
Bei diesem Produkt handelt es sich um einen Instanttyp, der ohne pH-Anpassung direkt in Wasser gelöst werden kann. Und er ist mit Serum und Antibiotika kompatibel, ohne dass das Medium gewechselt werden muss.
- Kostengünstig, geeignet für transiente Transfektion im großen Maßstab
Im Vergleich zu importierten Produkten hat das
5. Andere Transfektionsreagenzien von Yeasen
Tabelle 2.Liste der
| Katze# | Produktname | Nukleinsäuretyp | Zelltyp |
| 40823ES | DNA | Anhänger Und Suspensionszellen | |
| 40816ES | DNA | Anhänger Und Suspensionszellen | |
| 40820ES | DNA | Anhänger Und Suspensionszellen | |
| 40821ES | DNA | Anhänger Und Suspensionszellen | |
| 40802ES | DNA (<10kb), shRNA | Adherent Zellen | |
| 40805ES | Hieff Trans™ Suspension zellfrei Liposomales Transfektionsreagenz (Erkundigen) | DNA (<10kb) | Suspensionszellen(Für suspendierte Blutzellen oder Immun Zellen, die Transfektionseffizienz der aktuellen chemischen Reagenzien ist nicht hoch. Elektroporation oder Virusmethode werden empfohlen.) |
| 40806ES | siRNA、miRNA、Prä-miRNA, mimische miRNA, Anti-miRNA | Adhärente und Suspensionszellen |
6. Lesen beachten
Transfektionsreagenz – Hieff Trans™ und PEI
Leitfaden zur Produktauswahl für In-vitro-Zelltransfektionsreagenzien
Referenz:
[1] Lu, Y., Yao, J., & Zhou, J. (nd). Bildung und Aggregationsverhalten von Polyethylenimin-DNA-Komplexen. Fakultät für Pharmazie, Nanjing 210009.
[2] Sabin, J., et al. (2022). Neue Erkenntnisse über den Mechanismus der Polyethylenimin-Transfektion und ihre Auswirkungen auf Gentherapie und DNA-Impfstoffe. Colloids and Surfaces B: Biointerfaces, 210, 112219.
[3] Transiente Säugetierzelltransfektion mit Polyethylenimin (PEI). Longo PA, Kavran JM, Kim MS, Leahy DJ
