Zelltherapie bezeichnet den Einsatz biotechnologischer Methoden, um Zellen mit spezifischen Funktionen zu erhalten, die dann durch Prozesse wie Ex-vivo-Expansion und spezielle Kultivierung verbessert werden. Diese Zellen sind mit verstärkten Immunreaktionen, der Fähigkeit, Krankheitserreger und Tumorzellen abzutöten, und anderen Funktionen ausgestattet, um die therapeutischen Ziele für bestimmte Krankheiten zu erreichen. Gentherapie bezeichnet den therapeutischen Ansatz, die Expression einzelner Gene zu modifizieren oder defekte Gene durch Methoden wie Genaddition, Genmodifikation und Gen-Silencing zu reparieren. Das ultimative Ziel ist die Heilung von Krankheiten durch Korrektur abnormaler Gene.
| Produkt Arten | Beschreibung | Nummer von Genehmigt Medikamente Weltweit |
| Gen Therapie Vektor Produkte | Diese Produkte nutzen Gen Therapie Vektoren Zu liefern therapeutisch Gene Zu spezifisch Zellen In Die Patienten Gewebe, Zielen für Die Ausdruck oder Verordnung von therapeutisch Proteine. Das Kategorie verlässt sich An Die Lieferung von Gen Therapie Vektoren. | 2 |
| Mobilfunk Produkte | Verwenden von Integration viral Vektoren (solch als lentiviral Vektoren), Gene Sind eingeführt hinein Vorläufer Zellen oder Stängel Zelle Genome unter ex vivo Bedingungen. Als Zellen teilen, Die Gene Sind bestanden Zu Nachkomme Zellen. Der geändert Zellen Sind Dann aufgegossen zurück hinein Die geduldig. Mobilfunk Produkte hauptsächlich enthalten Kategorien solch als T Zellen, NK Zellen, Und Stängel Zellen. | 8 |
| Onkolytisch Virus Produkte | Abgeleitet aus geändert onkolytisch Viren mit Tumorabtötung Fähigkeiten, diese Produkte arbeiten An Die Prinzip von unter Verwendung Die Viren spezifisch Erkennung von Tumor Zellen Und Die immun Aktivierung ausgelöst auf infizierend Tumor Zellen. Das führt Zu gezielt Tötung von Tumor Zellen. | 1 |
Lösung zur Produktion und Expression viraler Vektoren
Der Kern der Arzneimittelproduktion für Zell- und Gentherapie (CGT) liegt in der Expression viraler Vektoren, einem Prozess, der typischerweise sowohl die vorgelagerte Vektorexpression als auch die nachgelagerte Reinigung umfasst. Die Vektorproduktion umfasst hochkomplexe Prozesse, stellt erhebliche Herausforderungen dar und hat oft lange Vorbereitungszyklen. Folglich nähert sich die globale GMP-Produktionskapazität für virale Vektoren einem Engpass, was ein großes Hindernis für die Entwicklung der gesamten Gentherapiebranche darstellt. Die Entwicklung, Skalierung und GMP-Produktion von Gentherapievektoren erfordern komplizierte Produktionssysteme und strenge Qualitätskontrollsysteme. Diese umfassen Prozesse wie die Einrichtung von Stamm-, Zell- und Virusbanken, groß angelegte E. coli-Stammkulturen und die Produktion von Gentherapievektoren.coli-Fermentation, Zellkulturprozesse, Prozesse zur Virusernte und -reinigung, aseptische Verarbeitung sowie Formulierungs- und Abfüllprozesse.
 AAV-Produktionskosten
AAV-Produktionskosten
Neben Investitionen in Sachanlagen (wie Ausrüstung, Reinräume usw.) und Arbeitskosten entstehen die Hauptkosten durch den Materialverbrauch in den vor- und nachgelagerten Prozessen. Die vorgelagerten Kosten betreffen hauptsächlich Rohstoffe wie Plasmide, Kulturmedien, Transfektionsreagenzien und Nukleasen; die nachgelagerten Kosten umfassen hauptsächlich Chromatographieharze, Kosten für die Qualitätskontrolle und mehr.
Kationischer Polymerträger
Zu den kationischen Polymeren (Polymeren) zählen Polyethylenimin (PEI), Poly(beta-aminoester) (PBAE), Chitosan, Polyacrylamid (PAH), Diethylaminoethyldextran (DEAE-Dextran), Poly(amidoamin)-Dendrimere (PAMAM) und andere. Das gemeinsame Prinzip der kationischen Polymertransfektion besteht in der Komplexierung von DNA unter physiologischen pH-Bedingungen, um den Abbau durch DNase zu verhindern. Anschließend heften sich diese Komplexe an die Zellmembran und werden durch Endozytose aufgenommen, woraufhin sie brechen und die DNA ins Zytoplasma freigesetzt wird, um ihre beabsichtigten Funktionen auszuüben. Der Hauptunterschied zwischen kationischen Polymeren und kationischen Lipiden besteht in der Abwesenheit hydrophober Teile in kationischen Polymeren, wodurch sie vollständig wasserlöslich sind und bequeme chemische Modifikationen ermöglichen.
Hieff Trans® PEI-Transfektionsreagenzien

| Prüfen Artikel | Standard | Forschung und Entwicklung Grad (40820) | GMP Grad (40821) |
| AAussehen | Vollständig, genau Information, NEIN Schaden, usw | √ | √ |
| Transfektion tEffizienz | > 70 % Transfektion Effizienz> 80 % Zelle Lebensfähigkeit | √ | √ |
| ENdotoxin | < 0,5 EU/ml | √ | √ |
| SFruchtbarkeit | Aseptisch Wachstum | √ | √ |
| MAbonnieren Rückstand | Nnegativ | √ | √ |
| pH | < 7,0 | √ | |
| Osmotisch PRDruck | ≤ 30 mOsm/kg | √ | |
| Verunreinigung RRückstand | MEthanol (≤ 0.3 %) Ethyl Äther(≤ 0,5 %) Methylbenzol (≤ 0,002 %) | √ | |
| Schwer Met al. RRückstand | ≤ 10 ppm |
| √ |
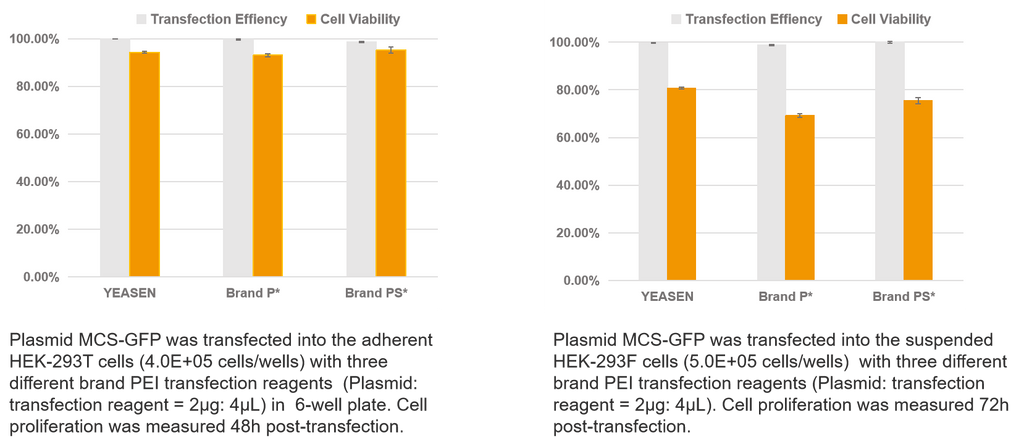
Transfektion einzelner Plasmide
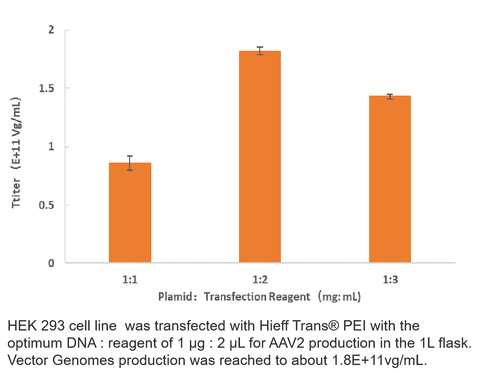
Virustiterdaten
1. LV-Produktion

2. AAV2-Produktion
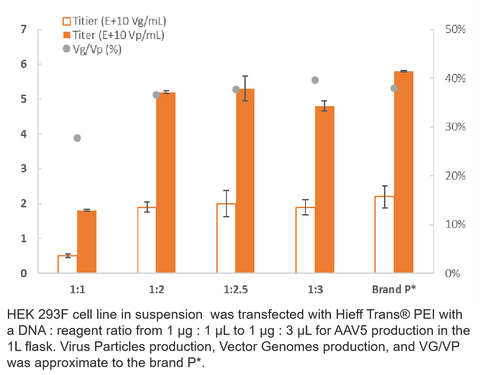
3. AAV5-Produktion
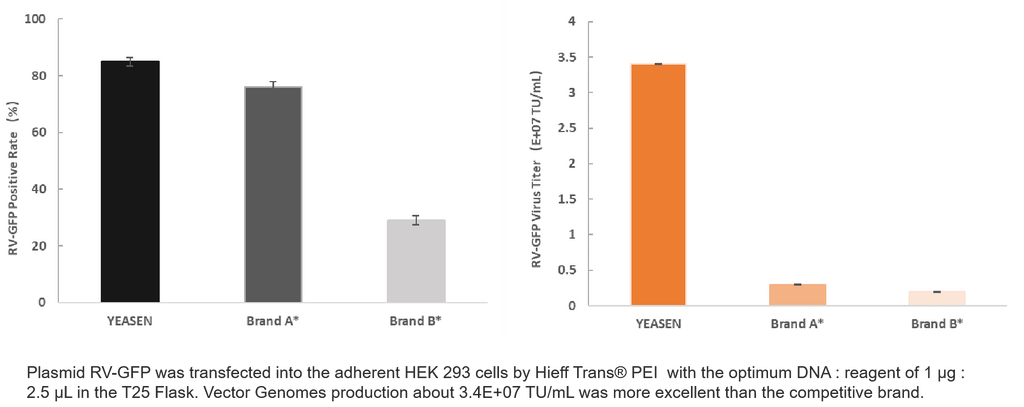
4. RV-Produktion
Produktinformationen
| Produktname | Katzen-Nr. |
| Hieff Trans® PEI-Transfektionsreagenz-GMP | 40821ES |
| Kit zur Erkennung von DNA-Rückständen in Wirtszellen von E.coli | 41308ES |
| E.coli Wirtszell-RNA-Rückstands-Erkennungskit | 41318ES |
| E.coli HCP ELISA-Kit | 36712ES |
| HEK293 HCP ELISA-Kit | 36713ES |
| HEK293-Kit zur Erkennung von DNA-Rückständen in Wirtszellen | 41302ES |
| HEK293 Kit zur Analyse der DNA-Größe von Wirtszellrückständen | 41316ES |
| MycAway™ Mycoplasma Echtzeit-qPCR-Erkennungskit (2G) | 40619ES |
| UCF.ME® UltraNuclease GMP-Qualität | 20157ES |
| Salt Active UltraNuclease GMP-Qualität | 20159ES |
| UltraNuclease ELISA Kit | 36701ES |
| Salzaktives UltraNuclease ELISA-Kit | 36703ES |
| RCA (E1A) Kopienzahl-Erkennungskit | 41321ES |
| Replikationskompetentes Lentivirus (RCL)-Nachweiskit | 41311ES |
| MolPure™ Magnetisches Probenvorbereitungskit für Rest-DNA | 18461ES |
