Mit der fortschreitenden Erforschung von Organoiden beteiligen sich immer mehr Menschen daran. Dieser Artikel fasst einige allgemeine Wissenspunkte zu Organoiden [1-5] zusammen und hofft, für alle hilfreich zu sein.
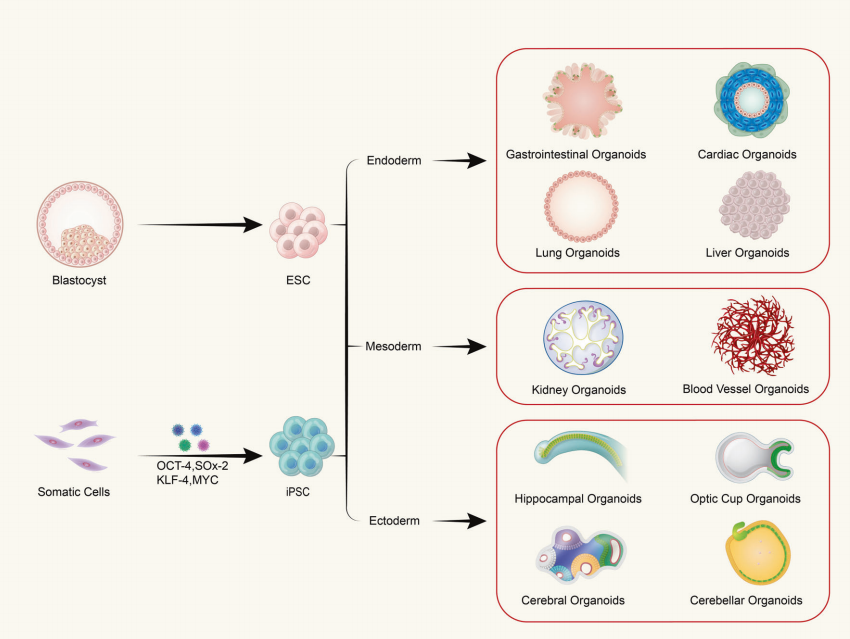
F: Bestehen Organoide aus einem einzigen Zelltyp oder aus mehrzelligem Gewebe?
Organoide entstehen durch die dreidimensionale (3D) Kultivierung adulter oder pluripotenter Stammzellen in vitro, wodurch gewebeähnliche Strukturen mit einer bestimmten räumlichen Organisation entstehen. Organoide sind keine Strukturen, die aus einzelnen Zellen bestehen. Sie entstehen vielmehr durch die induzierte Teilung und Differenzierung von Zellen mit Stammzelleigenschaften, die sich dann selbst zu Geweben mit einer bestimmten räumlichen Struktur, Morphologie und Funktionalität zusammensetzen, die den entsprechenden Organen in vivo ähneln.
F: Was sind die Quellen für die Kultivierung von Organoiden?
(1) Aus pluripotenten Stammzellen gewonnene Organoide umfassen adulte Stammzellen (ASC), pluripotente Stammzellen (PSC) und induzierte pluripotente Stammzellen (iPSC). (2) Aus gewebeextrahierten Zellen gewonnene Organoide kommen häufig in Tumorgewebe vor.
F: Kann gefrorenes Gewebe für die 3D-Kultivierung verwendet werden, wenn kein frisches Gewebe vorhanden ist?
Ja, allerdings gelten höhere Anforderungen an die Größe des gefrorenen Gewebes und die Lebensfähigkeit der primär gefrorenen Gewebe und Zellen nimmt erheblich ab, was zu einer deutlich geringeren Erfolgsrate bei der nachfolgenden Kultivierung führt.
F: Wie werden Organoide eingefroren und wiederbelebt?
Der optimale Zeitpunkt zum Einfrieren von Organoiden ist bei den Passagen 2-5, wenn die Aktivität und das Differenzierungspotenzial der Organoide am höchsten sind. Die Wiederbelebung der Organoide kann den gleichen Methoden folgen, die für die Zellwiederbelebung verwendet werden.
F: Ist es notwendig, die Größe kultivierter Organoide zu kontrollieren, und ist es von Vorteil, wenn sie zu groß sind?
Ja, es ist notwendig, die Größe zu kontrollieren, vorzugsweise innerhalb von 500 μm, da Organoiden interne Gefäß- und Gas-Flüssigkeits-Zirkulationssysteme fehlen. Wenn Organoide groß sind, haben Zellen in der Nähe des Zentrums Schwierigkeiten, Sauerstoff und Nährstoffe mit der Außenumgebung auszutauschen. Daher ist die Anzahl der toten Zellen umso größer, je größer die Struktur ist.
F: Was kann außer der Verwendung von Matrixgel noch zur Kultivierung von Organoiden verwendet werden?
Alternativen zur Kultivierung von Organoiden sind neben Matrixgelen (1) dezellularisierte extrazelluläre Matrix und andere abgeleitete Proteine, (2) synthetische Hydrogele und (3) konstruierte rekombinante Proteingele.
F: Wie kann eine gezielte Differenzierung von Organoiden erreicht werden?
Die frühe Entwicklung der durch Stammzellen induzierten Differenzierung in Organoiden wird gemeinsam durch mehrere Signalwege reguliert. Die In-vitro-Kultivierung erfordert die Zugabe von Wachstumsfaktoren, um die Aktivität dieser Signalwege zu simulieren und die Zellen dazu zu bringen, sich in bestimmte Richtungen zu differenzieren. Beispielsweise kann die Induktion mit Y27632 und Activin A embryonale Stammzellen (ESCs) oder induzierte pluripotente Stammzellen (iPSCs) in Embryoidkörper (EBs) differenzieren. Anschließend werden Signalwege durch Faktoren wie Wnt3a, FGF-4 und Noggin reguliert, um die Differenzierung der Stammzellen in bestimmte Richtungen zu induzieren.
F: Wie können Kontaminationen bei der Entnahme klinischer Proben vermieden werden?
(1) Stellen Sie sicher, dass die Proben so weit wie möglich aseptisch entnommen werden. (2) Tauchen Sie die Proben vor der Extraktion mehrere Minuten lang in PBS mit Antibiotika ein: Bei Tumoren in Bereichen mit potenziellem Kontakt mit der äußeren Umgebung, wie Magen, Darm und Blase, wird empfohlen, die Proben 5–10 Minuten lang in PBS mit 3–5 % Antibiotika einzutauchen; bei anderen häufigen Tumoren tauchen Sie die Proben etwa 5 Minuten lang in PBS mit 1–2 % Antibiotika ein. (3) Alle während der Zellextraktion verwendeten Reagenzien sollten 1 % Antibiotika und eine geeignete Konzentration an primären Antibiotika enthalten.
F: Welche Vorsichtsmaßnahmen sollten bei der Entnahme, Konservierung und dem Transport von Tumorgewebe getroffen werden?
Sammeln Sie möglichst viel Tumorgewebe mit einem hohen Gehalt an Tumorzellen und minimieren Sie die Zeit, in der die Gewebeproben der Luft ausgesetzt werden, um die Wahrscheinlichkeit einer Kontamination zu verringern. Legen Sie gesammelte Tumorgewebeproben so schnell wie möglich in sterile Röhrchen mit spezieller Probenkonservierungslösung und transportieren Sie sie schnell bei niedriger Temperatur (ca. 4 °C) zur Testeinheit (streben Sie eine Lieferung innerhalb von 2 bis 4 Stunden nach der Probenentnahme an).
F: Gibt es einen Unterschied zwischen aus Läsionen gezüchteten Organoiden und solchen, die aus angrenzendem Gewebe gezüchtet werden?
Welche Anforderungen gelten für die Probenentnahmestellen von Tumorgewebe? Ja, es gibt einen Unterschied. Tumore selbst weisen Heterogenität auf, daher ist es üblich, Unterschiede zwischen Organoiden aus verschiedenen Quellen zu beobachten. Morphologisch gesehen neigen Organoide aus primären Läsionen dazu, im Vergleich zu denen aus benachbarten Geweben eine invasivere Struktur zu haben und erscheinen im Allgemeinen unregelmäßiger. Um Fehler bei der Modellierung oder beim Arzneimittelscreening zu minimieren, sollten mehrere Proben aus Bereichen mit guter Aktivität entnommen werden.
F: Welche Arten von Arzneimitteln können für den Arzneimittelempfindlichkeitstest von Tumor-Organoiden verwendet werden?
Die wichtigsten Arten von Antitumormedikamenten in der klinischen Praxis können in drei Kategorien eingeteilt werden: Zytostatika (wie Paclitaxel, Cisplatin/Carboplatin, 5-FU usw.), zielgerichtete Medikamente (Medikamente, die auf EGFR, HER2, VEGFR usw. abzielen) und Immuntherapiemedikamente, vertreten durch Immun-Checkpoint-Inhibitoren (PD-1-Antikörper, PD-L1-Antikörper usw.).
F: Wie hoch ist die Erfolgsquote beim PDO-Anbau?
Die Erfolgsrate der PDO-Kultivierung variiert je nach Quelle leicht. Die meisten PDOs haben eine Erfolgsrate zwischen 63 % und 70 % oder sogar höher, bis zu 90 %, was weitgehend mit der Aktivität des Gewebes selbst korreliert. Darüber hinaus können klinische Behandlungen die Erfolgsrate beeinflussen. Die Erfolgsraten können verbessert werden, indem die Zeit der Gewebeex-vivo- und Operationsschritte verkürzt wird.
F: Kann gefrorenes Gewebe für die Organoid-Kultivierung verwendet werden?
Im Allgemeinen wird die Kryokonservierung von Gewebe aufgrund des erheblichen Verlusts der Lebensfähigkeit nicht empfohlen. Wenn Gewebe jedoch bei -80 °C gelagert wird, liegt das optimale Zeitfenster für die Organoidkultivierung innerhalb von 6 Wochen nach der Konservierung. Wenn Gewebe in flüssigem Stickstoff gelagert wird, kann die Konservierungszeit länger sein, sollte aber sechs Monate nicht überschreiten.
F: Bei der Gewinnung von Primärzellen sind in der Regel auch Fibroblasten eingemischt. Wie ist mit diesen umzugehen?
(1) Aufgrund der schlechten Haftung der Fibroblasten können diese durch wiederholtes Anhaften entfernt werden.(2) Reagenzien zur Fibroblastenentfernung können verwendet werden. Ob sie jedoch die Organoidkultivierung beeinträchtigen, muss experimentell überprüft werden.
F: Wie viel ursprüngliches Tumorgewebe wird für die Züchtung von Tumor-Organoiden benötigt? Ist die Biopsieprobe ausreichend?
Im Allgemeinen sollten die chirurgischen Gewebeproben größer als zwei bis drei Sojabohnen sein. Bei einer Entnahme durch eine Nadelbiopsie sind mindestens zwei bis drei Proben erforderlich, während bei endoskopischen Biopsien mindestens sechs oder mehr Tumorgewebeproben abgeklemmt werden müssen.
F: Was ist zu tun, wenn die Tumorgewebeprobe zu klein ist und die Anzahl der kultivierten Organoide für anschließende Tests nicht ausreicht?
Da Organoide, die aus Tumorquellen stammen, nach der Passage phänotypische Unterschiede aufweisen können, wird die Passage im Allgemeinen nicht empfohlen. In der Literatur wird empfohlen, die Passage von Organoiden auf 2–3 Generationen und maximal 5 Generationen zu beschränken. Wenn die Zellzahl zu gering ist und die Testanforderungen nach 5 Generationen nicht erfüllt, sollten Sie eine Änderung der Testmethode in Betracht ziehen, z. B. die Verwendung einer kleineren 384-Well-Platte oder den Versuch mit Mikrofluidchips zum Testen.
F: Gibt es im Tumorgewebe normale Zellen? Wie entfernt man diese normalen Zellen?
Es kann eine kleine Anzahl normaler Zellen vorhanden sein. Versuchen Sie zunächst, bei der Entnahme die Entnahme normaler Gewebe zu vermeiden. Zweitens können nach der Extraktion primärer Zellen zur weiteren Organoidkultivierung magnetische Perlensortierung oder Durchflusszytometrie verwendet werden. Wenn eine sehr kleine Anzahl normaler Zellen vorhanden ist, hat dies keinen wesentlichen Einfluss auf die nachfolgende Organoidmodellierung und -kultivierung, sodass eine Entfernung möglicherweise nicht erforderlich ist.
F: Warum erscheinen die Zellen rot, wenn Primärzellen aus Tumorgewebe extrahiert werden?
Gewebe sind in vivo reich an Blut, daher gibt es viele rote Blutkörperchen. In den meisten Fällen ist keine Verarbeitung erforderlich und die Organoidkultivierung wird dadurch nicht beeinträchtigt. Wenn zu viele rote Blutkörperchen vorhanden sind, können sie vor der Kultivierung entsprechend mit Lysepuffer behandelt werden.
F: Während der Organoid-Kultivierung werden schwarze Partikel gefunden. Wie kann man sie entfernen?
Bei den schwarzen Partikeln handelt es sich höchstwahrscheinlich um Verunreinigungen oder Zelltrümmer. Sie können auf zwei Arten entfernt werden:
Verdauen Sie die Organoide und waschen Sie sie wiederholt mit Medium, um die Verunreinigungen zu verdünnen.
Schneiden Sie die Organoide mit einem sterilen chirurgischen Messer in zwei Hälften und spülen Sie anschließend mit einer mit Medium gefüllten 1-ml-Spritze vorsichtig Unreinheiten aus den Organoiden aus.
F: Gibt es eine Begrenzung für die Anzahl der Passagen bei der Organoidkultivierung und wie viele Passagen können durchgeführt werden?
Die Anzahl der Passagen hängt im Allgemeinen von den Eigenschaften der Quellzellen ab. Die meisten Organoide können in vitro bis zu 10-mal (> 6 Monate) passagiert werden. Auch die Wahl der Kulturbedingungen kann einen gewissen Einfluss haben, wobei konditioniertes Medium im Allgemeinen einem synthetischen Faktormedium überlegen ist.
F: Können Tumorzelllinien (wie etwa die HepG2-Zelllinie) in PDOs kultiviert werden?
PDOs sind komplexe selbstorganisierte Strukturen. 3D-Kultursysteme, die aus einzelnen Zelllinien gebildet werden, können nicht als PDOs bezeichnet werden. Sie werden einfach als 3D-Kugelzustände bezeichnet.
F: Was sind die Kriterien für die Passagierung von Organoiden?
Je nach Entwicklungsstatus der Organoide variiert die Zeit, normalerweise zwischen 5 und 10 Tagen, bei einem Durchmesser von etwa 100–200 μm. Einige sich langsam entwickelnde Organoide benötigen möglicherweise mehrere Wochen, um ein geeignetes Passagestadium zu erreichen.
F: Wie zählt man die Anzahl lebensfähiger Organoide?
Nehmen Sie während des Experiments die vorbereitete Calcein-AM-Aufbewahrungslösung heraus und geben Sie dem Medium Calcein-AM-Lösung bis zu einer Endkonzentration von 0,2 μmol/l hinzu. Inkubieren Sie 60 Minuten lang bei 37 °C. Nach Ablauf der Zeit waschen Sie das Calcein-AM-haltige Medium langsam mit PBS ab und geben Sie frisches Medium hinzu. Verwenden Sie ein Fluoreszenzmikroskop mit einer Anregungswellenlänge von 490 nm und einer Emissionswellenlänge von 515 nm, um die Organoide zu beobachten und zu fotografieren. Lebende Organoide erscheinen grün und haben klare Kanten. Zählen Sie die Organoide mit einem Durchmesser von >20 μm.
F: Wie berechnet man die Lebensfähigkeit von Organoiden?
Die Lebensfähigkeit der Organoide wird nach der Formel X=(Nlive/Ntotal)×100 % berechnet, wobei X die Lebensfähigkeit der Organoide darstellt, Nlive die Anzahl der lebenden Organoide darstellt und Ntotal die Gesamtzahl der Organoide darstellt.
F: Welche Methoden gibt es zur Identifizierung von Organoiden?
Die einfachste Methode besteht darin, die Morphologie der Organoide unter dem Mikroskop zu beobachten und eine H&E-Färbung durchzuführen. Weitere Methoden sind Western Blot, qRT-PCR, Immunfluoreszenz und Durchflusszytometrie, um festzustellen, ob die Organoide entsprechende Biomarker exprimieren. Durch genetische Sequenzierung kann die genetische Übereinstimmung zwischen den kultivierten Organoiden und dem Quellgewebe festgestellt werden. Bei einigen Organoiden können Funktionstests durchgeführt werden, um festzustellen, ob sie bestimmte Funktionen besitzen. Studien haben beispielsweise gezeigt, dass Magenorganoide Magensäure absondern und Herzorganoide autonom schlagen können.
F: Können auch normale Zellen zu Organoiden heranwachsen? Wie entferne ich bei der Kultivierung von Tumor-Organoiden normale Organoide?
Auch normale Zellen können zu Organoiden heranwachsen. Zu den Methoden, um normale Organoide zu gewinnen, gehören: (1) Manuelle Auswahl auf der Grundlage von HE-Färbeergebnissen unter dem Mikroskop; (2) Reinigung von PDOs durch Anpassung der Zusammensetzung des Kulturmediums (wie Wachstumsfaktoren/Inhibitoren kleiner Moleküle); (3) Dispergieren von PDOs in einzelne Zellen für die Durchflusszytometrie oder die Sortierung magnetischer Kügelchen.
F: Sollten bei Experimenten zur Arzneimittelempfindlichkeit PDOs aus dem Matrixgel verdaut werden?
Nein, PDOs benötigen eine dreidimensionale Struktur, um In-vivo-Bedingungen zu simulieren. Wenn das Matrixgel keine Unterstützung bietet, wird die Genauigkeit von Arzneimittelempfindlichkeitsexperimenten beeinträchtigt. Im Allgemeinen können lösliche Arzneimittel das Matrixgel durchdringen, um auf Organoide einzuwirken, aber bei der Durchführung immunzytochemischer Experimente muss das Matrixgel entfernt werden.
F: Können PDO-Experimente Tiermodelle vollständig ersetzen (PDX)?
PDOs können PDX teilweise, aber nicht vollständig ersetzen.
F: Was könnten die Gründe für das abnormale Wachstum von PDOs während des Anbaus sein, das durch verkürzte Wachstumszyklen und eine schnelle Vermehrung im Vergleich zu früheren Bedingungen gekennzeichnet ist?
Externe Faktoren: (1) Diese Anomalie kann durch das übermäßige Wachstum bestimmter kontaminierender Zellen, wie Fibroblasten, verursacht werden. In solchen Fällen wird empfohlen, eine Schnittfärbung und -beobachtung durchzuführen, um das Vorhandensein dieser kontaminierten Zellen zu bestätigen und sie dann zu entfernen. (2) Änderungen der Kulturbedingungen, einschließlich der Zugabe bestimmter Faktoren oder kleiner Moleküle, können die Proliferationswege von PDOs weiter aktivieren.
Interne Faktoren: Mögliche genetische Mutationen. Um dies zu überprüfen, wird eine Sequenzierung empfohlen. Die Ergebnisse sollten mit denen der primären PDOs verglichen werden, um festzustellen, ob genetische Mutationen vorliegen.
F: Wie kann die Arzneimittelempfindlichkeit von PDOs getestet werden?
PDOs können mit Methoden wie CCK8-Test, ATP-Zelllebensfähigkeitstest und Lebend/Tot-Färbung auf Arzneimittelempfindlichkeit getestet werden. Die Beurteilung der ATP-Aktivität von Tumor-Organoiden ist die gängigste Methode. ATP ist das wichtigste Energiemolekül in Zellen und kann zur Messung des zellulären Stoffwechselniveaus verwendet werden, das die Anzahl lebensfähiger Zellen widerspiegelt. Basierend auf der Wirkung der Arzneimittelverabreichung auf den zellulären ATP-Gehalt kann der IC50-Wert (halbmaximale Hemmkonzentration des getesteten Arzneimittels) für jedes Arzneimittelschema mithilfe einer Analysesoftware berechnet werden, um die wirksamsten Arzneimittel zur Tumorhemmung auszuwählen.
F: Sind die Konzentrationsbereiche für Arzneimittelempfindlichkeitsexperimente von PDOs dieselben wie die für primäre Tumorzellen?
Nein, sie sind nicht gleich. Normalerweise muss die Arzneimittelkonzentration für PDOs höher sein als für Primärzellen. Es können Vorversuche durchgeführt werden, um die optimalen Konzentrationen für formale Arzneimittelempfindlichkeitsexperimente zu analysieren.
F: In welchem Wachstumsstadium sollten Organoide für Arzneimitteltests verwendet werden?
Es wird allgemein empfohlen, Organoide innerhalb von 5 Passagen für Arzneimitteltests zu verwenden. In diesem Stadium weisen Organoide die beste Stabilität und Aktivität auf.
F: Welche Kriterien gelten für die Bestimmung des Erfolgs der Organoid-Etablierung?
(1) Frühe vorläufige Beurteilung: Die Morphologie der Organoide verändert sich von einem zellulären Zustand zu Formen wie vakuolär, knospend, kompakt oder locker. (2) Identifizierung der Expression spezifischer Biomarker, die der Verteilung in Gewebeschnitten ähneln sollte. Für detailliertere Vergleiche können weitere Sequenzierungsanalysen durchgeführt werden.
F: Wie unterscheidet sich die Organoid-Kultivierung von der normalen Zellkultur?
(1) Verschiedene Zellkulturmethoden: Organoide benötigen die Unterstützung von Substraten oder räumlichen Strukturen, um ihre dreidimensionale Struktur aufrechtzuerhalten, während dies bei der normalen Zellkultur nicht erforderlich ist. (2) Die Organoidkultur erfordert eine ex vivo-Differenzierung und Selbstassemblierung, was die Verwendung von Kombinationen verschiedener Zytokine zur Induktion erfordert, was zu relativ komplexen Kulturmediumkomponenten führt. Bei der normalen Zellkultur wird normalerweise nur ein einziger Zelltyp verwendet, daher sind die Kulturmediumkomponenten relativ einfach.(3) Verschiedene Zellquellen: Organoide werden aus multipotenten Epithelzellen gewonnen, während sich die reguläre Zellkultur für die Kultivierung verschiedener Typen ausgewählter Zellen eignet.
F: Wie kann ich feststellen, ob die von mir kultivierten 3D-Kugeln Organoide sind und ob sie mit dem Zielgewebe übereinstimmen?
Zu den Methoden zur Identifizierung von Organoiden gehören H&E-Färbung, Immunhistochemie (IHC), Einzelzellsequenzierung und andere. Es ist notwendig, mehrdimensionale Beurteilungen aus morphologischer, histopathologischer und molekulargenetischer Sicht vorzunehmen, um festzustellen, ob sie mit dem Zielorgan oder -gewebe übereinstimmen. Bei Tumororganoiden kann der Nachweis spezifischer Biomarker zur Bestätigung verwendet werden.
F: Wenn die während der Kultivierung beobachtete Morphologie der Organoide von der in der Literatur berichteten abweicht, was könnte der Grund dafür sein?
Erstens können individuelle Unterschiede und Heterogenität in den Probenquellen und -subtypen bestehen. Zweitens können Unterschiede in der Qualität ausgewählter Zytokine und einiger zur Induktion verwendeter niedermolekularer Inhibitoren zu Abweichungen in der Differenzierungsmorphologie verschiedener Organoide führen. Es wird empfohlen, die Übereinstimmung zwischen der Morphologie der Organoide und dem Quellgewebe durch Methoden wie HE-Färbung, IHC und genetische Sequenzierung zu bestätigen, anstatt sich ausschließlich auf Literaturbeschreibungen zu verlassen.
F: Ist es bei der Durchführung von Arzneimittelempfindlichkeitsexperimenten mit Organoiden erforderlich, die Menge an DMSO, die als Lösungsmittel für Arzneimittel verwendet wird, zu kontrollieren?
Ja, normalerweise erfordern Experimente zur Arzneimittelempfindlichkeit, dass der Volumenanteil von DMSO weniger als 0,5 % beträgt.
F: Wie können Organoide aus dem Matrixgel gewonnen werden?
Die folgenden Methoden werden empfohlen: (1) Mit handelsüblichen Organoid-Gewinnungslösungen (CAT#41421ES) können Zellsuspensionen schonend und effektiv gewonnen werden, ohne Zellen oder Zelloberflächenproteine zu beschädigen. (2) Das Matrixgel kann bei niedriger Temperatur aufgetaut werden, um es aufzuweichen und die Organoide freizugeben.
F: Viele Organoide bleiben während der Rückgewinnung an den Wänden des Zentrifugenröhrchens haften. Wie kann die Rückgewinnungsrate verbessert werden?
Verwenden Sie zum Zentrifugieren nach der Entnahme eine horizontale Rotorzentrifuge und erhöhen Sie die Zentrifugationsgeschwindigkeit entsprechend. Im Allgemeinen sind eine Zentrifugalkraft von etwa 300 g und eine Geschwindigkeit von etwa 1000–1200 U/min geeignet.
Verwandte Zytokine Information
| PProdukt Nmich | KATZE | Größe |
| Menschliches Wnt-3a | 92276ES10 | 10μG |
| 92278ES20 | 20μG | |
| 92701ES10 | 10μG | |
| Menschlicher Schädel | 92528ES10 | 10μG |
| 91330ES10 | 10μG | |
| 91306ES10 | 10μG | |
| 91502ES10 | 10μG | |
| 91701ES08 | 10μG | |
| 92602ES60 | 100μG | |
| 91204ES10 | 10μG | |
| 90601ES10 | 10μG | |
| 91113ES10 | 10μG | |
| 92279ES10 | 10μG | |
| 92055ES10 | 10μG | |
| 92053ES10 | 10μG | |
| 92129ES08 | 5μG | |
| 91304ES10 | 10μG | |
| 91702ES10 | 10μG | |
| 92252ES60 | 100μG | |
| 90103ES10 | 10μG | |
| 90104ES10 | 10μG | |
| 90197ES10 | 10μG | |
| 90144ES08 | 10μG | |
| 90196ES10 | 10μG | |
| 90194ES10 | 10μG | |
| 90111ES10 | 10μG | |
| 90120ES10 | 10μG | |
| 90198ES10 | 10μG | |
| 91605ES10 | 10μG | |
| 92251ES10 | 10μG | |
| 92566ES08 | 5μG | |
| 92102ES10 | 10μG | |
| 91103ES10 | 10μG | |
| 92711ES10 | 10μG | |
| 92122ES60 | 100μG | |
| 92201ES60 | 100μG | |
| 92275ES20 | 20μG | |
| Menschliches BMP-2 | 92051ES10 | 10μG |
Weiterführende Literatur:
Referenz
