A medida que se profundiza la investigación sobre los organoides, cada vez más personas se suman a ella. Este artículo resume algunos puntos de conocimiento común sobre los organoides [1-5], con la esperanza de que sea útil para todos.
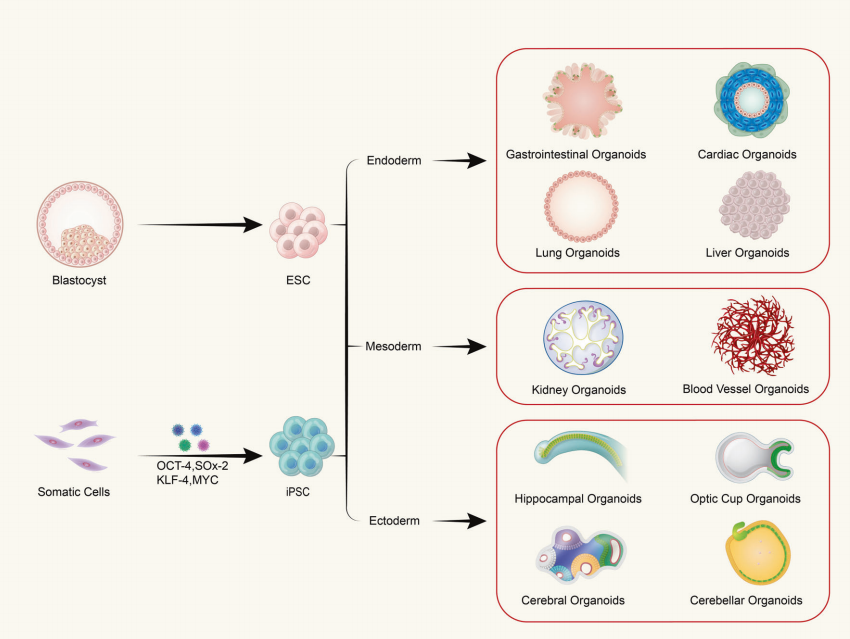
P: ¿Los organoides están compuestos por un solo tipo de célula o por tejidos multicelulares?
Los organoides se forman a partir del cultivo tridimensional (3D) in vitro de células madre adultas o células madre pluripotentes, lo que da como resultado estructuras similares a tejidos con una determinada organización espacial. Los organoides no son estructuras compuestas por células individuales, sino que se forman induciendo la división y diferenciación de células iniciadoras con propiedades de células madre, que luego se autoensamblan en tejidos con una determinada estructura espacial, morfología y funcionalidad similar a los órganos correspondientes in vivo.
P: ¿Cuáles son las fuentes para el cultivo de organoides?
(1) Los organoides derivados de células madre pluripotentes incluyen células madre adultas (ASC), células madre pluripotentes (PSC) y células madre pluripotentes inducidas (iPSC). (2) Los organoides derivados de células extraídas de tejido se encuentran comúnmente en tejidos tumorales.
P: ¿Se puede utilizar tejido congelado para cultivo 3D en ausencia de tejido fresco?
Sí, pero existen requisitos más altos para el tamaño del tejido congelado, y la viabilidad del tejido y las células primarias congeladas disminuirá significativamente, lo que conducirá a una tasa de éxito muy reducida en los cultivos posteriores.
P: ¿Cómo se congelan y resucitan los organoides?
El momento óptimo para congelar los organoides es entre los pases 2 y 5, cuando la actividad y el potencial de diferenciación de los organoides están en su punto máximo. La reanimación de los organoides puede seguir los métodos utilizados para la reanimación celular.
P: ¿Es necesario controlar el tamaño de los organoides cultivados? ¿Es beneficioso si son demasiado grandes?
Sí, es necesario controlar el tamaño, preferiblemente dentro de los 500 μm, ya que los organoides carecen de sistemas vasculares internos y de circulación gas-líquido. Cuando el tamaño de los organoides es grande, las células cercanas al centro tienen dificultades para intercambiar oxígeno y nutrientes con el entorno externo. Por lo tanto, cuanto mayor sea la estructura, mayor será el número de células muertas.
P: Además de utilizar gel matriz, ¿qué más se puede utilizar para cultivar organoides?
Además del gel de matriz, las alternativas para cultivar organoides incluyen (1) matriz extracelular descelularizada y otras proteínas derivadas, (2) hidrogeles sintéticos y (3) geles de proteínas recombinantes diseñados.
P: ¿Cómo se puede lograr la diferenciación dirigida de organoides?
El desarrollo temprano de la diferenciación inducida por células madre en organoides está regulado conjuntamente por múltiples vías de señalización. El cultivo in vitro requiere la adición de factores de crecimiento para simular la actividad de estas vías de señalización, guiando a las células para que se diferencien en direcciones específicas. Por ejemplo, la inducción con Y27632 y Activina A puede diferenciar células madre embrionarias (ESC) o células madre pluripotentes inducidas (iPSC) en cuerpos embrionarios (EB). Posteriormente, las vías de señalización son reguladas por factores como Wnt3a, FGF-4 y Noggin para inducir la diferenciación de células madre en direcciones específicas.
P: ¿Cómo se puede evitar la contaminación al obtener muestras clínicas?
(1) Asegúrese de que la toma de muestras sea lo más aséptica posible. (2) Antes de la extracción, sumerja en PBS que contenga antibióticos durante varios minutos: para tumores ubicados en áreas con potencial contacto con el ambiente externo, como el estómago, los intestinos y la vejiga, se recomienda sumergir en PBS que contenga entre un 3% y un 5% de antibióticos durante 5 a 10 minutos; para otros tumores comunes, sumerja en PBS que contenga entre un 1% y un 2% de antibióticos durante aproximadamente 5 minutos. (3) Todos los reactivos utilizados durante la extracción celular deben contener un 1% de antibióticos y una concentración adecuada de antibióticos primarios.
P: ¿Qué precauciones se deben tomar para la recolección, conservación y transporte de tejidos tumorales?
Recolecte tantos tejidos tumorales con un alto contenido de células tumorales como sea posible y minimice el tiempo de exposición de las muestras de tejido al aire para reducir la probabilidad de contaminación. Coloque las muestras de tejido tumoral recolectadas en tubos estériles que contengan una solución especial para la conservación de muestras lo antes posible y transpórtelas rápidamente a la unidad de prueba a baja temperatura (alrededor de 4 °C) (esfuércese por entregarlas dentro de las 2 a 4 horas posteriores a la toma de la muestra).
P: ¿Existe alguna diferencia entre los organoides cultivados a partir de lesiones y aquellos cultivados a partir de tejidos adyacentes?
¿Cuáles son los requisitos para los sitios de muestreo de tejidos tumorales? Sí, hay una diferencia. Los tumores en sí mismos presentan heterogeneidad, por lo que es común observar diferencias entre organoides derivados de diferentes fuentes. Morfológicamente, los organoides derivados de lesiones primarias tienden a tener una estructura más invasiva en comparación con los de tejidos adyacentes, y generalmente parecen más irregulares. Para minimizar los errores en el modelado o la detección de drogas, se deben tomar múltiples muestras de áreas con buena actividad.
P: ¿Qué tipos de medicamentos se pueden utilizar para las pruebas de sensibilidad a medicamentos de los organoides tumorales?
Los principales tipos de fármacos antitumorales en la práctica clínica se pueden clasificar en tres categorías: fármacos citotóxicos (como paclitaxel, cisplatino/carboplatino, 5-FU, etc.), fármacos dirigidos (fármacos dirigidos a EGFR, HER2, VEGFR, etc.) y fármacos de inmunoterapia representados por inhibidores de puntos de control inmunitarios (anticuerpos PD-1, anticuerpos PD-L1, etc.).
P: ¿Cuál es la tasa de éxito del cultivo de PDO?
La tasa de éxito del cultivo de PDO varía ligeramente según la fuente. La mayoría de los PDO tienen una tasa de éxito de entre el 63% y el 70%, o incluso más alta, hasta el 90%, que se correlaciona en gran medida con la actividad del propio tejido. Además, los tratamientos clínicos pueden afectar la tasa de éxito. Las tasas de éxito se pueden mejorar reduciendo el tiempo de cultivo del tejido ex vivo y los pasos operativos.
P: ¿Se puede utilizar tejido congelado para el cultivo de organoides?
En general, no se recomienda la criopreservación de tejidos debido a la pérdida significativa de viabilidad. Sin embargo, si los tejidos se almacenan a -80 °C, el período óptimo para el cultivo de organoides es dentro de las 6 semanas posteriores a la conservación. Si los tejidos se almacenan en nitrógeno líquido, el tiempo de conservación puede ser más largo, pero preferiblemente no debe superar los seis meses.
P: Al extraer células primarias, normalmente hay fibroblastos mezclados. ¿Cómo se deben tratar?
(1) Debido a la poca adhesión de los fibroblastos, estos pueden eliminarse mediante adhesiones repetidas.(2) Se pueden utilizar reactivos de eliminación de fibroblastos, pero es necesario validar experimentalmente si afectan al cultivo de organoides.
P: ¿Cuánto tejido tumoral original se necesita para cultivar organoides tumorales? ¿Es suficiente la muestra de biopsia?
Generalmente, los tejidos quirúrgicos deben ser más grandes que 2 o 3 semillas de soja; si se obtienen mediante biopsia con aguja, se requieren al menos 2 o 3 muestras, mientras que las biopsias endoscópicas requieren que se pincen al menos seis o más tejidos tumorales.
P: Si la muestra de tejido tumoral es demasiado pequeña y la cantidad de organoides cultivados es insuficiente para las pruebas posteriores, ¿qué se debe hacer?
Dado que los organoides derivados de fuentes tumorales pueden presentar diferencias fenotípicas después del pase, generalmente no se recomienda realizarlo. En la literatura se recomienda limitar el pase de organoides a 2 o 3 generaciones, con un máximo de 5 generaciones. Si el número de células es demasiado pequeño y no puede cumplir con los requisitos de prueba después de 5 generaciones, considere cambiar el método de prueba, como usar una placa más pequeña de 384 pocillos o probar chips microfluídicos para la prueba.
P: ¿Habrá células normales en los tejidos tumorales? ¿Cómo eliminar estas células normales?
Puede haber una pequeña cantidad de células normales. En primer lugar, intente evitar tomar muestras de tejidos normales durante la recolección. En segundo lugar, después de extraer las células primarias, se puede utilizar la clasificación con perlas magnéticas o la citometría de flujo para el cultivo posterior de organoides. Cuando hay una cantidad muy pequeña de células normales, no afecta significativamente el modelado y el cultivo de organoides posteriores, por lo que puede que no sea necesaria la eliminación.
P: Al extraer células primarias de tejidos tumorales, ¿por qué las células aparecen de color rojo?
Los tejidos son ricos en sangre in vivo, por lo que hay muchos glóbulos rojos. En la mayoría de los casos, esto no requiere procesamiento y no afecta el cultivo de organoides. Si hay demasiados glóbulos rojos, se pueden tratar adecuadamente con un tampón de lisis antes del cultivo.
P: Durante el cultivo de organoides se encuentran partículas negras. ¿Cómo eliminarlas?
Las partículas negras son probablemente impurezas o restos celulares. Se pueden eliminar de dos formas:
Digerir los organoides y lavarlos repetidamente con medio para diluir las impurezas.
Utilice un bisturí quirúrgico esterilizado para cortar los organoides por la mitad, luego utilice una jeringa de 1 ml llena de medio para eliminar suavemente las impurezas de los organoides.
P: ¿Existe un límite en la cantidad de pasajes para el cultivo de organoides y cuántos pasajes se pueden realizar?
El número de pases depende generalmente de las propiedades de las células de origen. La mayoría de los organoides pueden ser pasados in vitro hasta 10 veces (>6 meses). La elección de las condiciones de cultivo también puede tener cierta influencia, siendo el medio acondicionado generalmente superior al medio de factor sintético.
P: ¿Es posible cultivar líneas de células tumorales (como la línea celular HepG2) en PDO?
Los PDO son estructuras autoensambladas complejas. Los sistemas de cultivo tridimensionales formados por líneas celulares individuales no pueden llamarse PDO; simplemente se los denomina estados esféricos tridimensionales.
P: ¿Cuáles son los criterios para el paso de organoides?
Dependiendo del estado de desarrollo de los organoides, el tiempo varía, generalmente entre 5 y 10 días, con un diámetro de aproximadamente 100-200 μm. Algunos organoides de desarrollo lento pueden tardar varias semanas en alcanzar un estado adecuado para el pasaje.
P: ¿Cómo contar el número de organoides viables?
Durante el experimento, extraiga la solución de almacenamiento de calceína-AM previamente preparada y agregue la solución de calceína-AM al medio hasta una concentración final de 0,2 μmol/L. Incube a 37 °C durante 60 minutos. Una vez transcurrido el tiempo, lave lentamente el medio que contiene calceína-AM con PBS y agregue medio nuevo. Utilice un microscopio de fluorescencia con una longitud de onda de excitación de 490 nm y una longitud de onda de emisión de 515 nm para observar y fotografiar los organoides. Los organoides vivos aparecerán verdes y tendrán bordes claros. Cuente los organoides con un diámetro >20 μm.
P: ¿Cómo calcular la viabilidad de los organoides?
La viabilidad de los organoides se calcula según la fórmula: X=(Nvivos/Ntotal)×100%, donde: X representa la viabilidad de los organoides; Nvivos representa el número de organoides vivos; Ntotal representa el número total de organoides.
P: ¿Cuáles son los métodos para identificar organoides?
El método más básico consiste en observar la morfología de los organoides a través de un microscopio y realizar una tinción con H&E. Otros métodos incluyen Western Blot, qRT-PCR, inmunofluorescencia y citometría de flujo para detectar si los organoides expresan los biomarcadores correspondientes. La secuenciación genética puede identificar la coincidencia genética entre los organoides cultivados y el tejido de origen. En el caso de algunos organoides, se pueden realizar pruebas funcionales para ver si poseen funciones específicas. Por ejemplo, los estudios han demostrado que los organoides gástricos pueden secretar ácido gástrico y los organoides cardíacos pueden latir de forma autónoma.
P: ¿Las células normales también pueden convertirse en organoides? ¿Cómo eliminar organoides normales durante el cultivo de organoides tumorales?
Las células normales también pueden convertirse en organoides. Los métodos para eliminar organoides normales incluyen: (1) selección manual basada en los resultados de la tinción HE bajo un microscopio; (2) purificación de los PDO ajustando la composición del medio de cultivo (como factores de crecimiento/inhibidores de moléculas pequeñas); (3) dispersión de los PDO en células individuales para citometría de flujo o clasificación con perlas magnéticas.
P: Durante los experimentos de sensibilidad a medicamentos, ¿deben digerirse los PDO del gel matriz?
No, los PDO necesitan una estructura tridimensional para simular las condiciones in vivo. Si no hay soporte del gel matriz, la precisión de los experimentos de sensibilidad a los fármacos se verá afectada. Por lo general, los fármacos solubles pueden penetrar el gel matriz para actuar sobre los organoides, pero cuando se realizan experimentos inmunocitoquímicos, es necesario retirar el gel matriz.
P: ¿Pueden los experimentos con PDO reemplazar completamente a los modelos animales (PDX)?
Los PDO pueden reemplazar parcialmente a los PDX, pero no pueden reemplazarlos por completo.
P: ¿Cuáles podrían ser las razones del crecimiento anormal de las PDO durante el cultivo, caracterizado por ciclos de crecimiento más acortados y una rápida proliferación en comparación con las condiciones anteriores?
Factores externos: (1) Esta anomalía puede ser causada por el crecimiento extensivo de ciertas células contaminantes, como fibroblastos. En tales casos, se recomienda realizar tinción y observación de secciones para confirmar la presencia de estas células contaminadas y luego proceder a eliminarlas. (2) Los cambios en las condiciones de cultivo, incluida la adición de ciertos factores o moléculas pequeñas, pueden activar aún más las vías de proliferación de las PDO.
Factores internos: Posibles mutaciones genéticas. Para comprobarlo, se recomienda realizar una secuenciación y comparar los resultados con los de las PDO primarias para determinar si existen mutaciones genéticas.
P: ¿Cómo se puede probar la sensibilidad de los PDO a los medicamentos?
Los PDO pueden analizarse para determinar su sensibilidad a los fármacos mediante métodos como el ensayo CCK8, el ensayo de viabilidad celular ATP y la tinción de células vivas/muertas. La evaluación de la actividad ATP de los organoides tumorales es el método más común. El ATP es la molécula energética más importante de las células y puede utilizarse para medir los niveles metabólicos celulares, lo que refleja la cantidad de células viables. En función del efecto de la administración del fármaco en el contenido celular de ATP, se puede calcular el valor IC50 (la mitad de la concentración inhibitoria máxima del fármaco analizado) para cada régimen farmacológico mediante un software de análisis para seleccionar los fármacos más eficaces para la inhibición tumoral.
P: ¿Los rangos de concentración para los experimentos de sensibilidad a medicamentos de PDO son los mismos que los de las células tumorales primarias?
No, no son lo mismo. Normalmente, la concentración del fármaco para las PDO debe ser mayor que la de las células primarias. Se pueden realizar experimentos preliminares para analizar las concentraciones óptimas para los experimentos formales de sensibilidad a los fármacos.
P: ¿En qué etapa del crecimiento se deben utilizar los organoides para las pruebas de drogas?
En general, se recomienda utilizar organoides en cinco pasos para la prueba de detección de drogas. En esta etapa, los organoides muestran la mejor estabilidad y actividad.
P: ¿Cuáles son los criterios para determinar el éxito del establecimiento de organoides?
(1) Evaluación preliminar temprana: la morfología de los organoides cambia de un estado celular a formas como vacuolar, en gemación, compacta o suelta. (2) Identificación de la expresión de biomarcadores específicos, que deben ser similares a la distribución en cortes de tejido. Se pueden realizar análisis de secuenciación adicionales para realizar comparaciones más detalladas.
P: ¿En qué se diferencia el cultivo de organoides del cultivo de células normal?
(1) Diferentes métodos de cultivo celular: Los organoides requieren el soporte de sustratos o estructuras espaciales para mantener su estructura tridimensional, mientras que el cultivo celular regular no lo requiere. (2) El cultivo de organoides requiere lograr la diferenciación y el autoensamblaje ex vivo, por lo que requiere el uso de combinaciones de varias citocinas para la inducción, lo que da como resultado componentes de medio de cultivo relativamente complejos. El cultivo celular regular generalmente involucra solo un único tipo de célula, por lo que los componentes del medio de cultivo son relativamente simples.(3) Diferentes fuentes de células: los organoides se derivan de células epiteliales multipotentes, mientras que el cultivo celular regular es adecuado para cultivar varios tipos de células seleccionadas.
P: ¿Cómo puedo determinar si las esferas 3D que cultivé son organoides y si son consistentes con el tejido objetivo?
Los métodos para identificar organoides incluyen tinción con H&E, inmunohistoquímica (IHC), secuenciación de células individuales y otros. Es necesario realizar juicios multidimensionales desde perspectivas morfológicas, histopatológicas y genéticas moleculares para determinar si son consistentes con el órgano o tejido diana. En el caso de organoides tumorales, se puede utilizar la detección de biomarcadores específicos para la confirmación.
P: Si la morfología de los organoides observados durante el cultivo difiere de lo reportado en la literatura, ¿cuál podría ser la razón?
En primer lugar, pueden existir diferencias individuales y heterogeneidad en las fuentes y subtipos de muestras. En segundo lugar, las diferencias en la calidad de determinadas citocinas y algunos inhibidores de moléculas pequeñas utilizados para la inducción pueden dar lugar a variaciones en la morfología de diferenciación de diferentes organoides. Se sugiere confirmar la coherencia entre la morfología de los organoides y el tejido de origen mediante métodos como la tinción HE, la inmunohistoquímica y la secuenciación genética, en lugar de basarse únicamente en las descripciones bibliográficas.
P: Al realizar experimentos de sensibilidad a medicamentos con organoides, ¿es necesario controlar la cantidad de DMSO utilizada como disolvente para los medicamentos?
Sí, normalmente los experimentos de sensibilidad a los medicamentos requieren que el porcentaje de volumen de DMSO sea inferior al 0,5%.
P: ¿Cómo se pueden recuperar los organoides del gel matriz?
Se recomiendan los siguientes métodos: (1) Se pueden utilizar soluciones de recuperación de organoides disponibles comercialmente (CAT#41421ES) para obtener suspensiones celulares de manera suave y eficaz sin dañar las células ni las proteínas de la superficie celular. (2) El gel matriz se puede descongelar a baja temperatura para ablandarlo y liberar los organoides.
P: Muchos organoides se adhieren a las paredes del tubo de centrífuga durante la recuperación. ¿Cómo se puede mejorar la tasa de recuperación?
Al centrifugar después de la recolección, utilice una centrífuga de rotor horizontal y aumente la velocidad de centrifugación según corresponda. Por lo general, es adecuada una fuerza centrífuga de aproximadamente 300 g y una velocidad de aproximadamente 1000-1200 rpm.
Citocinas relacionadas información
| PAGproducto norteamo | GATO | Tamaño |
| Wnt-3a humano | 92276ES10 | 10micrasgramo |
| 92278ES20 | 20micrasgramo | |
| 92701ES10 | 10micrasgramo | |
| Cabeza humana | 92528ES10 | 10micrasgramo |
| 91330ES10 | 10micrasgramo | |
| 91306ES10 | 10micrasgramo | |
| 91502ES10 | 10micrasgramo | |
| 91701ES08 | 10micrasgramo | |
| 92602ES60 | 100micrasgramo | |
| 91204ES10 | 10micrasgramo | |
| 90601ES10 | 10micrasgramo | |
| 91113ES10 | 10micrasgramo | |
| 92279ES10 | 10micrasgramo | |
| 92055ES10 | 10micrasgramo | |
| 92053ES10 | 10micrasgramo | |
| 92129ES08 | 5micrasgramo | |
| 91304ES10 | 10micrasgramo | |
| 91702ES10 | 10micrasgramo | |
| 92252ES60 | 100micrasgramo | |
| 90103ES10 | 10micrasgramo | |
| 90104ES10 | 10micrasgramo | |
| 90197ES10 | 10micrasgramo | |
| 90144ES08 | 10micrasgramo | |
| 90196ES10 | 10micrasgramo | |
| 90194ES10 | 10micrasgramo | |
| 90111ES10 | 10micrasgramo | |
| 90120ES10 | 10micrasgramo | |
| 90198ES10 | 10micrasgramo | |
| 91605ES10 | 10micrasgramo | |
| 92251ES10 | 10micrasgramo | |
| 92566ES08 | 5micrasgramo | |
| 92102ES10 | 10micrasgramo | |
| 91103ES10 | 10micrasgramo | |
| 92711ES10 | 10micrasgramo | |
| 92122ES60 | 100micrasgramo | |
| 92201ES60 | 100micrasgramo | |
| 92275ES20 | 20micrasgramo | |
| BMP-2 humana | 92051ES10 | 10micrasgramo |
Lectura relacionada:
Referencia
