La terapia cellulare si riferisce all'uso di metodi biotecnologici per ottenere cellule con funzioni specifiche, che vengono poi potenziate attraverso processi quali l'espansione ex vivo e la coltivazione specializzata. Queste cellule sono dotate di risposte immunitarie aumentate, capacità di uccidere patogeni e cellule tumorali e altre funzioni per raggiungere gli obiettivi terapeutici per determinate malattie. La terapia genica si riferisce all'approccio terapeutico di modifica dell'espressione genica individuale o di riparazione di geni difettosi attraverso metodi quali l'aggiunta di geni, la modifica di geni e il silenziamento genico. L'obiettivo finale è curare le malattie rettificando i geni anomali.
| Prodotto Tipi | Descrizione | Numero Di Approvato Droghe In tutto il mondo |
| Gene Terapia Vettore Prodotti | Questi prodotti utilizzare gene terapia vettori A consegnare terapeutico geni A specifico cellule In IL del paziente tessuti, mirando per IL espressione O regolamento Di terapeutico proteine. Questo categoria si affida SU IL consegna Di gene terapia vettori. | 2 |
| Cellulare Prodotti | Utilizzando Integrando virale vettori (come COME lentivirale vettori), geni Sono introdotto in precursore cellule O stelo cella genomi Sotto ex vivo condizioni. COME cellule dividere, IL geni Sono passato A discendente cellule. IL modificato cellule Sono Poi infuso Indietro in IL paziente. Cellulare prodotti principalmente includere categorie come COME T cellule, Corea del Nord cellule, E stelo cellule. | 8 |
| Oncolico Virus Prodotti | Derivato da modificato oncolico virus con che uccide i tumori capacità, questi prodotti lavoro SU IL principio Di utilizzando IL virus specifico riconoscimento Di tumore cellule E IL immune attivazione innescato su infettante tumore cellule. Questo conduce A mirato uccidere Di tumore cellule. | 1 |
Soluzione per la produzione e l'espressione di vettori virali
Il fulcro della produzione di farmaci per la terapia genica e cellulare (CGT) risiede nell'espressione di vettori virali, un processo che in genere coinvolge sia l'espressione del vettore a monte che la purificazione a valle. La produzione di vettori comporta processi altamente complessi, presenta sfide significative e spesso ha lunghi cicli di preparazione. Di conseguenza, la capacità di produzione GMP globale per i vettori virali si sta avvicinando a un collo di bottiglia, ponendo un ostacolo importante allo sviluppo dell'intero settore della terapia genica. Lo sviluppo, l'aumento di scala e la produzione GMP di vettori per la terapia genica implicano sistemi di produzione complessi e rigorosi sistemi di controllo della qualità. Questi comprendono processi come l'istituzione di banche di ceppi, cellule e virus, E.fermentazione di coli, processi di coltura cellulare, processi di raccolta e purificazione dei virus, lavorazione asettica e processi di formulazione e riempimento.
 Costi di produzione AAV
Costi di produzione AAV
Oltre agli investimenti in beni fissi (come attrezzature, camere bianche, ecc.) e costi di manodopera, le spese principali derivano dal consumo di materiali nei processi upstream e downstream. I costi upstream riguardano principalmente materie prime come plasmidi, terreni di coltura, reagenti di trasfezione e nucleasi; i costi downstream includono principalmente resine cromatografiche, spese di controllo qualità e altro ancora.
Supporto polimero cationico
I polimeri cationici (polimeri) includono polietilenimmina (PEI), poli(beta-ammino estere) (PBAE), chitosano, poliacrilammide (PAH), dietilamminoetil destrano (DEAE-destrano), poli(ammidoammina) dendrimeri (PAMAM) e altri. Il principio comune della trasfezione dei polimeri cationici prevede la complessazione del DNA in condizioni di pH fisiologico per impedire la degradazione da parte della DNasi. Successivamente, questi complessi si attaccano alla membrana cellulare e vengono assorbiti per endocitosi, seguiti dalla rottura e dal rilascio del DNA nel citoplasma per esercitare le loro funzioni previste. La distinzione principale tra polimeri cationici e lipidi cationici risiede nell'assenza di porzioni idrofobiche nei polimeri cationici, rendendoli completamente solubili in acqua e consentendo comode modifiche chimiche.
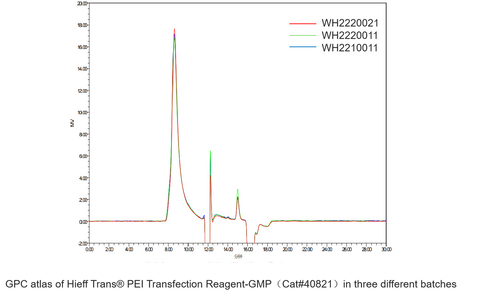
Reagenti di trasfezione Hieff Trans® PEI

| Test Articolo | Standard | Ricerca e sviluppo Grado (40820) | GMP Grado (40821) |
| UNaspetto | Completare, accurato informazioni, NO danno, ecc. | √ | √ |
| Trasfezione eefficienza | > 70% Trasfezione efficienza> 80% Cella fattibilità | √ | √ |
| Endotossina | < 0,5 UE/mL | √ | √ |
| STeralità | Asettico crescita | √ | √ |
| Micoplasma Residui | Nnegativo | √ | √ |
| pH | < 7.0 | √ | |
| Osmotico PRessere sicuro | ≤ 30 mOsm/kg | √ | |
| Impurità Residuo | Metanolo(≤ 0.3%) Etilico etere(≤ 0,5%) Metilbenzene(≤ 0,002%) | √ | |
| Pesante Megualmente Residuo | ≤ 10 parti per milione |
| √ |
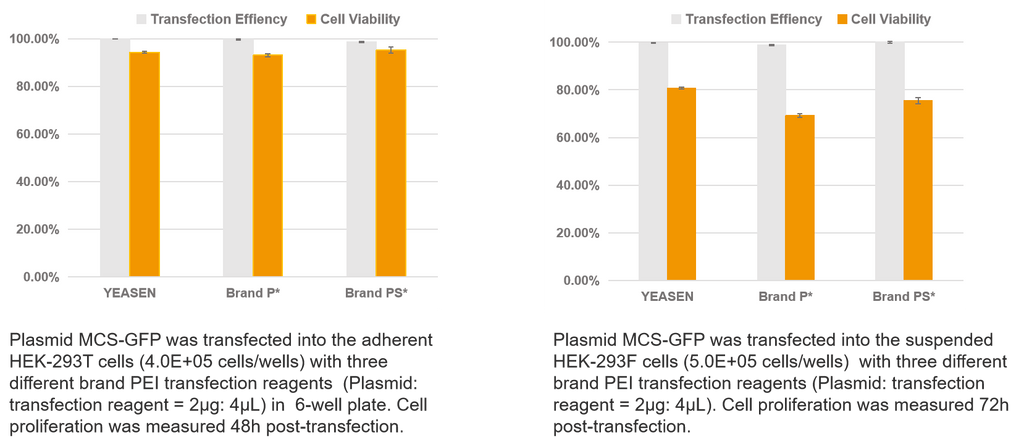
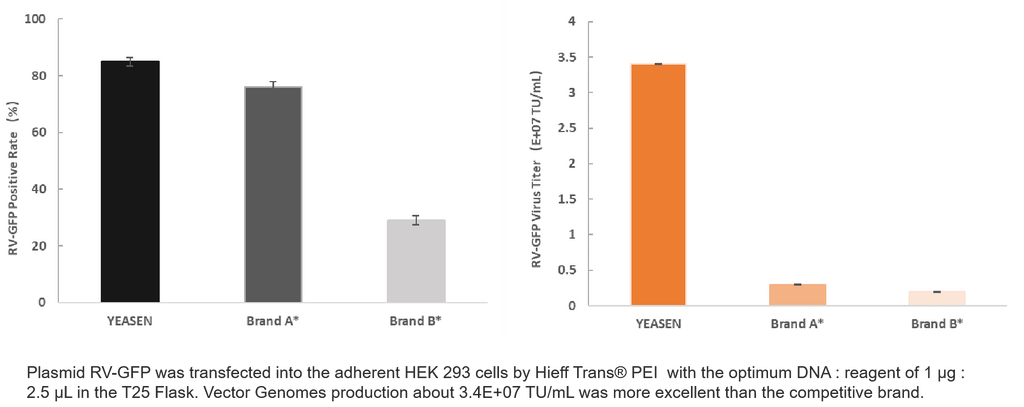
Trasfezione di un singolo plasmide
Dati sul titolo del virus
1. Produzione LV

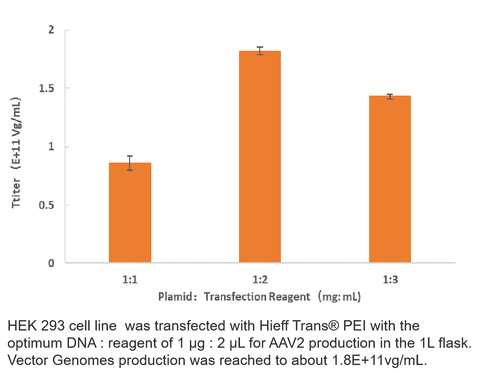
2. Produzione AAV2
3. Produzione AAV5
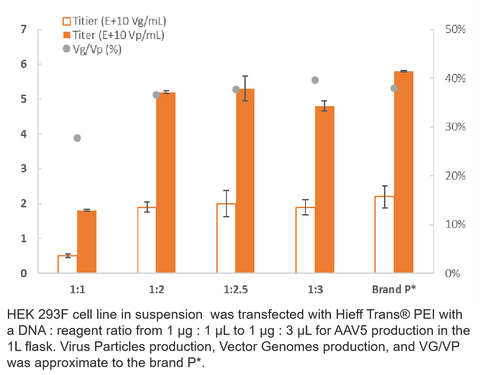
4. Produzione di camper
Informazioni sul prodotto
| Nome del prodotto | Numero di gatto. |
| Reagente di trasfezione PEI Hieff Trans®-GMP | 40821ES |
| Kit di rilevamento dei residui di DNA delle cellule ospiti di E. coli | 41308ES |
| Kit di rilevamento dei residui di RNA delle cellule ospiti di E. coli | 41318ES |
| Kit ELISA E.coli HCP | 36712ES |
| Kit ELISA HEK293 HCP | 36713ES |
| Kit di rilevamento dei residui di DNA delle cellule ospiti HEK293 | 41302ES |
| Kit di analisi delle dimensioni del DNA residuo della cellula ospite HEK293 | 41316ES |
| Kit di rilevamento qPCR in tempo reale del micoplasma MycAway™ (2G) | 40619ES |
| UCF.ME® UltraNuclease di grado GMP | 20157ES |
| Ultranucleasi attiva al sale di grado GMP | 20159ES |
| Kit ELISA UltraNuclease | 36701ES |
| Kit ELISA UltraNucleasi attiva al sale | 36703ES |
| Kit di rilevamento del numero di copie RCA (E1A) | 41321ES |
| Kit di rilevamento del lentivirus replicativo competente (RCL) | 41311ES |
| Kit di preparazione del campione di DNA residuo magnetico MolPure™ | 18461ES |
