Terapia celular refere-se ao uso de métodos de biotecnologia para obter células com funções específicas, que são então aprimoradas por meio de processos como expansão ex vivo e cultivo especializado. Essas células são dotadas de respostas imunológicas aumentadas, capacidades de matar células tumorais e patogênicas e outras funções para atingir os objetivos terapêuticos para certas doenças. Terapia genética refere-se à abordagem terapêutica de modificar a expressão gênica individual ou reparar genes defeituosos por meio de métodos como adição de genes, modificação genética e silenciamento genético. O objetivo final é curar doenças retificando genes anormais.
| Produto Tipos | Descrição | Número de Aprovado Drogas Mundialmente |
| Gene Terapia Vetor Produtos | Esses produtos utilizar gene terapia vetores para entregar terapêutico genes para específico células em o do paciente tecidos, mirando para o expressão ou regulamento de terapêutico proteínas. Esse categoria confia sobre o entrega de gene terapia vetores. | 2 |
| Celular Produtos | Usando integrando viral vetores (tal como lentiviral vetores), genes são introduzido em precursor células ou tronco célula genomas sob ex vivo condições. Como células dividir, o genes são passou para descendente células. O modificado células são então infundido voltar em o paciente. Celular produtos principalmente incluir categorias tal como E células, NK células, e tronco células. | 8 |
| Oncolítico Vírus Produtos | Derivado de modificado oncolítico vírus com matador de tumores capacidades, esses produtos trabalhar sobre o princípio de utilizando o vírus específico reconhecimento de tumor células e o imune ativação provocado sobre infectando tumor células. Esse pistas para alvo matando de tumor células. | 1 |
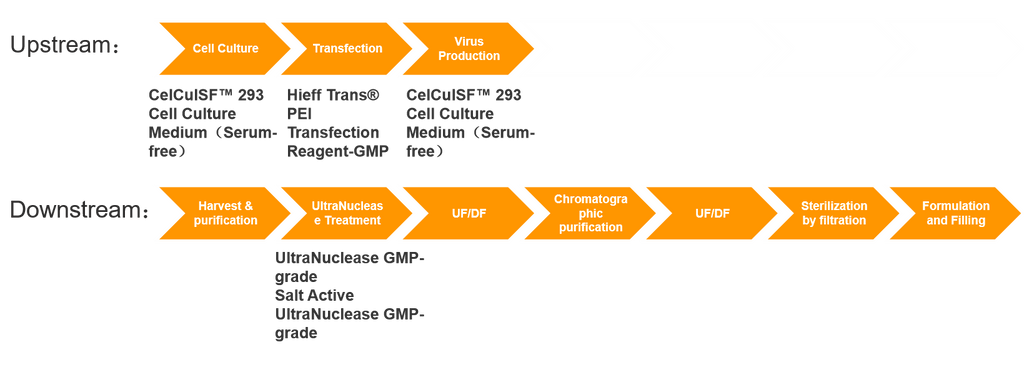
Solução de produção e expressão de vetores virais
O cerne da produção de medicamentos de Terapia Celular e Gênica (CGT) está na expressão de vetores virais, um processo que normalmente envolve tanto a expressão do vetor upstream quanto a purificação downstream. A produção de vetores envolve processos altamente complexos, apresenta desafios significativos e frequentemente tem longos ciclos de preparação. Consequentemente, a capacidade global de produção de GMP para vetores virais está se aproximando de um gargalo, representando um grande obstáculo para o desenvolvimento de toda a indústria de terapia genética. O desenvolvimento, a ampliação e a produção de GMP de vetores de terapia genética envolvem sistemas de produção intrincados e sistemas de controle de qualidade rigorosos. Isso abrange processos como estabelecimento de bancos de cepas, células e vírus, E.fermentação de coli, processos de cultura de células, processos de coleta e purificação de vírus, processamento asséptico e processos de formulação e envase.
 Custos de produção de AAV
Custos de produção de AAV
Além dos investimentos em ativos fixos (como equipamentos, salas limpas, etc.) e custos de mão de obra, as principais despesas surgem do consumo de material nos processos upstream e downstream. Os custos upstream envolvem principalmente matérias-primas como plasmídeos, meios de cultura, reagentes de transfecção e nucleases; os custos downstream incluem principalmente resinas de cromatografia, despesas de controle de qualidade e muito mais.
Transportador de polímero catiônico
Polímeros catiônicos (polímeros) incluem polietilenimina (PEI), poli(beta-amino éster) (PBAE), quitosana, poliacrilamida (PAH), dietilaminoetil dextrano (DEAE-dextrano), dendrímeros de poli(amidoamina) (PAMAM) e outros. O princípio comum da transfecção de polímeros catiônicos envolve a complexação de DNA sob condições fisiológicas de pH para evitar a degradação pela DNase. Posteriormente, esses complexos se ligam à membrana celular e são absorvidos por endocitose, seguidos pela ruptura e liberação de DNA no citoplasma para exercer suas funções pretendidas. A principal distinção entre polímeros catiônicos e lipídios catiônicos reside na ausência de porções hidrofóbicas em polímeros catiônicos, tornando-os completamente solúveis em água e permitindo modificações químicas convenientes.
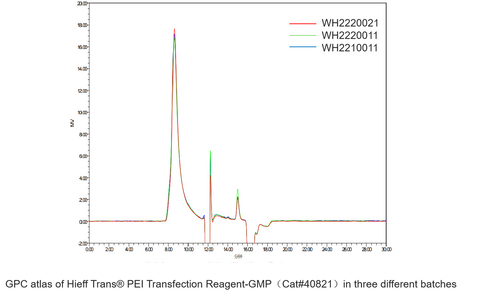
Reagentes de transfecção Hieff Trans® PEI

| Teste Item | Padrão | P&D Nota (40820) | BPF Nota (40821) |
| UMaparência | Completo, preciso Informação, não dano, etc | √ | √ |
| Transfecção eeficiência | > 70% Transfecção eficiência> 80% Célula viabilidade | √ | √ |
| Endotoxina | < 0,5 UE/mL | √ | √ |
| Sterilidade | Asséptico crescimento | √ | √ |
| Micoplasma Resíduo | Nãonegativo | √ | √ |
| pH | < 7.0 | √ | |
| Osmótico Prcerteza | ≤ 30 mOsm/kg | √ | |
| Impureza Rresíduo | Metanol(≤ 0.3%) Etilo éter(≤ 0,5%) Metilbenzeno(≤ 0,002%) | √ | |
| Pesado Metal Rresíduo | ≤ 10 ppm |
| √ |
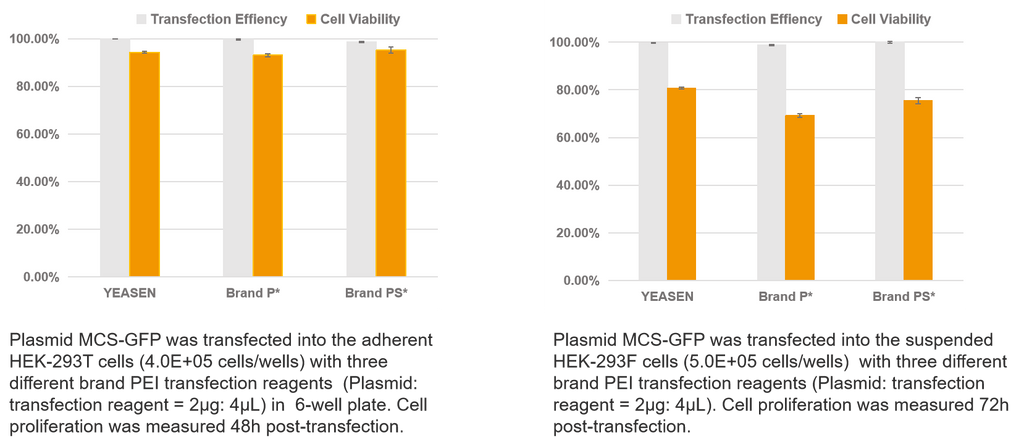
Transfecção de plasmídeo único
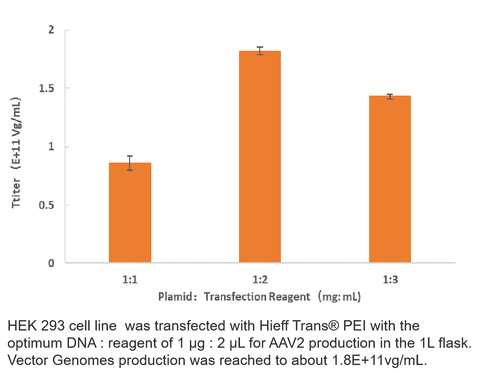
Dados de título de vírus
1. Produção LV

2. Produção AAV2
3. Produção AAV5
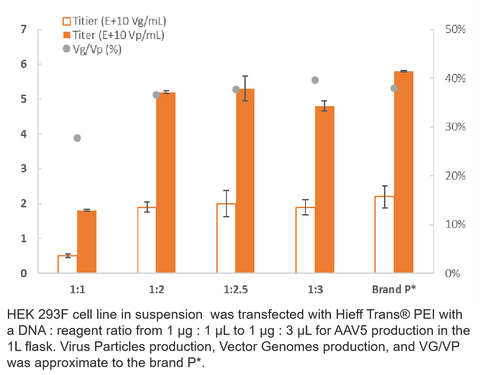
4. Produção de RV
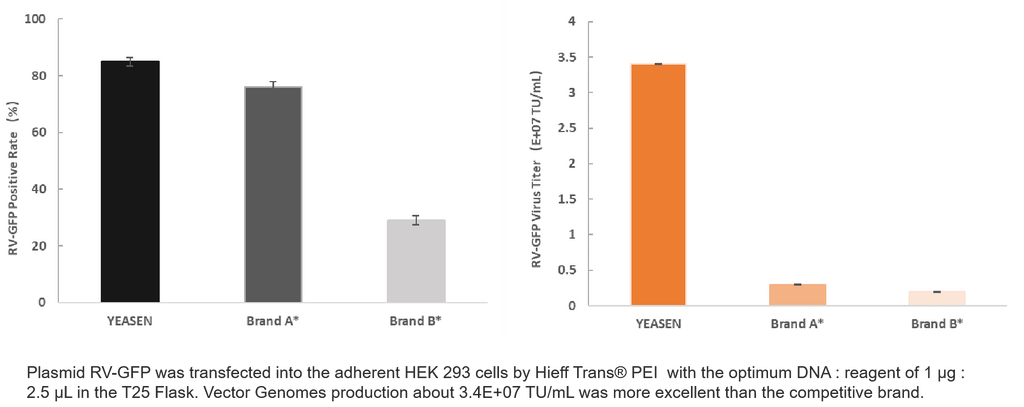
Informações do produto
| Nome do produto | Cat No. |
| Hieff Trans® PEI Reagente de Transfecção-GMP | 40821ES |
| Kit de detecção de resíduos de DNA de células hospedeiras de E. coli | 41308ES |
| Kit de detecção de resíduos de RNA de células hospedeiras de E. coli | 41318ES |
| Kit ELISA E. coli HCP | 36712ES |
| Kit ELISA HEK293 HCP | 36713ES |
| Kit de detecção de resíduos de DNA de células hospedeiras HEK293 | 41302ES |
| Kit de análise de tamanho de DNA de resíduo de célula hospedeira HEK293 | 41316ES |
| Kit de detecção de qPCR em tempo real de micoplasma MycAway™ (2G) | 40619ES |
| UCF.ME® UltraNuclease grau GMP | 20157ES |
| UltraNuclease ativo de sal de grau GMP | 20159ES |
| Kit ELISA UltraNuclease | 36701ES |
| Kit ELISA UltraNuclease Ativo Salino | 36703ES |
| Kit de detecção de número de cópias RCA (E1A) | 41321ES |
| Kit de detecção de lentivírus competente para replicação (RCL) | 41311ES |
| Kit de preparação de amostra de DNA residual magnético MolPure™ | 18461ES |
