HCD/HCP

高敏性,FG级,残留DNA检测试剂盒,用于生物产品的质量控制
概述 宿主细胞残留DNA是生物制品生产过程中产生的工艺相关杂质,不仅会降低生物制品的疗效,还可能带来感染性、致瘤性等安全隐患,因此各国监管机构均对生物制品中残留DNA的含量作出了限制。 目前WHO和FDA的指导原则均建议成品中残留DNA不超过10ng/剂,FDA也规定生物制品宿主细胞DNA...
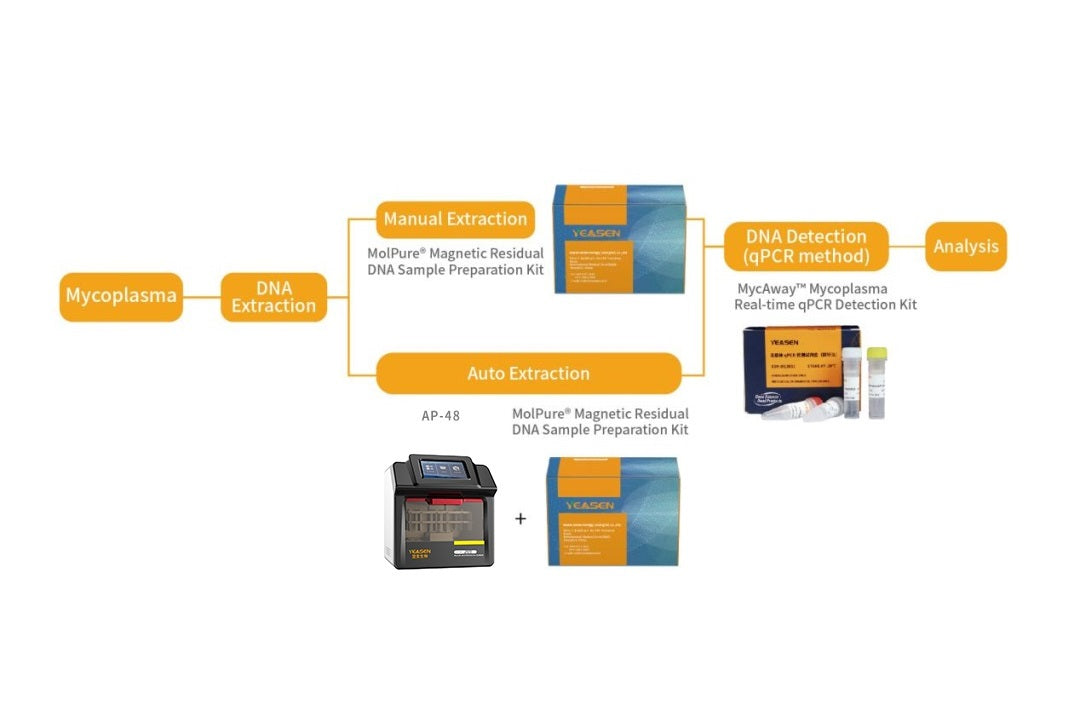
Mycaway支原体实时QPCR检测套件(2G)验证报告
背景 本报告中总结的数据由 Yeasen 生物技术(上海)有限公司(MycAway)商标 支原体实时荧光定量PCR检测试剂盒(2G) 产品。 汇总数据仅供用户参考,用户需要使用自己的样本验证支原体方法,以确认该方法可以满足用户的要求。建议所有使用该试剂盒的实验室验证...
CHO宿主细胞DNA残基检测试剂盒(3G)验证报告
胆固醇 宿主细胞DNA残留检测试剂盒 (3)格) 资格概要(编号: 41332ES60) 背景 本报告中总结的数据由 Yeasen CHO 生物技术 宿主细胞DNA残留检测试剂盒(3G)产品。摘要数据仅供用户参考,用户需自行验证宿主细胞残留 DNA方法通过使用自己的样本来...
HEK293宿主细胞DNA残基检测试剂盒(3G)验证报告
HEK293 宿主细胞DNA残留检测试剂盒 (3)格) 资格概要(类别编号:41331ES60) 背景 本报告中总结的数据由 Yeasen 'HEK293 的生物技术 宿主细胞DNA残留检测试剂盒(3G)' 产品。汇总数据仅供用户参考,用户需自行验证宿主细...
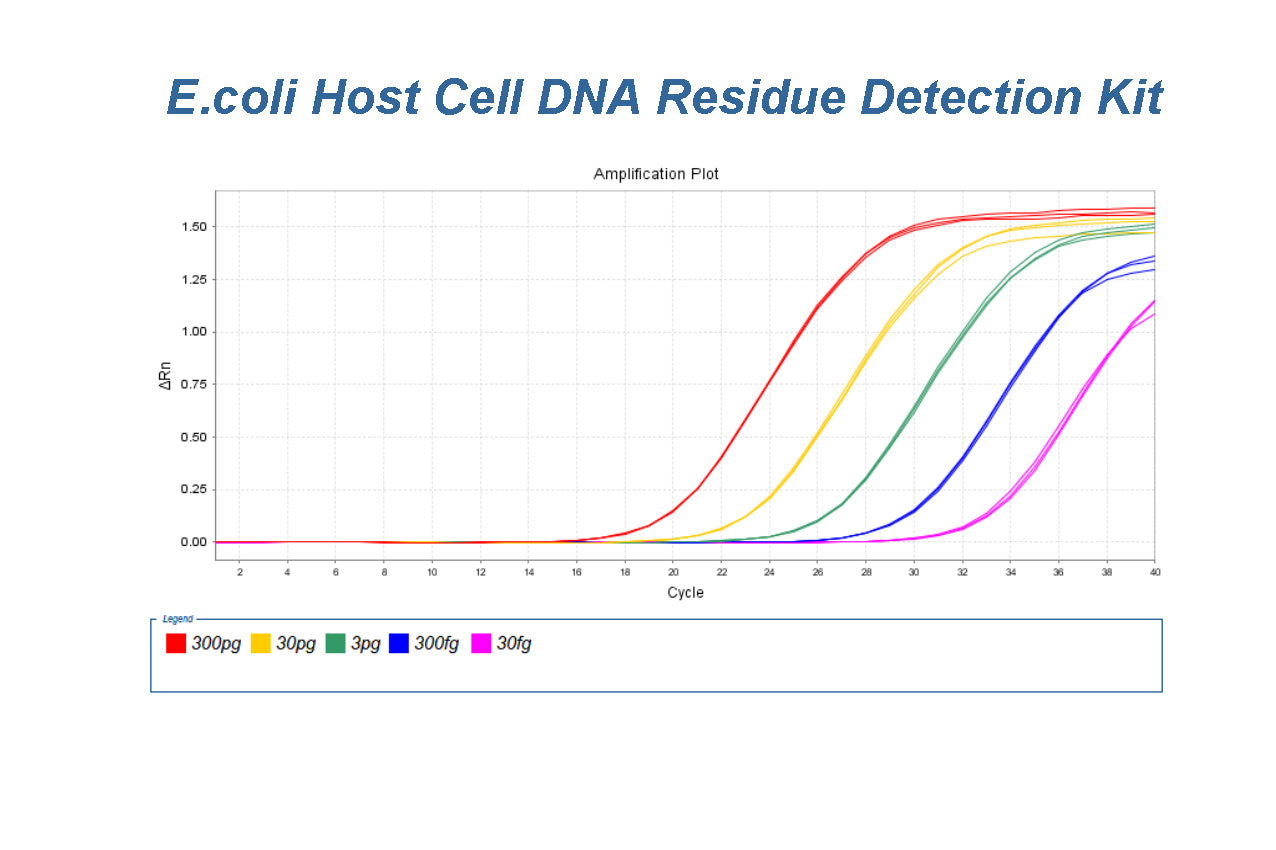
大肠杆菌宿主细胞DNA残基检测试剂盒(2G)验证报告
大肠杆菌 宿主细胞DNA残留检测试剂盒 (2G) 资格概要(类别编号:41308ES60) 背景 本报告中总结的数据由 Yeasen 生物技术针对“大肠杆菌宿主细胞DNA残留检测试剂盒(2G)”产品。摘要数据仅供用户参考,用户需自行验证宿主细胞残留 DNA方法通过使用自己...

分枝杆菌QPCR检测和方法验证有助于细胞和基因治疗技术开发的发展
近年来,随着生物医药的快速发展,新冠疫情下细胞和基因治疗的兴起,以及mRNA疫苗的问世,确保生物制品的安全性和可靠性已成为各国政府和监管机构关注的焦点。支原体污染是一种常见但通常难以消除的污染类型。监管要求在涉及细胞培养的生物过程中“确保无支原体污染”。 监管机构对支原体检测的要求: ...

宿主细胞残留DNA检测试剂盒有助于生物制剂和制造
宿主细胞残留DNA是生物制品生产过程中产生的工艺相关杂质,不仅会降低生物制品的疗效,还可能带来感染性、致瘤性等安全隐患,因此各国监管机构均对生物制品中残留DNA的含量作出了限制。 目前WHO和美国FDA的指导原则均建议成品中残留DNA不得高于10ng/剂,美国FDA也指出生物制品宿主细胞中残留...

