La terapia celular se refiere al uso de métodos biotecnológicos para obtener células con funciones específicas, que luego se mejoran mediante procesos como la expansión ex vivo y el cultivo especializado. Estas células están dotadas de respuestas inmunitarias aumentadas, capacidades para matar patógenos y células tumorales y otras funciones para lograr los objetivos terapéuticos de ciertas enfermedades. La terapia génica se refiere al enfoque terapéutico de modificar la expresión de genes individuales o reparar genes defectuosos mediante métodos como la adición de genes, la modificación de genes y el silenciamiento de genes. El objetivo final es curar enfermedades rectificando genes anormales.
| Producto Tipos | Descripción | Número de Aprobado Drogas Mundial |
| Gene Terapia Vector Productos | Estos productos utilizar gene terapia Vectores a entregar terapéutico genes a específico células en el del paciente tejidos, puntería para el expresión o regulación de terapéutico Proteínas. Este categoría se basa en el entrega de gene terapia Vectores. | 2 |
| Celular Productos | Usando integrando viral Vectores (semejante como lentiviral vectores), genes son introducido en precursor células o provenir celúla genomas bajo ex vivo condiciones. Como células dividir, el genes son aprobado a descendiente células. El modificado células son entonces infundido atrás en el paciente. Celular productos principalmente incluir Categorías semejante como yo células, NK células, y provenir células. | 8 |
| Oncolítico Virus Productos | Derivado de modificado oncolítico virus con Matar tumores capacidades, estos productos trabajar en el principio de Utilizando el virus específico reconocimiento de tumor células y el inmune activación motivado al Infectando tumor células. Este dirige a Dirigido asesinato de tumor células. | 1 |
Solución para la producción y expresión de vectores virales
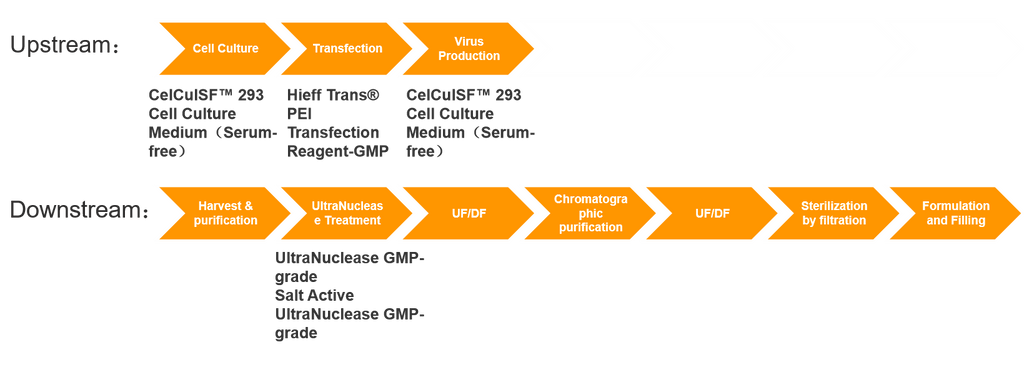
El núcleo de la producción de fármacos de terapia celular y génica (TCG) reside en la expresión de vectores virales, un proceso que normalmente implica tanto la expresión del vector en sentido ascendente como la purificación en sentido descendente. La producción de vectores implica procesos muy complejos, presenta desafíos significativos y, a menudo, tiene ciclos de preparación largos. En consecuencia, la capacidad de producción global de GMP para vectores virales se está acercando a un cuello de botella, lo que plantea un obstáculo importante para el desarrollo de toda la industria de la terapia génica. El desarrollo, la ampliación y la producción de GMP de vectores de terapia génica implican sistemas de producción intrincados y sistemas de control de calidad estrictos. Estos abarcan procesos como el establecimiento de bancos de cepas, células y virus, la producción a gran escala de E. coli.fermentación de coli, procesos de cultivo celular, procesos de recolección y purificación de virus, procesamiento aséptico y procesos de formulación y llenado.
 Costos de producción de AAV
Costos de producción de AAV
Aparte de las inversiones en activos fijos (como equipos, salas blancas, etc.) y los costos de mano de obra, los principales gastos surgen del consumo de materiales en los procesos anteriores y posteriores. Los costos anteriores involucran principalmente materias primas como plásmidos, medios de cultivo, reactivos de transfección y nucleasas; los costos posteriores incluyen principalmente resinas de cromatografía, gastos de control de calidad y más.
Portador de polímero catiónico
Los polímeros catiónicos (polímeros) incluyen polietilenimina (PEI), poli(beta-amino éster) (PBAE), quitosano, poliacrilamida (PAH), dietilaminoetil dextrano (DEAE-dextrano), dendrímeros de poli(amidoamina) (PAMAM) y otros. El principio común de la transfección con polímeros catiónicos implica la formación de complejos de ADN en condiciones de pH fisiológico para evitar su degradación por la DNasa. Posteriormente, estos complejos se adhieren a la membrana celular y son absorbidos por endocitosis, seguida de la ruptura y liberación del ADN en el citoplasma para ejercer sus funciones previstas. La principal distinción entre polímeros catiónicos y lípidos catiónicos radica en la ausencia de porciones hidrofóbicas en los polímeros catiónicos, lo que los hace completamente solubles en agua y permite modificaciones químicas convenientes.
Reactivos de transfección Hieff Trans® PEI

| Prueba Artículo | Estándar | Investigación y desarrollo Calificación (40820) | BPF Calificación (40821) |
| Aapariencia | Completo, preciso información, No daño, etc. | √ | √ |
| Transfección miEficiencia | > 70% Transfección eficiencia> 80% Celúla viabilidad | √ | √ |
| mindotoxin | < 0,5 UE/ml | √ | √ |
| Sesterilidad | Aséptico crecimiento | √ | √ |
| METROyicoplasma Residuo | norteNegativo | √ | √ |
| pH | < 7.0 | √ | |
| Osmótico PAGaasegurar | ≤ 30 MOSM/kilogramo | √ | |
| Impureza Rresiduo | METROetanol(≤ 0.3%) Etilo éter(≤ 0,5%) Metilbenceno(≤ 0,002%) | √ | |
| Pesado METROetcétera Rresiduo | ≤ 10 ppm |
| √ |
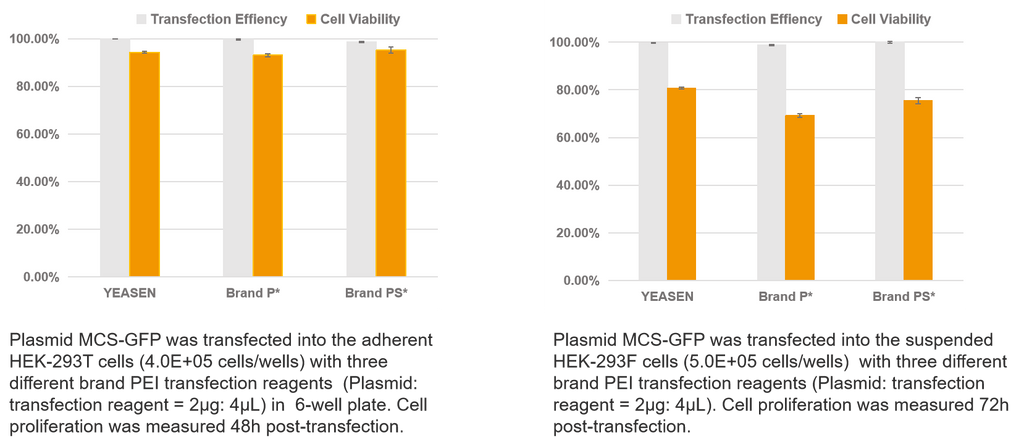
Transfección de un solo plásmido
Datos de titulación del virus
1. Producción de LV

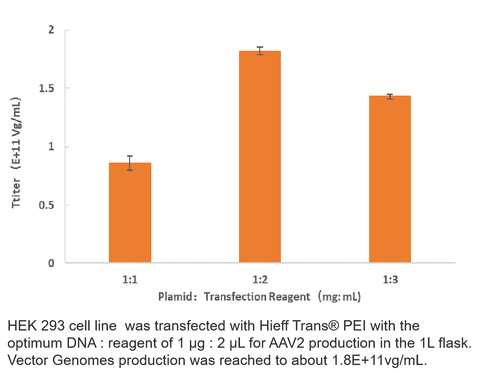
2. Producción de AAV2
3. Producción de AAV5
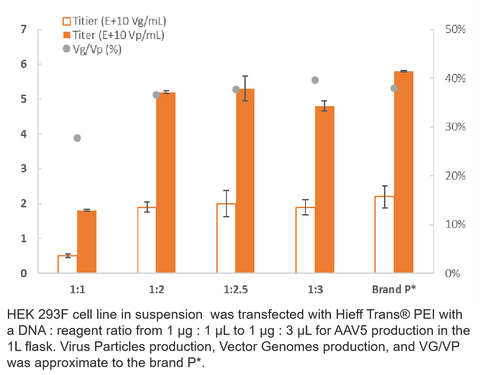
4. Producción de vehículos recreativos
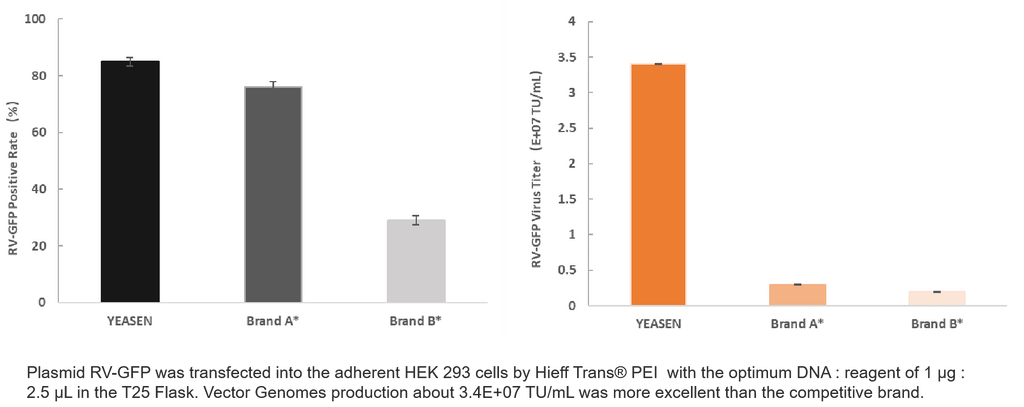
Información del producto
| Nombre del producto | Gato Nro. |
| Reactivo de transfección Hieff Trans® PEI - GMP | 40821ES |
| Kit de detección de residuos de ADN de células hospedadoras de E. coli | 41308ES |
| Kit de detección de residuos de ARN en células hospedadoras de E. coli | 41318ES |
| Kit ELISA para E. coli HCP | 36712ES |
| Kit ELISA para el diagnóstico de la hepatitis C (HCP) HEK293 | 36713ES |
| Kit de detección de residuos de ADN de células huésped HEK293 | 41302ES |
| Kit de análisis del tamaño del ADN de los residuos de células huésped HEK293 | 41316ES |
| Kit de detección de qPCR en tiempo real de micoplasma MycAway™ (2G) | 40619ES |
| UCF.ME® UltraNuclease Grado GMP | 20157ES |
| Ultranucleasa activa de sal de grado GMP | 20159ES |
| Kit ELISA de ultranucleasa | 36701ES |
| Kit ELISA de ultranucleasa activa de sal | 36703ES |
| Kit de detección de número de copias RCA (E1A) | 41321ES |
| Kit de detección de lentivirus con capacidad de replicación (RCL) | 41311ES |
| Kit de preparación de muestras de ADN residual magnético MolPure™ | 18461ES |
