HCD/HCP

高敏性,FG級,殘留DNA檢測試劑盒,用於生物產品的質量控制
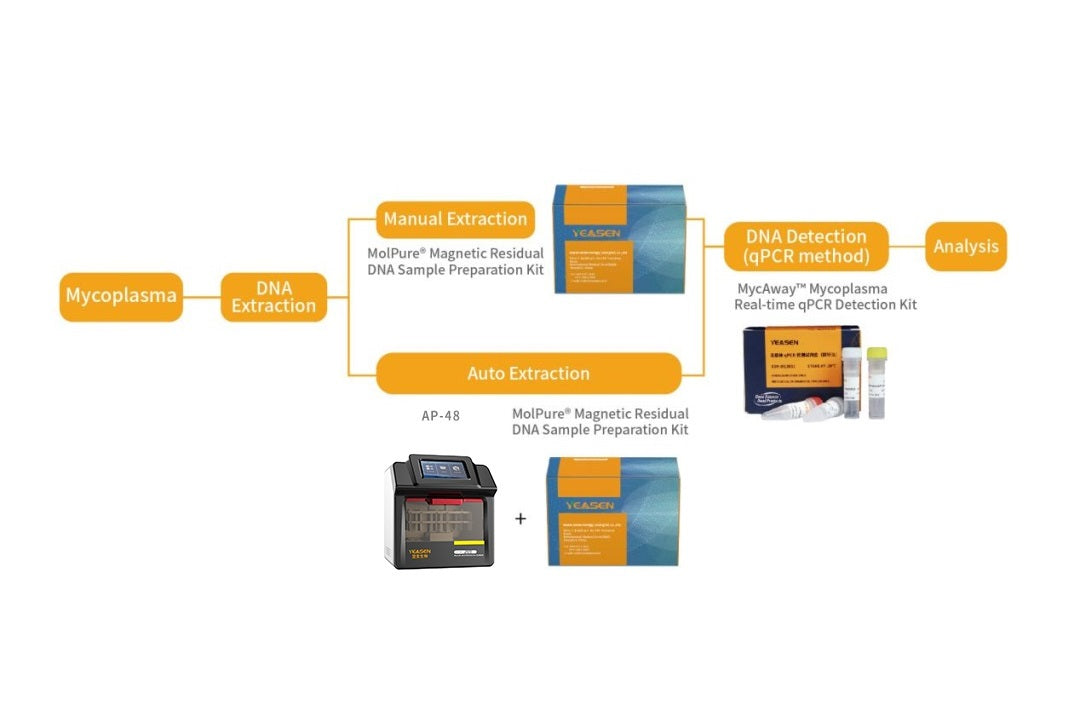
概述 宿主細胞殘留DNA是生物製劑生產過程中涉及的製程相關雜質,不僅會降低生物製劑的有效性,還可能帶來傳染性或致瘤性等安全隱患。因此,各國監管機構都對生物製劑中殘留DNA的量進行了限制。 目前WHO和FDA的指導原則建議成品中殘留DNA不超過10ng/劑,FDA也規定生物製劑宿主細胞DNA...
Mycaway支原體實時QPCR檢測套件(2G)驗證報告
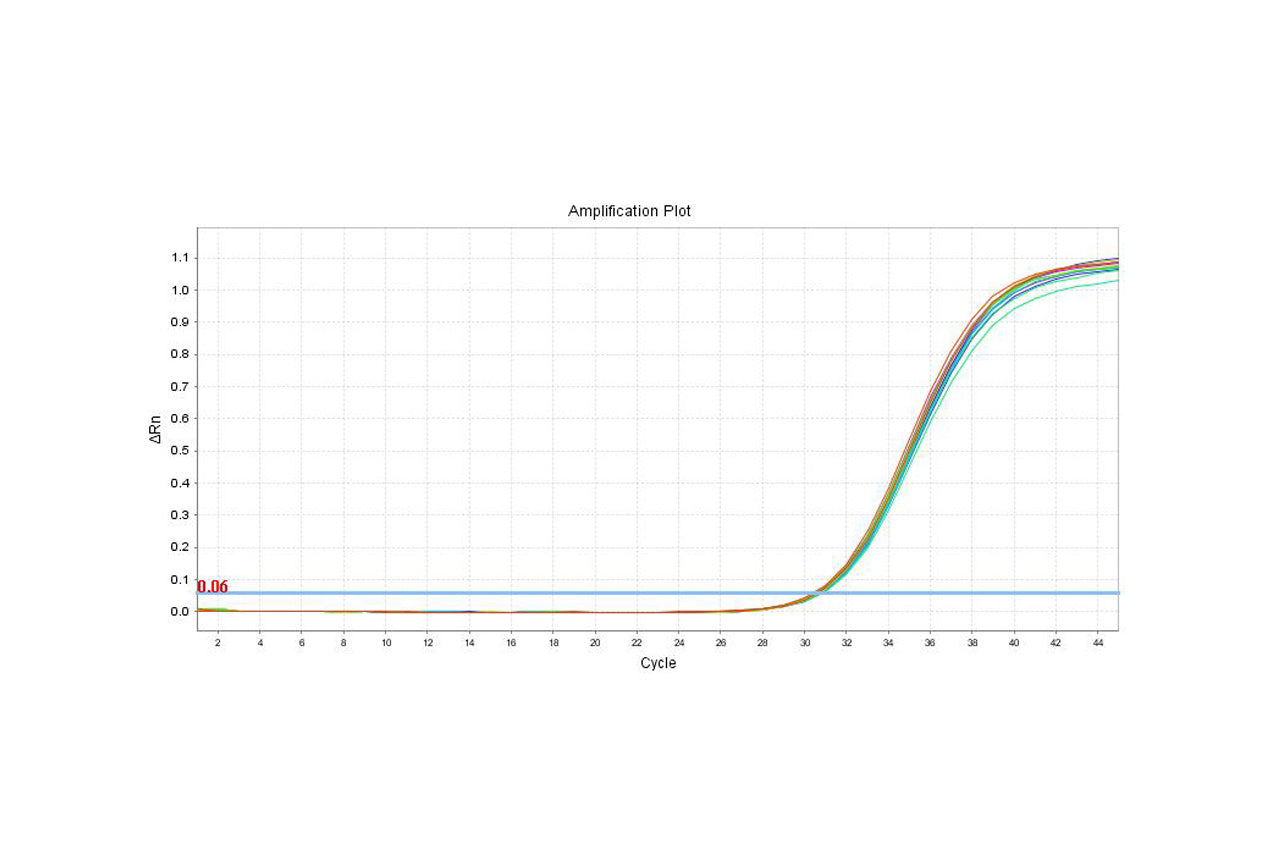
背景 本報告中總結的數據由 Yeasen 生物技術(上海)有限公司(MycAway)商標 支原體即時螢光定量PCR檢測試劑盒(2G) 產品。 彙總資料僅供使用者參考,使用者需以自己的樣本對支原體方法進行驗證,確認該方法能否滿足使用者的要求。建議所有使用該試劑盒的實驗...
CHO宿主細胞DNA殘基檢測試劑盒(3G)驗證報告
膽固醇 宿主細胞DNA殘留檢測試劑盒 (3)格) 資格概要(編號: 41332ES60) 背景 本報告中總結的數據由 Yeasen CHO 生物技術 宿主細胞DNA殘留檢測試劑盒(3G)產品。匯總資料僅供用戶參考,用戶需自行驗證宿主細胞殘留 DNA方法透過使用自己的樣本來...
HEK293宿主細胞DNA殘基檢測試劑盒(3G)驗證報告
HEK293 宿主細胞DNA殘留檢測試劑盒 (3)格) 資格摘要(類別編號:41331ES60) 背景 本報告中總結的數據由 Yeasen 'HEK293 的生物技術 宿主細胞DNA殘留檢測試劑盒(3G)' 產品。匯總資料僅供用戶參考,用戶需自行驗證宿主細...
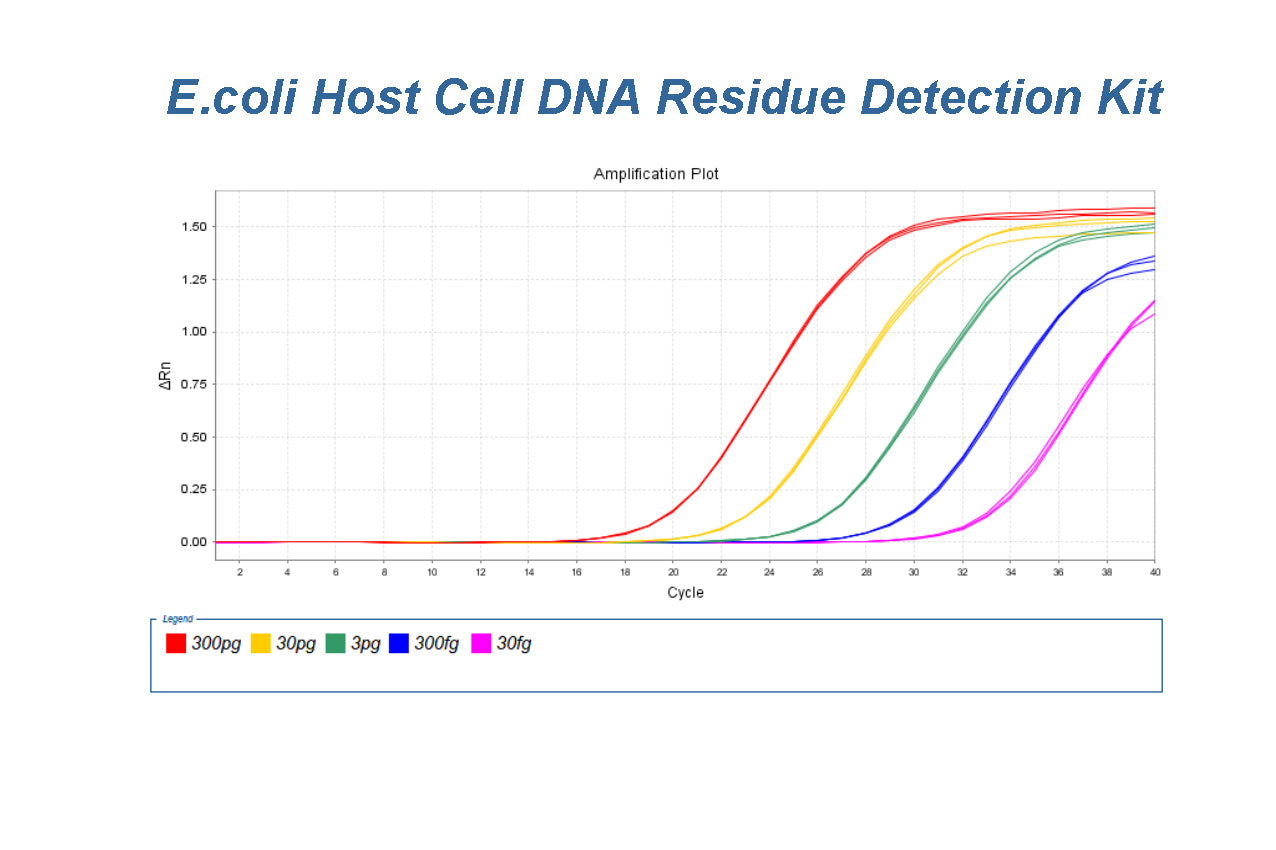
大腸桿菌宿主細胞DNA殘基檢測試劑盒(2G)驗證報告
大腸桿菌 宿主細胞DNA殘留檢測試劑盒 (2G) 資格摘要(類別編號:41308ES60) 背景 本報告中總結的數據由 Yeasen '大腸桿菌宿主細胞DNA殘留檢測試劑盒(2G)'產品的生物技術。匯總資料僅供用戶參考,用戶需自行驗證宿主細胞殘留 DNA方...

分枝桿菌QPCR檢測和方法驗證有助於細胞和基因治療技術開發的發展
近年來,隨著生物醫藥的快速發展,新冠肺炎疫情下細胞和基因治療的興起,以及mRNA疫苗的問世,確保生物製品的安全可靠已成為世界各國政府和監管機構關注的重點。支原體污染是一種常見但通常很難消除的污染類型。監管要求強制要求涉及細胞培養的生物過程「確保不受支原體污染」。 監管機構對支原體檢測的要求...

宿主細胞殘留DNA檢測試劑盒有助於生物製劑和製造
宿主細胞殘留DNA是生物製劑生產過程中涉及的製程相關雜質,不僅會降低生物製劑的有效性,還可能帶來傳染性或致瘤性等安全隱患。因此,各國監管機構都對生物製劑中殘留DNA的量做了限制。 目前WHO和美國FDA的指導原則建議成品中殘留DNA不得高於10ng/劑,美國FDA也指出生物製品宿主細胞內殘留D...

