Der rasante Fortschritt der Biotechnologie hat durch die Entwicklung von mRNA-Impfstoffen, die mithilfe der In-vitro-RNA-Synthesetechnologie hergestellt werden, einen tiefgreifenden Einfluss auf die Bekämpfung von Infektionskrankheiten wie COVID-19 gehabt. Zahlreiche Unternehmen, darunter Moderna in den USA, CureVac in Deutschland und BioNTech in Deutschland, haben nicht nur therapeutische mRNA-Impfstoffe entwickelt, sondern auch Behandlungen für Erkrankungen wie Tumore, Infektionskrankheiten und chronische Krankheiten.
Für die Erforschung und Formulierung von mRNA-Impfstoffen ist eine breite Palette von Rohstoffen erforderlich, um ihre erfolgreiche Entwicklung zu gewährleisten. Als Pionier in der Molekularenzymindustrie hat
Um sowohl Produktqualität als auch Produktionskapazität zu gewährleisten, hat
1. Vorteile von GMP
2.
3.
4. Anwendungsszenarien von
5. Rohstoffe für die Herstellung von mRNA-Impfstoffen von
6. Bestellinformationen
1. Vorteile von GMP
„GMP-Qualität“ ist ein Markenbegriff, den
Tabelle 1. Vorteile von GMP
| Qualitätskontrollen | Forschungsniveau | GMP-Qualität |
| Tierfrei | Es dürfen auch tierische Stoffe verwendet werden | Bei Bedarf können Tierfreiheitszertifikate vorgelegt werden |
| Zellbankcharakterisierung | Weniger streng | Streng (entspricht den GMP-Vorschriften) |
| Rückverfolgbarkeitsinformationen für Rohstoffe und Fertigprodukte | Weniger streng | Streng (entspricht den GMP-Vorschriften) |
| Kontrolle des Endotoxinspiegels | / | Streng |
| Sterile Kontrolle | / | Streng |
| Chargenprotokolle für Herstellung und Prüfung | Weniger streng | Streng (Chargenprotokolle können bei Bedarf bereitgestellt werden) |
| Prozessvalidierungsbericht | / | Der Bericht kann bei Bedarf bereitgestellt werden |
| Änderungskontrollsystem | Selbsteinschätzung | Streng (entspricht den GMP-Vorschriften) |
| Qualitätsmanagementsystem | Selbsteinschätzung | ISO 13485-Zertifizierung |
| DMF-Nummer | / | Ja (Meldung) |
2. Yeasen kann Produkte in GMP-Qualität liefern
3. Yeasen erwarb DMF-Nummern für viele Produkte
Drug Master Files (DMFs) sind vertrauliche Dokumente, die freiwillig bei der US-amerikanischen Food & Drug Administration (FDA) eingereicht werden. Sie enthalten detaillierte Informationen über Einrichtungen, Prozesse oder Artikel, die bei der Herstellung, Verarbeitung, Verpackung und Lagerung von Humanarzneimitteln verwendet werden.
Die FDA prüft den technischen Inhalt eines DMF, wenn ein Hersteller eines aktiven pharmazeutischen Wirkstoffs (API) darauf verweist, um seinen Prüfantrag für ein neues Arzneimittel (IND), seinen Zulassungsantrag für ein neues Arzneimittel (NDA), seinen Zulassungsantrag für ein neues Arzneimittel (ANDA) oder seinen Exportantrag zu unterstützen. DMFs spielen bei diesen Anträgen eine entscheidende Rolle.Wenn Hersteller DMFs für bestimmte Materialien einreichen, kann der FDA-Genehmigungsprozess erheblich beschleunigt werden.
4. Anwendungsszenarien von Yeasen -Produkten
4.1 Vorlagengenerierung
Die Plasmidlinearisierung ist ein unverzichtbarer Schritt bei der Vorlagengenerierung, wenn Plasmidvektoren als Transkriptionsvorlagen verwendet werden. Da die Transkription bis zum Ende der DNA-Vorlagen fortschreitet, stellt die Plasmidlinearisierung sicher, dass RNA-Transkripte einer definierten Länge und Sequenz generiert werden.
4.2 In Vitro Transkription (IVT)
Die In-vitro-Transkription wird von verschiedenen Faktoren beeinflusst. Enzyme, Puffer und modifizierte Substrate haben alle einen großen Einfluss auf die Transkriptionseffizienz.
Basierend auf der ZymeEditor-Plattform hat YEASEN Biotech neuartige T7-RNA-Polymerasen entwickelt, die die Bildung von dsRNA während des In-vitro-Transkriptionsprozesses (IVT) deutlich reduzieren (T7-RNA-Polymerase, niedrige ds-RNA, 250 U/μL). Es verringert die Immunogenität von mRNA erheblich und verbessert bis zu einem gewissen Grad die Integrität von mRNA. Es wird erwartet, dass diese Entwicklung eine entscheidende Rolle bei der Weiterentwicklung von mRNA-Impfstoffen und Krebsmedikamenten spielen wird.

Durch Optimierung des Puffers und Anpassung des Salztyps des Nukleotidsubstrats konnten wir die Effizienz der Transkription erheblich verbessern und die Produktion von dsRNA reduzieren.

Abbildung 2. Tris NTP kann die lVT-Effizienz erheblich steigern und die dsRNA-Produktion reduzieren
4.3 mRNA-Capping
Da eine 5'-Cap-Struktur die Immunogenität verringert und für eine effiziente Translation von mRNAs erforderlich ist, ist das Hinzufügen von Cap-Strukturen an den 5'-Enden der durch Transkription erzeugten mRNA notwendig.
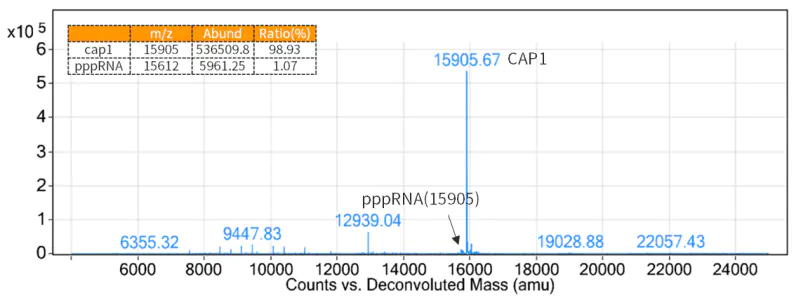
Abbildung 3. Ergebnisse der Cap-Rate-Erkennung (LC-MS-Erkennung)
4.4 mRNA-Reinigung
Die Reinigung ist ein unverzichtbarer Schritt zur Gewinnung hochreiner mRNAs.
5. Rohstoffe für die Herstellung von mRNA-Impfstoffen von Yeasen
Derzeit kann
Tabelle 2.Rohstoffe für die Herstellung des mRNA-Impfstoffs bereitgestellt von
| Vorlagenvorbereitung | In-vitro-Transkription | ||
| 10164ES | 10623ES | ||
| 10122ES | 10625ES | ||
| 10922ES | 10672ES | ||
| 10300ES | 10621ES | ||
|
| 10611ES | ||
| 10661ES | 10133ES | ||
| RNAse R (20 U/uL) | 14615ES | 10650ES | |
| Xba ich | 10662ES | 10651ES | |
| Deckelung |
| Reinigung |
|
| 10614ES | 12602ES | ||
| 10612ES | Magnetisches Trenngestell | 80460ES | |
| 10619ES | 36717ES | ||
| 10681ES |
| ||
6. Bestellinformationen
Nachfolgend sind repräsentative Produkte von
Tabelle 3. Bestellinformationen
Zum Thema Lesen:
GMP-Reagenzien für die mRNA-In-vitro-Synthese
DNase I und ihre Anwendungen in der Biomedizin
Quellen:
[1] Chaudhary, N., Weissman, D., & Whitehead, KA (2021). mRNA-Impfstoffe gegen Infektionskrankheiten: Prinzipien, Bereitstellung und klinische Umsetzung. Nature-Rezensionen. Arzneimittelforschung, 20(11), 817–838.
[2] Vogel, AB et al. Selbstverstärkende RNA-Impfstoffe bieten gleichwertigen Schutz gegen Influenza wie mRNA-Impfstoffe, aber
bei viel niedrigeren Dosen. Molecular therapy : the journal of the American Society of Gene Therapy 26, 446-455,
[3] Fuchs, AL, Neu, A. & Sprangers, R. Eine allgemeine Methode zur schnellen und kostengünstigen Produktion von 5'
capped RNA. RNA (New York, NY) 22, 1454-1466, doi:10.1261/rna.056614.116 (2016).
[4] Schmid, A.Überlegungen zur Herstellung von mRNA-Impfstoffen für klinische Studien. Methods in molecular biology (Clifton, NJ) 1499, 237-251,
[5] Banerji, A. et al. mRNA-Impfstoffe zur Vorbeugung der COVID-19-Erkrankung und gemeldete allergische Reaktionen: Aktuelle Erkenntnisse und empfohlener Ansatz. Das Journal für Allergie und klinische Immunologie. In der Praxis 9, 1423-1437,
[6] Richner, JM et al. Modifizierte mRNA-Impfstoffe schützen vor einer Infektion mit dem Zika-Virus. Cell 168, 1114-1125.e1110,
[7] Corbett, KS et al. SARS-CoV-2 mRNA-Impfstoffdesign ermöglicht durch Prototyp-Erregervorbereitung. Nature 586,567-571,
[8] Corbett, KS et al. mRNA-1273 schützt vor einer SARS-CoV-2-Beta-Infektion bei nichtmenschlichen Primaten. Nature Immunology 22, 1306-1315,
[9] Keech, C. et al. Phase 1-2-Studie eines rekombinanten SARS-CoV-2-Spike-Protein-Nanopartikel-Impfstoffs. The New England Journal of Medicine 383, 2320-2332,
[10] Kramps, T. & Elbers, K. Einführung in RNA-Impfstoffe. Methoden der Molekularbiologie (Clifton, NJ) 1499, 1-11,
[11] Linares-Fernández, S., Lacroix, C., Exposito, JY & Verrier, B. Anpassung des mRNA-Impfstoffs zur Balance zwischen angeborener und adaptiver Immunantwort. Trends in molecular medicine 26, 311-323,
